Indice del volumen
Volume index
Comité Editorial
Editorial Board
Comité Científico
Scientific Committee
SÍNDROME NEUMORRENAL: HEMORRAGIA PULMONAR CON GLOMERULONEFRITIS ENDO-EXTRACAPILAR SIN EVIDENCIA DE ANTICUERPOS ANTI MEMBRANA BASAL GLOMERULAR
(SÍNDROME GOODPASTURE PROBABLE INMUNE).
Ernesto Moro Rodríguez y Enrique Niembro de Rache
Facultad Ciencias de la Salud. Universidad Rey Juan Carlos. Alcorcón
Hospital General Universitario 'Gregorio Marañón'. Madrid. España
jemoro @ uninet.edu
Rev Electron Biomed / Electron J Biomed 2003;1(1):25-31. pdf
.- Cambios mínimos: 19 (21.59%)
- Segmentarias y focales: 24 (27.27%)
- Esclerosis glomerular, focal, segmentaria y global: 2 (2.27%)
- Extramembranosas: 16 (18.18 %)
- Con proliferación endocapilar: 6 (6.81%)
- Con proliferación endo-extracapilar: 17 (19.31%)
- Membranoproliferativas: 4 (4.45%)
- 2A) Probable no inmune:
ENFERMEDAD DEL LEGIONARIO Y HEMORRAGIA PULMONAR UREMICA. - 2B) Probable inmune:
GLOMERULONEFRITIS CON SEMILUNAS SIN EVIDENCIA DE ACS-ANTIMBG O COMPLEJOS INMUNES. - 6A.) HEMORRAGIA PULMONAR IDIOPÁTICA
- 6B.) DESORDENES DE SANGRADO
- 6C.) DAÑO ALVEOLAR AGUDO
- 6D.) MISCELANEA: ASPIRADOS, ESTENOSIS MITRAL, TRAUMA etc.
Revisión de Dr. Roberto Cuan Ravinal. Departamento de Patologia. Faculdade de Medicina de Ribeirão Preto. Universidade de São Paulo. Brasil
Revisión de Dr. Ernesto Hoffmann. Louisiana State University Medical Center. New Orleans, Louisiana. USA
Introducción:
El Síndrome de Goodpasture fue reconocido por primera vez Goodpasture en 1919 en un paciente de diez y ocho años de edad que padeció de forma aguda hemoptisis y hematuria, poco después de recobrarse de una gripe. Desde entonces este tipo de patología, sin ser muy frecuente, ha quedado bien tipificada y se han sucedido numerosos trabajos que han buscado esclarecer su patogenia y su tratamiento más adecuado.
Si bien han sido muchos los progresos que nos han permitido comprender mejor este síndrome, sigue sin determinarse de forma concluyente su etiopatogenia, pese a que diversos agentes, como la inhalación de hidrocarburos volátiles o el virus de la gripe, han sido estrechamente implicados.
El síndrome de Goodpasture se suele presentar entre los 16-30 años de edad. Se reconoce que las manifestaciones pulmonares usualmente preceden a una enfermedad renal evidente. La clínica inicial está dominada en un 95% por la hemoptisis, disnea para el ejercicio, debilidad, fatiga, Hb < 12 g/dl, Leucocitosis > 10.000 mm3, proteinuria, y moldes de células rojas y blancas en el urograma.
La etiología del síndrome de Goodpasture permanece desconocida, aunque frecuentemente se precede de una infección pulmonar o enfermedad viral-like. También se ha involucrado con la exposición a hidrocarburos y administración de Penicilamina (Sternlieb, 1975)
Rees y col. en 1984, demostraron un incremento del haplotipo HLA-D'33 en estos pacientes, y un ligero incremento en el HLA-B7. Estos pacientes presentan una enfermedad renal más severa, con concentraciones más altas de creatinina en suero.
En cuanto a la naturaleza del antígeno que inicia la producción de anticuerpos en el síndrome de Goodpasture, ha sido objeto de considerables controversias. El colágeno y antígenos no colagénicos de la lámina basal epitelial han sido relacionados como los antígenos inmunogénicos de éste Síndrome (Wieslander, 1984; Fish, 1984).
Estos estudios sugieren que los antígenos pertenecerían a una glucoproteina no colagénica polar, componente del colágeno IV. Sisson et al. en 1982, con técnicas inmuno-ultraestructurales localizaron el antígeno del Síndrome de Goodpasture en la lámina rara interna de la membrana basal del glomérulo, aunque Yaar et al en el mismo año describen depósitos tanto en la lámina rara interna como en la lámina rara externa cuando utilizan anticuerpos anti-colágeno tipo IV.
Wieslander et al en sus trabajos publicados en 1985 en busca de ésta localización estima que el antígeno del Síndrome de Goodpasture se encuentra en la región globular dominante del colágeno tipo IV. El antígeno de este síndrome se encuentra secuestrado en una forma hexamérica y no reacciona con el anticuerpo hasta que este hexámero se disocia y el antígeno se expone.
Caso Clínico:
En las exploraciones complementarias se descubre hipoxia, (pO2 55, FiO2 0.21), infiltrados alveolares bilaterales difusos en la radiografía de tórax, adenopatías mediastínicas, anemia microcítica intensa (Hb 4.4, VCM 69, 419000 plaquetas, 12400 leucocitos, 85S, 3C, 10L, 2M. Coagulación normal: PTT 25', AP 73%, fibrinógeno 538), microhematuria y función renal normal (Cr 1.03, ura 33).
Estudios inmunológicos: ANA, anticuerpos antimúsculo liso, antimitocondriales, antimembrana basal glomerular, factor reumatoide e inmunocomplejos circulantes fueron todos negativos. C3 183, C4 23, y FB 58 proteína C reactiva 64, Aslo 174. Fibronoscopia sin lesiones transbronquiales. Ecocardiograma sin alteraciones.
Datos microbiológicos: HIV, marcadores del virus B de la hepatitis, hemocultivos (excepto 2/3 con Staph coagulasa negativo en la última semana), cultivo de secreciones bronquiales, urocultivo, serología de Legionella, citomegalovirus, Herpes virus, Epstein-Barr e IFD a legionella en secreciones bronquiales todos negativos.
Se sospecha sobreinfección por la presencia de fiebre y leucocitosis elevada realizándose tratamiento con varios regímenes antibióticos sin resultados.
Glomerulonefritis: durante los primeros días presentó microhematuria, proteinuria (1.5 gr/día), posteriormente aparecen cilindros hemáticos y progresivamente insuficiencia renal parenquimatosa que precisa diálisis peritoneal (el 19º día desde el ingreso).
Bioquímica: úrico 4.5, colesterol 137, triglicéridos, bilirrubina total 2,4 (directa 1,4), GOT 17, GPT 23, fosfatasa alcalina 124, LDH 272.
Anemia: Fueron necesarias transfusiones de hematíes en múltiples ocasiones (25 u. en los 27 días de estancia). Extendidos de sangre periférica (a los 11 días del ingreso): anisocitosis marcada con abundante microcitos hipocromos. Reticulocitos 5.3%, haptoglobina 11, sideremia 122, transferrina 107, ferritina >1000. Coombs directo e indirecto negativos. Resto de series normales.
Fallece a los 27 días de ingreso tras bradicardia.

Pulmón izquierdo: Imagen macroscópica en la que se observa extensa hemorragia intrapulmonar. |
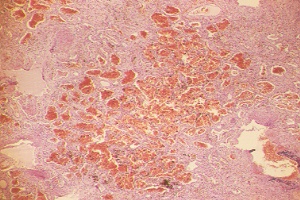
Histología pulmón. Tinción H-E. 100x |
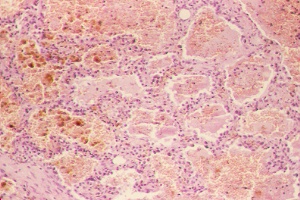
Histología del pulmón. Hemorragia y distress respiratorio. Tinción H-E. 400x |
Comentarios:
Siguiendo el informe clínico transcrito más arriba, el paciente en cuestión, de 21 años de edad y previamente sano, cursó inicialmente con un cuadro de dos meses de evolución, en el que destacaban principalmente episodios de disnea y ocasionales esputos hemoptoicos.
Con tan sólo los dos signos iniciales, un diagnóstico diferencial general a considerar incluiría: Tuberculosis pulmonar, bronquiectasias, embolismo pulmonar, fallo cardiaco congestivo, neumonía, endocarditis, absceso pulmonar, edema pulmón y carcinoma de pulmón.
Haciendo un diagnóstico diferencial de exclusión, en base a la edad del paciente y al hecho de que con anterioridad a estas manifestaciones se encontraba sano, podríamos descartar los diagnósticos de: Bronquiectasias (en sus variedades congénitas, y las que concurren con asma bronquial atópico, o con fenómenos infecciosos necrosantes), embolismo pulmonar (al ser una patología propia de pacientes de mayor edad en relación con la formación de trombos en el sistema venoso profundo de extremidades inferiores), endocarditis y fallo cardiaco congestivo (al no haber enfermedad cardiaca previa y no tratarse de una persona adicta a drogas por vía parenteral o alcohólico crónico), y carcinoma pulmonar (en base al hecho de que las neoplasias pulmonares en adultos jóvenes son poco frecuentes. En éste sentido Roviaro et al. en 1985, sobre una serie de 1514 casos de neoplasias pulmonares evaluaron una incidencia del 10% de estos tumores entre los 11 y 45 años de edad, considerándolos como raros antes de los 20 años.
Según estas consideraciones el paciente padecería un cuadro neumónico, una tuberculosis pulmonar (que no puede descartarse todavía en nuestros días pese a que se estime que declina cada año su incidencia en España a cifras entre 6-8% según Durán, 1987), un absceso pulmonar (por un supuesto aspirado bucofaríngeo, o por infección pulmonar debida a K. pneumoniae, bacilos entéricos Gram negativos, S. aureus o anaerobios) o edema pulmonar (siempre en consideración dada la larga lista de causas no cardiogénicas que lo ocasionan, incluyendo una forma neurogénica, exposición a agentes tóxicos ambientales o espontáneos, infecciones pulmonares difusas, broncoaspirados, etc.).
El cuadro que motiva el ingreso del paciente refleja, sobre los dos signos iniciales de disnea y hemoptisis, se añade la presencia de dolor torácico, fiebre de 38º, palidez, estertores crepitantes, hepatomegalia, hipoxia, infiltrados alveolares bilaterales difusos en la radiografía de tórax, adenopatías mediastínicas, anemia microcítica intensa y microhematuria.
Sobre esta clínica podría considerarse todavía un diagnóstico diferencial que incluría: Neumonía, Tuberculosis pulmonar, y edema de pulmón. Descartando el absceso pulmonar ante la imagen radiográfica de infiltración alveolar difusa.
En base al diagnóstico radiológico la ocupación de espacio alveolar difusa bilateral puede ser edematosa, purulenta o hemorrágica. Los diagnósticos de tuberculosis pulmonar y neumonía (que en este caso dado sería bilateral), bajo la imagen radiológica descrita, se ponen en entre dicho. Tras esto: Se comienza a establecer una sospecha de hemorragia pulmonar.
Durante su ingreso se intenta precisar la etiología, descartando toda una batería de agentes infecciosos. Tampoco responde a distintos regímenes antibióticos, instaurados por la presencia de fiebre y leucocitosis elevada, evolucionando con insuficiencia respiratoria que obliga a su ventilación mecánica. En el intento de controlar la hipoxemia se provoca un neumotórax bilateral que es drenado, al tiempo que va desarrollándose un distress respiratorio que imposibilita su desentubación.
Los estudios inmunológicos no resultan concluyentes. Todas las pruebas realizadas fueron negativas.
La patología cardiovascular y la presencia de lesiones traqueobronquiales quedan descartadas ante los informes negativos de las pruebas ecocardiográficas y fribonoscópias. El aspirado del lavado broncoalveolar descubre macrófagos alveolares cargados de hemosiderina, lo que ayuda a sustentar aún más un proceso hemorrágico pulmonar encuadrable en los Grupos 6A o 2 de la clasificación de Albelda, 1985. Según esta sospecha se hace un tratamiento adecuado a esta patología (corticoides y sesiones de plasmaféresis), desestimando las biopsias pulmonares o renales por su agresividad en un paciente comprometido. El día 19 de su ingreso desarrolla una clara insuficiencia renal que precisa de diálisis peritoneal y el paciente acaba falleciendo tras bradicardia el día 27 después de su ingreso.
El estudio de la necropsia confirma el juicio
diagnóstico clínico de Hemorragia pulmonar y Síndrome de Distress
Respiratorio del Adulto. Además, el principal hallazgo con el que se concluye en estimar que se trata de un Síndrome de Goodpature, es el hallazgo de un patrón lineal de IgG a nivel de la membrana basal glomerular.
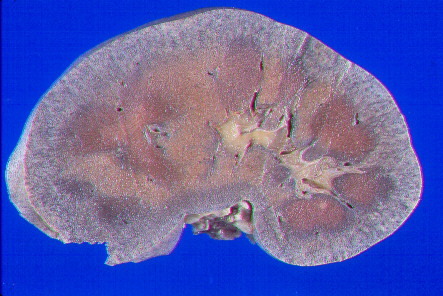
Riñón. Imagen macroscópica |
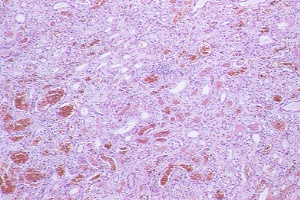
Histología del riñón. Tinción H-E |
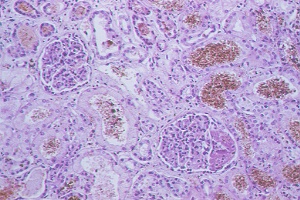
Histología del riñón. Tinción H-E |
|
|
Encuadrando la glomerulonefritis endo-extracapilar diagnosticada de la autopsia que hemos presentado dentro de la incidencia de glomerulonefritis que en el mismo año estudiamos en el Departamento de Anatomía Patológica del Hospital General Universitario Gregorio Marañón, tenemos que de 88 casos de glomerulonefritis fueron:
Del total de biopsias procedentes de fibronoscopia entre los años 85 al 90, el diagnóstico de hemorragia pulmonar fue emitido en tan sólo 5 ocasiones. Lo que habla por un lado, de la escasa práctica que el clínico hace de esta prueba como medio diagnóstico en el síndrome en cuestión, pese a la posibilidad de poder hacer estudios de inmunofluorescencia; y de otro de la escasa frecuencia del mismo.
En el caso presentado, sin embargo, hay una discrepancia evidente entre los hallazgos de inmunofluorescencia encontrados en los especimenes de la necropsia y los estudios inmunológicos practicados. La respuesta a esta duda parece difícil dado que ambos datos se contradicen, y no se encuentra razón alguna que lo justifique. Puestos a aventurarnos cabría pensar que las titulaciones en sangre fueron lo suficientemente bajas como para dar el test realizado como negativo. Además, esto explicaría que las lesiones glomerulares encontradas en la necropsia tan sólo alcanzaban a un 10% de los mismos, mostrando estadios iniciales fibrinoepiteliales de glomerulonefritis endo-extracapilar sin fibrosis.
Con respecto a estas discrepancias entre los estudios de inmmunofluorescencia sobre tejidos y las pruebas en suero, Zimmerman et al. en 1979 observaron el hecho contrario, es decir, que en algunos casos de enfermedad pulmonar hemorrágica, con Acs citotóxicos demostrables en el suero, no se observó la enfermedad renal. El autor carecía de respuesta a esta evidencia.
El diagnóstico diferencial de las hemorragias pulmonares difusas ha sido bien estudiado por Albelda et al., 1985. Este autor clasifica las hemorragias pulmonares en los siguientes grupos:
- GRUPO 1 Hemorragia pulmonar con glomerulonefritis y anticuerpos anti-MBG:
ENFERMEDAD DE GOODPASTURE CLÁSICA.
GRUPO 2 Hemorragia pulmonar con enfermedad renal sin anomalía inmune:
GRUPO 3 Hemorragia pulmonar con
glomerulonefritis y enfermedad por complejos inmunes:
LUPUS ERITEMATOSO. GRANULOMATOSIS DE WEGENER, CRIOGLOBULINEMIA, PURPURA HENOCH-SCHÖNLEIN, ENFERMEDADES DEL TEJIDO CONECTIVO, VASCULITIS SISTEMICAS.
GRUPO 4 Hemorragia pulmonar, y complejos inmunes:
LUPUS ERITEMATOSO, GRANULOMATOSIS DE WEGENER, VASCULITIS SISTEMICAS.
GRUPO 5 Hemorragia pulmonar, anticuerpos anti-MBG sin enfermedad glomerular:
ISQUEMIAS VARIANTE DE GOODPASTURE O FORMA INICIAL DEL SUERO.
GRUPO 6
Bibliografía:
Albelda SM, Gefter WB, Epstein DM, Miller WT. Diffuse pulmonary hemorrhage: a review and classification. Radiology. 1985; 154:289-297
Beirne GJ, Wagnild JP, Zimmerman SW, Macken PD, Burkholder PM. Idiopathic crescentic glomerulonephritis. Medicine (Baltimore). 1977; 56:349-381
Briggs WA, Johnson JP, Teichman S, Yeager HC, Wilson CB. Antiglomerular basement membrane antibody-mediated glomerulonephritis and Goodpasture's syndrome. Medicine (Baltimore). 1979;58:348-361
Durán R. Tratamiento de la Tuberculosis Pulmonar. Información Terapéutica de la Seguridad Social 1987; Vol 11 Nº 1:8
Fish AJ, Lockwood MC, Wong M, Price RG. Detection of Goodpasture antigen in fractions prepared from collagenase digests of human glomerular basement membrane. Clin Exp Immunol. 1984;55:58-66
Goldstein J, Weil J, Liel Y. Intrapulmonary hemorrhages and immune complex glomerulonephritis masquerading as Goodpasture's syndrome. Hum Pathol. 1986;17:754-757
Goodpasture E.W. The Significance of Certain Pulmonary Lesions in Relation to the Etiology of Influenza. Am J Med Sci 1919; 158:863
Gunnarsson A, Hellmark T, Wieslander J. Molecular properties of the Goodpasture epitope. J Biol Chem. 2000;2 75:30844-30848
Hellmark T, Segelmark M, Unger C, Burkhardt H, Saus J, Wieslander J. Identification of a clinically relevant immunodominant region of collagen IV in Goodpasture disease. Kidney Int. 1999; 55:936-944
Hellmark T, Burkhardt H, Wieslander J. Goodpasture disease. Characterization of a single conformational epitope as the target of pathogenic autoantibodies. J Biol Chem. 1999; 274:25862-25868
Hellmark T, Segelmark M, Wieslander J. Anti-GBM antibodies in Goodpasture syndrome; anatomy of an epitope. Nephrol Dial Transplant. 1997; 12:646-648
Kalluri R, Wilson CB, Weber M, Gunwar S, Chonko AM, Neilson EG, Hudson BG. Identification of the alpha 3 chain of type IV collagen as the common autoantigen in antibasement membrane disease and Goodpasture syndrome. J Am Soc Nephrol. 1995; 6:1178-1185
Klassen J, Elwood C, Grossberg AL, Milgrom F, Montes M, Sepulveda M, Andres GA. Evolution of membranous nephropathy into anti-glomerular-basement-membrane glomerulonephritis. N Engl J Med. 1974; 290:1340-1344
Kondo N, Tateno M, Yamaguchi J, Yoshiki T, Itoh T, Kawashima N, Kataoka K. Immunopathological studies of an autopsy case with Goodpasture's syndrome and systemic necrotizing angiitis. Acta Pathol Jpn. 1986; 36:595-604
Wu MJ, Rajaram R, Shelp WD, Beirne GJ, Burkholder PM. Vasculitis in Goodpasture's syndrome. Arch Pathol Lab Med. 1980; 104:300-302
Morita T, Suzuki Y, Churg J. Structure and development of the glomerular crescent. Am J Pathol. 1973;72:349-368
Morrin PA, Hinglais N, Nabarra B, Kreis H. Rapidly progressive glomerulonephritis. A clinical and pathologic study. Am J Med. 1978;65:446-460
Penades JR, Bernal D, Revert F, Johansson C, Fresquet VJ, Cervera J, Wieslander J, Quinones S, Saus J. Characterization and expression of multiple alternatively spliced transcripts of the Goodpasture antigen gene region. Goodpasture antibodies recognize recombinant proteins representing the autoantigen and one of its alternative forms. Eur J Biochem. 1995; 229:754-760
Phelps RG, Rees AJ. The HLA complex in Goodpasture's disease: a model for analyzing susceptibility to autoimmunity. Kidney Int. 1999;56:1638-1653
Rees AJ, Peters DK, Amos N, Welsh KI, Batchelor JR. The influence of HLA-linked genes on the severity of anti-GBM antibody-mediated nephritis. Kidney Int. 1984;26:445-450
Rosenblatt SG, Knight W, Bannayan GA, Wilson CB, Stein JH. Treatment of Goodpasture's syndrome with plasmapheresis. A case report and review of the literature. Am J Med. 1979;66:689-696
Roviaro GC, Varoli F, Zannini P, Fascianella A, Pezzuoli G. Lung cancer in the young. Chest. 1985;87:456-459
Salvidio G, Garibotto G, Saffioti S, Pontremoli R. Good therapeutical response of Goodpasture's syndrome with severe renal failure. Nephron. 1989; 52:285
Saxena R, Bygren P, Arvastson B, Wieslander J. Circulating autoantibodies as serological markers in the differential diagnosis of pulmonary renal syndrome. J Intern Med. 1995; 238:143-152
Saxena R, Bygren P, Rasmussen N, Wieslander J. Circulating autoantibodies in patients with extracapillary glomerulonephritis. Nephrol Dial Transplant. 1991; 6:389-397
Sisson S, Dysart NK, Jr., Fish AJ, Vernier RL. Localization of the Goodpasture antigen by immunoelectron microscopy. Clin Immunol Immunopathol. 1982; 23:414-429
Sternlieb I, Bennett B, Scheinberg IH. D-penicillamine induced Goodpasture's syndrome in Wilson's disease. Ann Intern Med. 1975; 82:673-676
Walker RG, Scheinkestel C, Becker GJ, Owen JE, Dowling JP, Kincaid-Smith P. Clinical and morphological aspects of the management of crescentic anti-glomerular basement membrane antibody (anti-GBM) nephritis/Goodpasture's syndrome. Q J Med. 1985; 54:75-89
Westman KW, Bygren PG, Eilert I, Wiik A, Wieslander J. Rapid screening assay for anti-GBM antibody and ANCAs; an important tool for the differential diagnosis of pulmonary renal syndromes. Nephrol Dial Transplant. 1997; 12:1863-1868
Wieslander J, Bygren P, Heinegard D. Isolation of the specific glomerular basement membrane antigen involved in Goodpasture syndrome. Proc Natl Acad Sci U S A. 1984; 81:1544-1548
Wieslander J, Heinegard D. The involvement of type IV collagen in Goodpasture's syndrome. Ann N Y Acad Sci. 1985; 460:363-374
Wieslander J, Langeveld J, Butkowski R, Jodlowski M, Noelken M, Hudson BG. Physical and immunochemical studies of the globular domain of type IV collagen. Cryptic properties of the Goodpasture antigen. J Biol Chem. 1985; 260:8564-8570
Whitworth JA, Morel-Maroger L, Mignon F, Richet G. The significance of extracapillary proliferation. Clinicopathological review of 60 patients. Nephron. 1976;16:1-19
Wilson CB, Smith RC. Goodpasture's syndrome associated with influenza A2 virus infection. Ann Intern Med. 1972; 76:91-94
Yamamoto T, Wilson CB. Binding of anti-basement membrane antibody to alveolar basement membrane after intratracheal gasoline instillation in rabbits. Am J Pathol. 1987; 126:497-505
Yaar M, Foidart JM, Brown KS, Rennard SI, Martin GR, Liotta L. The Goodpasture-like syndrome in mice induced by intravenous injections of anti-type IV collagen and anti-laminin antibody. Am J Pathol. 1982;107:79-91
Zimmerman SW, Varanasi UR, Hoff B. Goodpasture's syndrome with normal renal function. Am J Med. 1979; 66:163-171

