Indice del volumen Volume index
Comité Editorial Editorial Board
Comité Científico Scientific Committee
SÍNDROME DE APNEAS HIPOPNEAS DURANTE EL SUEÑO Y CORAZÓN
J. Terán Santos, ML. Alonso Alvarez, J. Cordero Guevara*, JM. Ayuela Azcárate**
JM. Monserrat Canal***, MJ. Coma del Corral*.
Unidad Respiratoria del Sueño, Unidad de Investigación* y Servicio de Medicina Intensiva** del
Hospital General Yagüe de Burgos. Servicio de Neumología Hospital Clínico de Barcelona***. España
jteran @ hgy.es
Rev Electron Biomed / Electron J Biomed 2005;1:72-78
Comentario del revisor, Esteban Larronde, MD. Cardiología. Ex-Jefe de Residentes del Hospital Interzonal General San Martin de La Plata. Neuquen. R. Argentina
Comentario del revisor Claudio Rabec MD. Service de Pneumologie et Réanimation Respiratoire. Centre Hospitalier et Universitaire de Dijon. Dijon, France
INTRODUCCIÓN
Las enfermedades cardiovasculares y cerebrovasculares son las enfermedades más comunes en la sociedad industrial y se han realizado grandes esfuerzos, para minimizar el impacto en la morbi mortalidad secundaria a estas enfermedades1.
Desde el punto de vista epidemiológico, numerosos estudios sugieren la existencia de una relación entre las apneas del sueño no tratadas y el deterioro en la calidad de vida, la aparición de complicaciones cardiovasculares, cerebrovasculares, accidentes de tráfico y un exceso de mortalidad2, 3.
El conocimiento médico ligado a la cronobiología ha hecho aparecer el concepto de salud "variable", vinculada a acontecimientos muchos de ellos diferentes durante el día y la noche, siendo el síndrome de apneas hipopneas del sueño (SAHS) el gran artífice, por aportar aspectos fisiopatológicos relevantes sobre un proceso que se produce fundamentalmente por la noche, pero cuyas consecuencias vemos durante el día4, 5.
Los objetivos principales de este trabajo son revisar las consecuencias fisiológicas de la apnea del sueño en el sitema cardiovascular y revisar someramente los efectos del tratamiento de esta enfermedad sobre las enfermedades cardiovasculares.
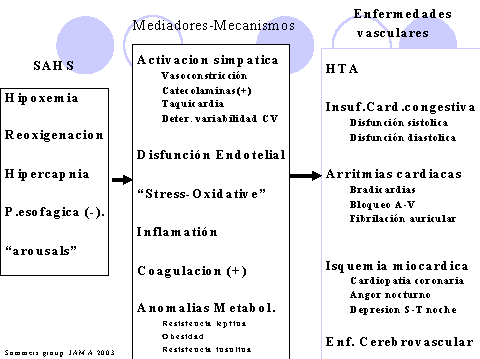
Figura 1.- Mecanismos fisiopatológicos del SAHS y enfemedad vascular
Efectos agudos de los trastornos respiratorios del sueño en el sistema cardiovascular.
En sujetos normales, la presión arterial sistémica disminuye aproximadamente un 15% durante el sueño y las reducciones más importantes se producen en sueño NREM (fase 3,4). Un fenómeno similar se produce en la frecuencia cardíaca, en la actividad del sistema nervioso autónomo y en las resistencias vasculares, condicionando todo ello un estado de "reposo hemódinamico", marcado por una disminución del gasto cardíaco.
La disminución paralela del flujo nervioso simpático y la hipoventilación central respiratoria, esta posiblemente ligada a las conexiones de neuronas simpáticas que intervienen en el control respiratorio y cardiovascular situadas en el tronco cerebral.
Por el contrario en sueño REM se produce un incremento en la actividad del sistema nervioso autónomo, en la presion arterial y en la frec cardíaca, situando su actividad en un nivel similar al de la vigilia y produciéndose por lo tanto una disociación en esta fase de sueño, entre el control respiratorio y el vascular.
En contraste con el efecto fisiológico normal del sueño en el sistema cardiovascular, las apneas producen una serie de consecuencias hemodinámicas, que incluyen hipertensión arterial pulmonar y sistémica, incremento en la poscarga ventricular y disminución del gasto cardíaco, fenómenos todos ellos resultado de la estimulación simpática, del arousal (despertar), de las alteraciones en la presión intratorácica y de la hipoxia e hipercapnia 6.
Respuesta neurohormonal
Los eventos apneicos finalizan en aumentos de la actividad nerviosa simpática, vasoconstricción e hipertensión sistémica.
La vasoconstricción sistémica se cree esta mediada por actividad alfa neural simpática, ya que en pacientes con síndrome de Shy Drager, se observan cambios mínimos en la frecuencia cardíaca o en la presión sistémica en relación a las apneas.
Por otro lado varios tipos de arritmias se pueden observar en pacientes con apneas del sueño y asi mientras las arritmias supraventriculares son la consecuencia de la alteración en el tono nerviosos simpático, las ventriculares parecen relacionarse con la hipoxia.
Arousal
El arousal es un mecanismo de defensa, que activa los musculos dilatadores de la vía aérea superior y previene la asfixia en pacientes con apneas del sueño. El grado en el que este mecanismo contribuye al aumento de actividad simpática es desconocido, tal y como se ha demostrado en el modelo animal en perros donde la inducción de apneas con y sin arousal tenian un comportamiento irregular, al igual que la presencia de respiración periódica en humanos sin arousal también induce aumentos transitorios en la frecuencia cardíaca y en la presión arterial sistémica.
Efecto de la presión intratorácica
El efecto del aumento de la presión negativa intratorácica es incrementar la presión transmural en el ventrículo izquierdo y por lo tanto la poscarga. También se produce un aumento en el retorno venoso al ventrículo derecho, llevando a su distensión y una desviación en el septo interventricular, que puede dificultar el llenado del ventrículo izquierdo.
Por otro lado existen evidencias de que la exagerada presión negativa intratorácica, puede impedir la relajación del ventrículo izquierdo contribuyendo también a empeorar su llenado. El efecto total de estos acontecimientos es la reducción del volumen latido y el gasto cardiaco, que además es proporcional a la presion negativa intratorácica existente.
Como consecuencia de todos estos cambios y de los aumentos en las catecolaminas y hormonas circulantes (peptido natriurético auricular, renina angiotensina aldosterona, etc) la presión sistémica se incrementa cíclicamente durante el sueño.
Hipoxia
Los cambios en la tension arterial de oxígeno son detectados primariamente por los cuerpos carotideos, los cuales llevan a vasoconstricción del lecho vascular y a incremento en la secreción de catecolaminas.
La vasoconstricción pulmonar se produce en respuesta a la hipoxia alveolar y en pacientes con síndrome de apneas hipopneas del sueño, los episodios recurrentes de hipoxemia durante el sueño producen incrementos repetidos de la presión en la arteria pulmonar. Sin embargo son pocos los pacientes con SAHS que desarrollan hipertensión pulmonar y esta es más frecuente en pacientes que tienen asociado hipoventilación alveolar crónica e hipercapnia7.
Enfermedad cardiovascular y síndrome de apneas hipopneas del sueño
Esta bien establecido que la hipertensión arterial conduce a enfermedad cardiovascular, después de años de exposición. Algo similar puede suceder para el síndrome de apneas del sueño. La mejor manera de investigar el impacto potencial del SAHS en el riesgo cardiovascular es utilizando estudios epidemiológicos prospectivos a gran escala y el empleo de modelos animales ya disponibles en la actualidad.
Hipertensión
La hipertensión afecta al 20% de la población adulta y es el factor de riesgo más importante para el desarrollo de enfermedad coronaria, insuficiencia cardíaca y accidentes cerebrovasculares.
En tan solo un 10% de los casos se encuentra la enfermedad subyacente y es en este contexto en el que toma especial importancia el síndrome de apneas del sueño como causa tratable de hipertensión arterial.
La relación del SAHS y la hipertensión arterial (HTA) ha sido mencionada en la literatura médica desde inicios de los ochenta. Se ha estimado que entre un 40-60% de los pacientes con SAHS son hipertensos y aproximadamente 1/3 de los pacientes con HTA padecen un SAHS. Sin embargo, esta relación ha sido ampliamente cuestionada debido a que los pacientes que sufren estas enfermedades comparten ciertas características que pueden actuar como factores de confusión (sexo, edad, asociación con obesidad, consumo de alcohol y tabaco, entre otros)8, 99.
En los pacientes con SAHS se producen aumentos cíclicos de la tensión arterial en relación con los eventos respiratorios obstructivos que acontecen durante la noche. En este hecho se hallan implicados los quimiorreceptores centrales y periféricos, barorreceptores y aferentes pulmonares, la hipoxia e hipercapnia, los aumentos en la presión negativa intratorácica y los despertares transitorios, dando lugar a una serie de cambios autonómicos, hemodinámicos y humorales, que se traducen en un efecto presor al finalizar las apneas.
No obstante, el debate radica en si estos aumentos transitorios de la tensión arterial durante la noche pueden llegar a provocar HTA sostenida durante el día. En modelos de experimentación animal se ha demostrado que durante el periodo de sueño, la hipoxia intermitente en ratas, o la oclusión intermitente de la vía aérea superior en perros da lugar a elevaciones mantenidas de la tensión arterial cuando los animales están despiertos y respirando con normalidad. En las ratas, la extirpación de los quimiorreceptores, evita el desarrollo de HTA. De estas experiencias parece obvio deducir que la hipoxia-hipercapnia y los cambios en la presión pleural son algunos de los principales mecanismos fisiopatológicos responsables del aumento del tono simpático vasoconstrictor y de la aparición de HTA diurna.
En los últimos años se ha realizado un esfuerzo considerable para demostrar la asociación entre SAHS e HTA. Este esfuerzo queda reflejado en los resultados obtenidos por los dos mayores estudios epidemiológicos realizados en población general. En ambos la presencia de HTA se asumió cuando la TA > 140/90 o se estaba recibiendo en tratamiento hipotensor. Los sujetos fueron divididos en subgrupos de gravedad en función del IAH. El estudio de Wisconsin10 es un estudio transversal con un seguimiento de 4 años (n=709), y de 8 años en un subgrupo (n=184). El Sleep Heart Health Study11, 12 es un estudio transversal (n=6841). La prevalencia de HTA y la Odds ratio de la asociación entre SAHS e HTA en los diferentes subgrupos de severidad, después de realizar un ajuste por sexo, edad, IMC, circunferencia del cuello y cintura, y consumo de alcohol y tabaco queda reflejado en la tabla 1.
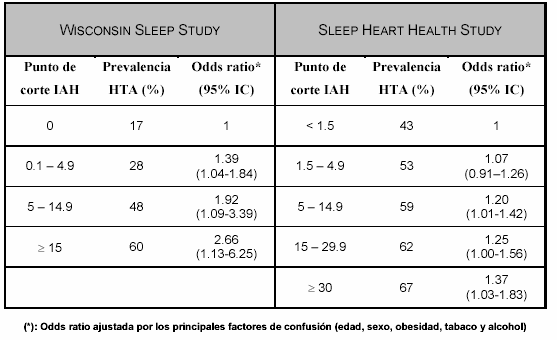
Tabla 1. Asociación entre Síndrome de Apnea-hipopnea durante el Sueño e hipertensión arterial en los grandes estudios poblacionales.
Los autores de ambos estudios concluyen que existe una asociación entre SAHS e HTA independiente de los factores de confusión, que sigue un patrón creciente de dosis / respuesta en función de la severidad del SAHS. En el estudio de Wisconsin, al con un seguimiento de 8 años, se afirma que esta relación es de causalidad. Conclusiones superponibles a las anteriores han sido publicadas por otros autores13, 14, donde además se indica que esta asociación es más relevante en personas jóvenes con normo peso. Por otro lado, también ha sido demostrado que el tratamiento con CPAP frente a placebo, disminuye las cifras de tensión arterial de forma significativa en pacientes sin HTA conocida15, 16, y que este beneficio es mayor en los pacientes con un SAHS más grave, o en aquellos que toman medicación antihipertensiva, independientemente de la cifras basales de presión arterial.
En conclusión, hemos de asumir, fuera de toda duda, que el SAHS es un factor independiente de hipertensión arterial diurna, y ello tendrá implicaciones relevantes en la salud pública.
Cardiopatía isquémica
Diversos estudios, tanto transversales como caso control, han puesto de manifiesto que la presencia de trastornos respiratorios durante el sueño son comunes en pacientes con enfermedad coronaria, en sus diversas manifestaciones, tanto en hombres como en mujeres12. Estos trabajos muestran que más de un 30% de los pacientes con cardiopatía isquémica tienen un SAHS asociado. Así, Schafer17 encuentra una alta prevalencia de SAHS en pacientes con enfermedad coronaria angiograficamente demostrada, concluyendo que la existencia de una SAHS moderado (IAH >20) es un factor de riesgo independientemente asociado con infarto miocardio (OR 2.0, IC 1.0-3.8).
Un estudio epidemiológico, observacional, multiétnico, recientemente publicado12, (Sleep Heart Health Study) evalúa la asociación entre trastornos respiratorios durante el sueño y la existencia de enfermedades cardiovasculares referidas por 6424 personas de más de 40 años de edad a las que se realiza un estudio polisomnográfico, evidenciando una asociación entre trastornos respiratorios del sueño y eventos coronarios (OR 1.27, IC 0.99-1.62), aunque más modesta que la encontrada con insuficiencia cardiaca y los accidentes cerebrovasculares.
Es importante considerar, que la asociación entre trastornos respiratorios durante el sueño y enfermedad coronaria, no implica causalidad. Los pacientes con SAHS presentan frecuentemente múltiples factores de riesgo cardiovascular. De ahí, que en la evaluación de los trastornos respiratorios del sueño como factor de riesgo independiente para las enfermedades cardiovasculares requiera un ajuste cuidadoso para los factores de riesgo cardiovasculares clásicos.
Por otra parte, se ha descrito que los pacientes con enfermedad coronaria y SAHS, pueden presentar isquemia miocárdica durante los episodios apneicos, fundamentalmente en la fase REM. Estas depresiones del segmento ST son mas frecuentes en pacientes con SAHS de carácter severo o en pacientes con angina nocturno previa. Los pacientes con infarto de miocardio y SAHS parecen tener un patrón de presentación horaria distinta, con una tendencia a aparecer entre las 6 y 12 de la mañana18.
En pacientes con cardiopatía isquémica, la presencia de un trastorno respiratorio del sueño parece ser un indicador de mal pronóstico. No existen estudios controlados acerca de la eficacia de la CPAP en este tipo de pacientes, habiéndose descrito aisladamente la reducción significativa de eventos isquémicos nocturnos o depresión del segmento ST en pacientes en tratamiento con CPAP19.
Insuficiencia cardiaca congestiva.
Las observaciones de los estudios epidemiológicos indican una asociación entre SAHS e insuficiencia acrdíaca. Los datos procedentes del Sleep Health Herat12, indican que la presencia de apneas (IAH > 11) se asocia con una odds para insuficiencia cardíaca de 2,38 independiente de otros factores de riesgo.
En dos grandes series20, 21 de pacientes con insuficiencia cardíaca por disfunción sistolica, el 11% de 81 pacientes y el 37% de 450 pacientes tenian apneas obstructivas.
Además es reseñable que un tercio de los pacientes con fallo cardíaco crónico presentan función sistólica normal y alteración de la función diastólica, resultado de la reducción en la distensibilidad del ventrículo izdo. En este sentido Chan y cols22 encontraron que el 55% de 20 pacientes con esta alteración tenian un IAH>10.
Existe también la posibilidad de que el fracaso cardíaco induzca apneas obstructivas del sueño, por un lado dada la capacidad de la respiración periódica para inducir colapso de la vía aérea superior y por otro por la retención de liquidos y su acumulo en los tejidos blandos del cuello y la faringe.
El efecto deletéreo de las apneas en la función cardíaca parece ser más intenso en pacientes con enfermedad estructural previa, donde la afectación de la poscarga tiene mayores implicaciones.
Solamente un estudio ha examinado los efectos del tratamiento del SAHS en la función sistólica y Malone y col.23 demostraron en 8 pacientes con miocardiopatía dilatada de origen desconocido, que el tratamiento con CPAP (presión positiva continua nasal) a un mes mejoraba la fracción de eyección de un 37% a un 49%.
Respiración de Cheyne Stokes y fallo cardíaco congestivo.
La respiración de Cheyne Stokes con apneas de sueño centrales es una forma de respiración periódica, común en pacientes con fallo cardíaco crónico y que esta presente en un 30-40% de las series comunicadas20, 21.
Existen además evidencias crecientes de un peor pronóstico y progresión de la enfermedad en los pacientes que lo padecen. La respiración de Cheyne Stokes parece el resultado de la inestabilidad del control central de la respiración. Naughtton y cols.24 proponen que la apnea central en pacientes con fallo cardíaco crónico y Cheyne Stokes es disparada y propagada por hiperventilación y la consiguiente reducción en la pCO2, por debajo del umbral apneico.
Durante la apnea o hipopnea la pCO2 se incrementa gradualmente, resultando en respiración periódica y hiperventilación, hasta que la pCO2 de nuevo desciende por debajo del umbral apneico.
La hiperventilación puede ser el resultado de la estimulación de receptores irritantes vagales pulmonares por congestion pulmonar (Figura 2).
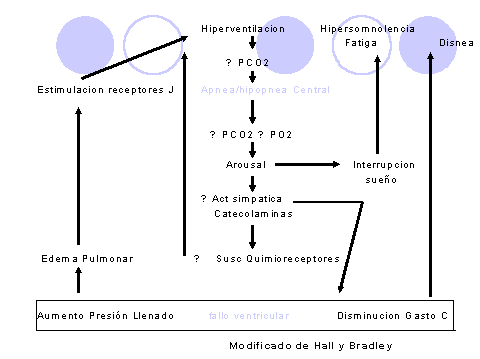
Figura 2.- Fisiopatología de la respiración de Cheyne Stokes en insuficiencia cardíaca
Existe tambien una implicación fisiopatológica derivada de las caídas de oxígeno, de los arousals del sueño, de la activación simpática y de la elevación de la frecuencia cardíaca y de la presión arterial25, 26, de tal manera que Javaheri y cols27 encontraron una alta prevalencia de apneas centrales en pacientes con fracaso cardíaco crónico e hipocapnia y un mayor porcentaje de ectopias ventriculares que en pacientes normocapnicos, con la consiguiente implicación clínica en el mayor numero de muertes súbitas.
Varias formas de presión positiva continua, incluyendo CPAP y presión binivel, han demostrado reducir la frecuencia de los eventos centrales en pacientes con fracaso cardíaco crónico, aunque con mecanismo de acción no aclarado.
La aplicación por periodos cortos de tiempo de CPAP en fracaso cardíaco crónico estable ha demostrado reducir la poscarga de ventrículo izdo, aumentar el gasto cardíaco y disminuir la actividad del sistema nervioso autónomo. Su uso en un periodo de uno a tres meses ha demostrado, incrementar la fracción de eyección, la fuerza muscular inspiratoria y reducir la regurgitación mitral y el péptido natriurético auricular28, 29, 30.
Sin y cols31 han comunicado los resultados de un estudio randomizado y controlado de tratamiento con CPAP en 66 pacientes con fallo cardíaco crónico, 29 con respiración de Cheyne Stokes y 37 sin esta alteración. Sobre un periodo de seguimiento de 5 años los pacientes con respiración de Cheyne Stokes que cumplieron el tratamiento con CPAP, experimentaron una significativa reducción en el porcentaje combinado de mortalidad y trasplante cardíaco. En la actualidad el Canadian Continuous Positive Airway Pressure Trial for Congestive Herat Faillure, intenta responder a estas interrogantes32.
El Grupo Español de insuficiencia cardíaca y trastornos del sueño, analiza en el primer estudio publicado controlado y con placebo los efectos de la CPAP sobre la fracción de eyección, en pacientes con insuficiencia cardíaca congestiva estable (fracción de eyección < 40%), óptimamente tratados, con disfunción sistólica y apneas del sueño independientemente de su naturaleza central u obstructiva.
El eje fundamental del estudio es la fracción de eyección y se randomizaron 72 pacientes. El porcentaje de pacientes con respiración de Cheyne Stokes es cercano al 19%, lejos de los datos epidemiológicos americanos que lo situan en un 40%. Se objetiva por otro lado una falta de mejoría del grupo tratado con respecto al placebo en la fracción de eyección y la no existencia de cambios en la calidad de vida, en ninguna de las vertientes exploradas (SF -36).
Los únicos efectos beneficiosos cardiovasculares se obtienen en los pacientes con fracción de eyección mayor o igual al 30% y futuros estudios determinarán si esto conduce realmente a un aumento de supervivencia en algún subgrupo de pacientes con determinada "reserva contráctil miocárdica"33.
Conclusiones
El avance en los conocimientos del impacto de los trastornos respiratorios del sueño, requerirá el desarrollo de modelos animales de investigación, que exploren diferentes mecanismos fisiopatológicos y necesitara de la colaboración de epidemiólogos especialistas en respiratorio y patología cardiovascular.
Dado que la mayoría de los pacientes con SAHS pueden estar asintomáticos, es importante resolver si la presencia de apneas de sueño juega un papel independiente como factor de riesgo para el desarrollo de enfermedad cardiovascular, del mismo modo que nadie duda de los efectos en la morbi mortalidad de la hipertensión arterial o la hipercolesterolemia.
BIBLIOGRAFIA
1. Ho KK, Anderson KM, Kannel WB, Grossman W, Levy D. Survival after the onset of congestive heart failure in Framingham Heart Study subjects. Circulation 1993;88:107-115. [PubMed][Abstract]
2. Montserrat JM, Ferrer M, Hernandez L, Farré R, Vilagut G, Navajas D et al. Effectiveness of CPAP treatment in daytime function in Sleep Apnea Syndrome A randomised controlled study with an optimized placebo. Am J Respir Crit Care Med. 2001;164:608-13.
3. Monasterio C, Vidal S, Duran J, Ferrer M, Carmona C, Barbé F et al. Effectiveness of Continuous Positive Airway Pressure in Mild Sleep Apnea-Hypopnea Syndrome. Am J Respir Crit Care Med. 2001;164:939-43
4. Terán Santos J, Jimenez Gomez A, Cordero Guevara J. The association between sleep apnea and the risk of traffic accidents. N Engl J Med 1999;340:847-851.
5. Parra O, Arboix A, Bechich S, García-Eroles, Montserrat JM, López JA, Ballester E, Guerra JM, Sopeña JJ. Time course of sleep-related breathing disorders in First-Ever Stroke or Transient Ischemic Attack. Am J Respir Crit Care Med 2000;161:375-380.
6. Leung RST, Bradley TD. Sleep apnea and cardiovascular disease. Am J Respir Crit Care Med 2001;164:2147-2165
7. Roux F, D'Ambrosio C, Mohsenin V. Sleep-related breathing disorders and cardiovascular disease. Am J Med 2000;108:396-402. [PubMed]
8. Stradling JR, Pepperell JCT, Davies RJO. Sleep apnoea and hypertension: proof at last?. Thorax 2001;56(suppl II):ii45-ii49.
9. Fletcher EC, Lesske J, Qian W, Miller CC 3rd, Unger T. Repetitive episodic hypoxia causes diurnal elevation of blood pressurein rats. Hypertension 1992,19:555-561. [PubMed] [Abstract]
10. Peppard PE, Young T, Palta M, Skatrud J. Prospective Study of the Association between Sleep-Disordered Breathing and Hypertension. N Engl J Med 2000;342:1378-84.
11. Nieto FJ, Young TB, Lind BK, Shahar E, Samet JM, Redline S, D'Agostino RB, Newman AB, Lebowitz MD, Pickering TG. Association of sleep-disordered breathing, sleep apnea, and hypertension in a large community-based study. Sleep Heart Health Study. JAMA 2000;283:1829-1836 [PubMed]
12. Quan SF, Howard BV, Iber C, Kiley JP, Nieto FJ, O'Connor GT, Rapoport DM, Redline S, Robbins J, Samet JM, Wahl PW. The Sleep Heart Health Study: design, rationale, and methods. Sleep. 1997;20:1077-1085. [PubMed]
13. Shahar E, Whitney CW, Redline S, Lee ET, Newman AB, Javier Nieto F, O'Connor GT, Boland LL, Schwartz JE, Samet JM. Sleep-disordered breathing and cardiovascular disease: cross-sectional results of the Sleep Heart Health Study. Am J Respir Crit Care Med 2001;163:19-25
14. Bixler EO, Vgontzas AN, Lin HM, Ten Have T, Leiby BE, Vela-Bueno A, Kales A. Association of hypertension and sleep-disordered breathing. Arch Intern Med 2000; 160:2289-2295 [PubMed]
15. Faccenda JF, Mackay TW, Boon NA, Douglas NJ. Randomized placebo-controlled trial of continuous positive airway pressure on blood pressure in the sleep apnea-hypopnea syndrome. Am J Respir Crit Care Med 2001;163:344-348.
16. Pepperell JC, Ramdassingh-Dow S, Crosthwaite N, Mullins R, Jenkinson C, Stradling JR, Davies RJ. Ambulatory blood pressure after therapeutic and subtherapeutic nasal continuous positive airway pressure for obstructive sleep apnoea: a randomised parallel trial. Lancet 2002;359:204-210. [PubMed]
17. Schafer H, Koehler U, Ewig S, Hasper E, Tasci S, Luderitz B. Obstructive Sleep Apnea as a Risk Marker in Coronary Artery Disease. Cardiology 1999, 92:79-84. [PubMed]
18. Mooe T, Franklin KA, Wiklund U, Rabben T, Holmström K. Sleep-disordered breathing and myocardial ischemia in patients with coronary artery disease. Chest 2000; 17:1597-1602.
19. Franklin KA, Nilsson JB, Sahlin C, Naslund U. Sleep apnoea and nocturnal angina. Lancet 1995; 345:1085-1087. [PubMed]
20. Javaheri S, Parker TJ, Liming JD, Corbett WS, Nishiyama H, Wexler L, Roselle GA. Sleep apnea in 81 ambulatory male patients with stable heart failure. Types and their prevalences, consequences, and presentations. Circulation 1998;97:2154-2159.
21. Sin DD, Fitzgerald F, Parker JD, Newton G, Floras JS, Bradley TD. Risk factors for central and obstructive sleep apnea in 450 men and women with congestive heart failure. Am J Respir Crit Care Med 1999; 160.1101-1106.
22. Chan J, Sanderson J, Chan W, Lai C, Choy D, Ho A, Leung R. Prevalence of sleep-disordered breathing in diastolic heart failure. Chest 1997; 111:1488-1493
23. Malone S, Liu PP, Holloway R, Rutherford R, Xie A, Bradley TD. Obstructive sleep apnoea in patients with dilated cardiomyopathy: effects of continuous positive airway pressure. Lancet. 1991;338:1480-1484. [PubMed]
24. Naughton MT, Bradley TD. Sleep apnea in congestive heart failure. Clin Chest Med 1998;19:99-113 [PubMed]
25. Lorenzi-Filho G, Rankin F, Bies I, Douglas Bradley T. Effects of inhaled carbon dioxide and oxygen on cheyne-stokes respiration in patients with heart failure. Am J Respir Crit Care Med. 1999;159:1490-1498.
26. Yu J, Zhang JF, Fletcher EC. Stimulation of breathing by activation of pulmonary peripheral afferents in rabbits. J Appl Physiol. 1998;85:1485-1492
27. Javaheri S. A mechanism of central sleep apnea in patients with heart failure. N Engl J Med. 1999;341:949-954.
28. Takasaki Y, Orr D, Popkin J, Rutherford R, Liu P, Bradley TD. Effect of nasal continuous positive airway pressure on sleep apnea in congestive heart failure. Am Rev Respir Dis 1989;140: 1578-1584. [PubMed]
29. Naughton MT, Benard DC, Rutherford R, Bradley TD. Effect of continuous positive airway pressure on central sleep apnea and nocturnal pCO2 in heart failure. Am J Respir Crit Care Med. 1994;150:1598-1604. [Abstract]
30. Teschler H, Dohring J, Wang YM, Berthon-Jones M. Adaptive pressure support servo-ventilation: a novel treatment for Cheyne-Stokes respiration in heart failure. Am J Respir Crit Care Med 2001; 164:614-619.
31. Sin DD, Logan AG, Fitzgerald FS, Liu PP, Bradley TD. Effects of continuous positive airway pressure on cardiovascular outcomes in heart failure patients with and without Cheyne-Stokes respiration. Circulation 2000;102:61-66.
32. Bradley TD, Logan AG, Floras JS. Rationale and design of the Canadian Continuous Positive Airway Pressure Trial for Congestive Heart Failure patients with Central Sleep Apnea--CANPAP. Can J Cardiol 2001; 17:677-684. [PubMed]
Existen estudios que responden en forma afirmativa esta pregunta1 y otros que son mas "moderados" en tal aseveracion2. Se demostró una relación directa con la hipertensión arterial, (aunque no muy claro en la población añosa)2, 3, 4. También hay relación entre el SAOS y las arritmias, sobre todo las supraventriculares, bradicardias, bloqueos y con la enfermedad cerebrovascular. En esta época de cambio, los estudios que están actualmente en desarrollo, responderán nuestras preguntas.
En el mundo son pocos los grupos dedicados a estudiar patologías del sueño, pero no son pocos los pacientes que las presentan. Esta revisión resulta muy valiosa, para ir comprendiendo la fisiopatología y la relación que tiene el SAOS con la enfermedad cardiaca, permitiendo al medico no especialista en patología del sueño, tenerla presenta, detectarla y referirla en el momento indicado.
Comentario del revisor Claudio Rabec MD. Service de Pneumologie et Réanimation Respiratoire. Centre Hospitalier et Universitaire de Dijon. Dijon, France
En lo que concierne al SAHS, algunas de sus consecuencias fisiopatológicas pueden explicar su influencia en la génesis de ECV:
En dicho contexto existen evidencias que el SAHS representa un factor de riesgo independiente de hipertensión arterial, como asi de también de insuficiencia cardiaca y de enfermedad coronaria y en este contexto, el tratamiento con CPAP podria tener un efecto análogo al de los beta bloqueantes en estos pacientes4.
Concerniente al rol de las ECV en la génesis de SAHS, éste no es menos importante. Por caso, la insuficiencia cardíaca aumenta significativamente la prevalencia de SAHS, en especial de un tipo partícular de síndrome de apnea del sueño de tipo central: la respiracion periódica nocturna de Cheyne Stokes (RCS). Así, grandes series demostraron que la prevalencia global de SAHS en la insuficiencia cardíaca alcanza un 40% (de los cuales un 70% corresponde a RCS)5. Se sabe también que la presencia de RCS en el marco de la insuficiencia cardíaca se asocia con un incremento de la mortalidad, aunque es dificil discernir si la RCS en dicho contexto es sólo un marcador de fallo cardíaco grave o si su presencia constituye un factor de riesgo independiente que ensombrece el pronóstico de esta condición.
De manera interesante, es común que en pacientes con insuficiencia cardíaca avanzada coexistan eventos obstructivos y centrales y en dichos casos existe frecuentemente un pasaje gradual de la forma obstructiva al inicio de la noche a la forma central en fin de noche. Una hipótesis que podría explicar estas formas "combinadas", es que los cambios hemodinámicos secundarios a los eventos obstructivos podríian agravar la disfunción ventricular izquierda a lo largo de la noche, generando asi un incremento de la presión de fin de diástole, lo que podria favorecer la aparicion, tardiamente, de la RCS6.
La alta prevalencia de SAHS en los pacientes con insuficiencia cardíaca, su carácter de marcador de enfermedad grave y la existencia hoy día de tratamientos eficaces, amerita la búsqueda sistemática de síntomas sugestivos de SAHS en esta población y el considerar "liberalmente" la realización de una polisomnografia ante la mínima sospecha de trastornos respiratorios vinculados al sueño.
Referencias
Comentario del revisor, Esteban Larronde, MD. Cardiologo ex-Jefe de Residentes del Hospital Interzonal General San Martin de La Plata. Neuquen. R. Argentina
La apnea obstructiva del sueño conduce a efectos agudos y crónicos en el sistema cardiovascular, y su tratamiento con presión positiva continua en la vía aérea ha demostrado disminuir la presión arterial y mejorar la fracción de eyeccion en pacientes con insuficiencia cardíaca congestiva. Si tuviéramos que elegir un ejemplo, de una patología casi desconocida y olvidada, que esta recuperando su verdadera dimensión, sin pensarlo demasiado el ejemplo es el SAOS. Esta excelente revisión sobre "Síndrome de Apnea Hipopnea durante el sueño y corazón", nos posiciona en un marco de reflexión y cambio: ¿será el SAOS un nuevo factor de riesgo para la cardiopatía isquémica?
Referencias
1.- Peker Y, Hedner J, Norum J, Kraiczi H, Carlson J. Increased incidence of cardiovascular disease in middle-aged men with obstructive sleep apnea: a 7-year follow-up. Am J Respir Crit Care Med. 2002;166:159-165.
2.- Nieto FJ, Young TB, Lind BK, Shahar E, Samet JM, Redline S et al. Association of sleep-disordered breathing, sleep apnea, and hypertension in a large community-based study. JAMA 2000;283:1829-1836
3.- Bixler EO, Vgontzas AN, Lin HM, Ten Have T, Leiby BE, Vela-Bueno A et al. Association of hypertension and sleep-disordered breathing. Arch Intern Med. 2000;160:2289-95.
4.- Hamilton GS, Solin P, Naughton MT. Obstructive sleep apnoea and cardiovascular disease. Intern Med J. 2004;34:420-426.
Terán y col. publican una interesante revisión acerca de la relación entre síndrome de apnea-hipopnea del sueño (SAHS) y sistema cardiovascular. La relación entre el SAHS y la enfermedad cardiovascular (ECV), parece reconocer un carácter de "ida y vuelta".
1.- La modificación del régimen de presiones intratoracico que acompaña a los episodios apneicos repetidos, y que, al disminuir la precarga y aumentar la postcarga, conduce a reducciones episódicas del volumen minuto cardíaco1
2.- El aumento de la actividad simpática como consecuencia de dichos eventos2
3.- Los pacientes con SAHS presentan un aumento en la carga de mediadores inflamatorios como también del "stress oxidativo" ambos factores incriminados en la aterogénesis y la disfunción endotelial3
1.- Bradley TD, Hall MJ, Ando S, et al. Hemodynamic effects of simulated obstructive apneas in humans with and without heart failure. Chest 2001; 119:1827-1835
2.- Morgan BJ, Denahan T, Ebert TJ. Neurocirculatory consequences of negative intrathoracic pressure vs. asphyxia during voluntary apnea. J Appl Physiol 1993; 74:2969-2975
3.- Bradley TD, Floras JS. Sleep apnea and heart failure: Part I: obstructive sleep apnea. Circulation 2003; 107:1671-1678
4.- Shahar E, Whitney CW, Redline S, et al. Sleep-disordered breathing and cardiovascular disease: cross-sectional results of the Sleep Heart Health Study. Am J Respir Crit Care Med 2001; 163:19-25
5.- Sin DD, Fitzgerald F, Parker JD, et al. Risk factors for central and obstructive sleep apnea in 450 men and women with congestive heart failure. Am J Respir Crit Care Med 1999; 160:1101-1106
6.- Tkacova R, Niroumand M, Lorenzi-Filho G, et al. Overnight shift from obstructive to central apneas in patients with heart failure: role of pCO2 and circulatory delay. Circulation 2001; 103:238-243
Recibido, 12 de Diciembre de 2004
Publicado, 31 de Enero de 2005
