Indice del volumen Volume index
Comité Editorial Editorial Board
Comité Científico Scientific Committee
- Mutaciones fundadoras:
Técnica utilizada en screening de familias de primer grado. Analiza de forma directa mutaciones fundadoras 15,16: 185delAG del exon Z, 2312del5 del exon 11 y 5382insC del exón 20 para el BRCA1 y 6174delT o 936delAAAC para el BRCA2 son mutaciones de los judios de Ashkenazi.
Presenta las ventajas de ser una técnica de coste no elevado, rápida y relativamente sencilla. El inconveniente principal es que la ausencia de mutaciones puntuales no excluye otras de carácter esporádico. - Polimorfismo de cadenas de ADN simple (SSCP)
La variación y alteración de un fragmento de ADN se identifica mediante la variación electroforética debida al cambio en la composición del ADN. La mutación se identifica a continuación por secuenciación. Esta técnica presenta las desventajas de una baja fiabilidad debido a un alto porcentaje de falsos positivos y falsos negativos. Así mismo sólo presenta la limitación de que sólo puede realizarse en fragmentos pequeños. Una variante de esta técnica son los heteroduplex 17. - Electroforesis en gradiente de densidad (DGGE)
La diferente movilidad en el gel que produce un cambio en la composición de un fragmento de ADN, permite detectar las mutaciones, que a continuación se identificaron por secuenciación. Esta técnica presenta la ventaja de permitir el análisis de grandes fragmentos, pero la desventaja de su elevado coste. - Test de Proteinas truncadas (PTT) 18
In vitro se traduce a proteínas el ARN y se identifican las mutaciones stop-codon por diferencias de peso molecular en las bandas. A continuación las mutaciones se identifican por secuenciación. El principal inconveniente de esta técnica es el no identificar otro tipo de mutaciones. - Secuenciación directa del gen
Es una técnica de alta fiabilidad, sin embargo presenta los inconvenientes de su complejidad, lentitud y alto coste. - Técnica de Microarrays (Figura 5)
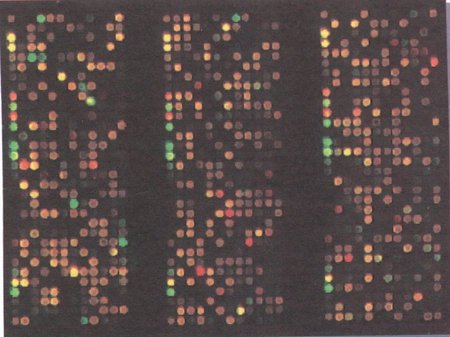
Fig 5.- Ensayos de detección de BRCA 1 y BRCA 2 mediante microarrays.
(Cada punto de hibridación corresponde a una secuencia estudiada. El color varía dependiendo del tipo de unión).
Se amplifica el ADN mediante PCR, se le incorporan fluorocromos y permite realizar miles de hibridaciones sobre las secuencias de ADN conocidas. - Modelo Couch 18
Solo estima la probabilidad de mutación en el BRCA1. Tiene en cuenta la edad media del cáncer de mama en la familia, la historia fa miliar del cáncer de mama y ovario. Presenta la limitación del tamaño de la muestra que es pequeño (164 mujeres diagnosticadas de cáncer de mama, caucasianas) y media de casos en las familias de 3.5. Detecta mutación en el 16% de las mujeres con historia familiar de cáncer de mama. La mutación en el BRCA1 no se asocia con el número de familiares afectados y no es un buen modelo predictivo en familias con un solo miembro afectado. - Modelo Frank 19.
Estima la probabilidad de mutación en el BRCA1 y en el BRCA2. Tiene en cuenta la historia familiar. La muestra sobre la que se postuló este método era de 238 mujeres con cáncer de mama diagnosticado antes de los 50 años o con cáncer de ovario y algún familiar en relación de primer o segundo grado. Según este modelo, los familiares de primer grado tienen un 50% de probabilidad y los de segundo grado un 25%. - Modelo BRCAPRO 20,21.
Estima la probabilidad individual de mutación en BRCA1 y en BRCA2, teniendo en cuenta la historia familiar, la edad y la comparación en la incidencia de cáncer de mama y ovario en pacientes con mutación en los genes BRCA frente a los pacientes sin mutación. Este modelo presenta la limitación de que la muestra utilizada se compone de familias de alto riesgo de mutaciones en los genes BRCA, por tanto las predicciones no son correctas en familias de menos riesgo. - Modelo de la Hoya 22,23.
Este modelo desarrollado en España en el Hospital Clínico San Carlos de Madrid, estima las posibilidades de mutaciones en ambos genes BRCA1 y BRCA2. Tiene en cuenta la historia familiar, edad media del diagnostico del cáncer de mama, cáncer de ovario, cáncer de mama en varones, etc. La muestra utilizada fue de 102 familias española con al menos 3 cánceres de mama y/o ovario y uno de ellos de diagnóstico previo a los 50 años. - Quimioprevención
Entre los medicamentos preventivos empleados están los antiestrógenos y entre ellos el más utilizado es el tamoxifeno. Estos medicamentos no sólo se han mostrado eficaces en el tratamiento del cáncer de mama, sino que también tienen un papel en la profilaxis del mismo. En el cáncer de mama receptor estrogénico positivo (RE +), los antiestrógenos bloquean estos receptores impidiendo el crecimiento de las células neoplásicas34. El tamoxifeno ha logrado reducir la incidencia de cáncer de mama en las mujeres con BRCA2 mutado 34.
Con objeto de evitar el aumento de riesgo de cáncer uterino debido al uso de estos antiestrógenos, se están probando otros antiestrógenos denominados moduladores selectivos de receptores de estrógenos (MSRE) como el raloxifeno 29.
Narod y cols 35 obtuvieron con tamoxifeno cifras de un 50% de reducción de riesgo de cáncer de mama contralateral en pacientes diagnosticadas con cáncer de mama y mutaciones BRCA1 o BRCA2. No obstante el efecto protector del tamoxifeno no persiste por encima de los 10 años. - Mastectomia bilateral profiláctica
Existen múltiples estudios que avalan que la extirpación preventiva de ambos senos en mujeres BRCA1 y BRCA2 positivas reduce entre al menos en un 90% la aparición de cáncer de mama 36,37. No obstante debido al impacto psicológico y a los problemas potenciales con la cirugía reconstructiva es preciso valorar muy bien la decisión a tomar. - Ooferectomia profiláctica
Existen estudios que avalan la recomendación de la extirpación preventiva de loas ovarios en mujeres que presentan mutación BRCA1 ó BRCA2. Esta medida reduce el riesgo de cáncer de ovario y el de mama. Las cifras estimadas en los diversos estudios son variables pero nada desdeñables, 85-96% para cáncer de ovario y 53-70% para el de mama 38-40
LOS GENES BRCA1 y BRCA2. ESTUDIO MOLECULAR
A. San Miguel, I. Gonzalez Blanco*, J.A. Minguéz Pargas*, L. Martín Rodríguez,
R. García Iglesias, N. Alonso, F.J. Martín Gil.
Servicio de Análisis Clínicos y *Obstetricia y Ginecología. Hospital Universitario Rio Hortega. Valladolid.
asanmiguel @ hurh.sacyl.es
Rev Electron Biomed / Electron J Biomed 2006;3:16-23.
Comentario del revisor Dr. Manuel Claver Criado. Jefe del Servicio de Patología. Hospital General Yagüe. Complejo Asistencial de Burgos. Burgos. España
Comentario del revisor Dr. Isidro Machado Puerto. Especialista en Histopatología. Valencia. España.
RESUMEN
En los últimos años, se realizaron numerosos estudios para establecer la predisposición hereditaria al cáncer y las alteraciones mutacionales a nivel de genes susceptibles de originar cáncer de mama y ovario. En 1994 se identificaron los genes BRCA1 (Breast Cancer Gene 1) y BRCA2 (Breast Cancer Gene 2) como susceptibles de cáncer de mama y ovario. En la actualidad se sabe que las mutaciones en BRCA1 y BRCA2 están lejos de explicar la totalidad de los casos de cáncer de mama y/o ovario, y a pesar de que se postulan alteraciones mutacionales en otros genes como CHEK2, TP53 y PTEN, el BRCA1 y BRCA2, siguen teniendo su importancia y utilidad en la valoración del riesgo de predisposición hereditaria. Aunque las cifras son variables según los distintos estudios y autores, se trata en cualquier caso de porcentajes importantes. Entre el 15 y el 85% de las mujeres portadoras de mutación BRCA 1 o BRCA 2 tienen riesgo de desarrollar un cáncer de mama y entre un 10 y 60% de desarrollar un cáncer de ovario.
PALABRAS CLAVE: Estudio molecular. Genes BRCA1 y BRCA2
In the last years, numerous studies were made to establish the hereditary predisposition to the cancer and the mutationals alterations at level of genes susceptible to originate breast and ovarian cancers. In 1994 genes BRCA1 (Breast Cancer Gene 1) and BRCA2 were identified (Breast Cancer Gene 2) as susceptible of both of breast and ovarian cancers. At the present time, it is knows that the mutations in BRCA 1 and BRCA 2 are far from explaining the totality of the cases of breast cancer and/or ovary, and although mutationals alterations in other genes like CHEK2, TP53 and PTEN, the BRCA1 and BRCA2 are postulated, they continue having his importance and utility in the valuation of the risk of hereditary predisposition. Correlations between both BRCA1 and BRCA2 levels with tumour grade metastasis and prognostic accuracy. Between 15 and 85% of the carrying women of mutation BRCA 1 or BRCA 2 have risk of developing a cancer of breast and between 10 and 60% to develop an ovarian cancer.
KEY WORDS: GENES BRCA1 and BRCA2. MOLECULAR STUDY.
INTRODUCCION
El carcinoma de mama es el cáncer que se produce con mayor frecuencia en la mujer, constituyendo por tanto una de las principales causas de mortalidad. Mientras que el cáncer de ovario se presenta con una frecuencia de un 4%, pero debido a su virulencia constituye la quinta causa de muerte.
Entre los factores de riesgo en ambos tipos de cáncer son similares, siendo la edad uno de los principales. La historia familiar del cáncer de mama constituye el segundo factor de riesgo de carcinoma de mama y/o ovario.
Estadísticamente las cifras de cáncer de mama hereditario no son muy relevantes frente a la totalidad, ya que sólo representan entre el 5 y 10% del total de los cánceres de mama. Sin embargo, debido a que se trata del segundo factor de riesgo, cualquier conocimiento o avance sobre los riesgos de predisposición hereditaria es de importante repercusión.
En los últimos años, se han realizado numerosos estudios para establecer la predisposición hereditaria al cáncer y las alteraciones mutacionales a nivel de genes susceptibles de originar estos tipos de cánceres. En 1994 se identificaron los genes BRCA1 (Breast Cancer Gene 1) y BRCA2 (Breast Cancer Gene 2) como susceptibles de producir cáncer de mama y ovario.
En la actualidad se sabe que las mutaciones en BRCA1 y BRCA2 están lejos de explicar la totalidad de los casos de cáncer de mama y ovario, y a pesar de que se postulan alteraciones mutacionales en otros genes como CHEK2, TP53 y PTEN, el BRCA1 y BRCA2, siguen teniendo su importancia y utilidad en la valoración del riesgo de predisposición hereditaria. Aunque las cifras son muy variables según los distintos estudios y autores, se trata en cualquier caso de porcentajes importantes. Entre el 15 y el 85% de las mujeres portadoras de mutación BRCA1 o BRCA2 tienen riesgo de desarrollar un cáncer de mama y entre un 10 y 60% de desarrollar un cáncer de ovario 1.
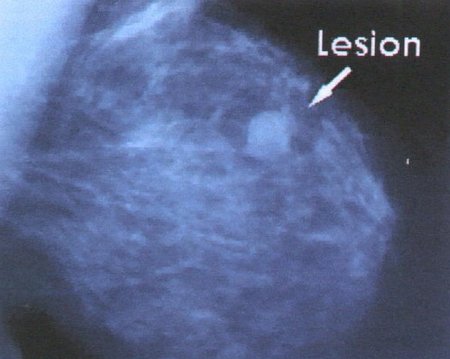
En la figura 1 se muestra una lesión sospechosa de carcinoma de mama.
CARACTERISTICAS ESTRUCTURALES Y FUNCIONALES DE BRCA1 Y BRCA2
El gen BCRA 1, se localizó en el cromosoma 17q12-q21 y fue clonado por Miki y cols en 1994 2. Se trata de un gen de elevadas dimensiones, que tiene 24 exones, 22 de ellos codificantes. Codifica una proteína de peso molecular de 220 KD. El BCRA 1 no presenta gran homología con otros genes, excepto dos secuencias una situada en la zona amino terminal y otra en la zona carboxiterminal que muestran cierta similitud con genes ya conocidos. La secuencia de la zona amino terminal, denominada "dominio de dedos de zinc" estás relacionada con factores de transcripción y participa en interacciones de proteínas con ADN o proteínas entre sí 3. La secuencia de la zona carboxiterminal denominada dominio BRCT está relacionada con la reparación del ADN 4,5. En la figura 2 aparece recogida esquematicamente la estructura y principales dominios de la proteína BRCA1.
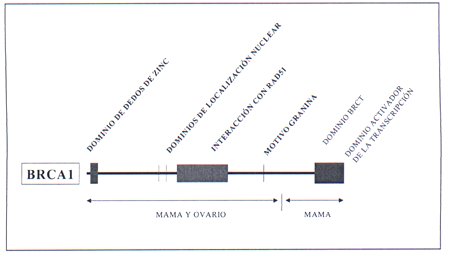
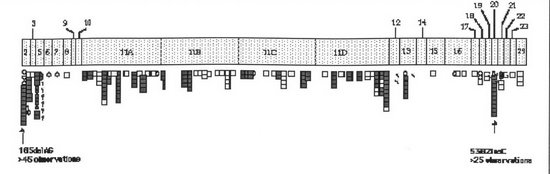
Fig 2.- Secuencia genómica del BRCA1 y la localización de las mutaciones conocidas en el Breast Information Core (BCI) del Nacional Center for Human Genome Research.
En la figura 3 aparece representada la secuencia genómica del BRCA1 y la localización de las mutaciones conocidas en el Breast Information Core (BCI) del Nacional Center for Human Genome Research.
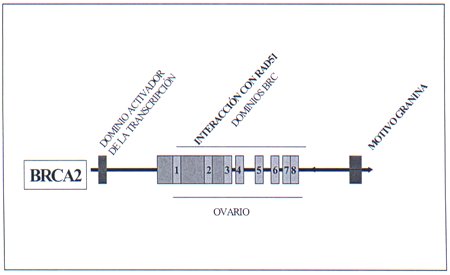
El gen BRCA2 se localizó en el cromosoma 13q12-q13 y fue identificado por Wooster y cols. en 1995 6,7. Al igual que el gen BRCA1 se trata de un gen de elevadas dimensiones que tiene 27 exones. Codifica un proteína mucho mayor que la codifica por BRCA1 cuyo peso molecular es de 384 KD. Asi mismo, como el BRCA1, no presenta gran homología con otros genes, a excepción de un dominio situado en el exón 11 de repeticiones BRC.
La funcionalidad de ambos genes BRCA1 y BRCA2 parece ser similar y relacionada con el mantenimiento de la integridad de genoma. Ambos presentan dominios capaces de activar y regular la transcripción así como participar en la reparación del ADN.
Ambos genes se comportan y se conocen como "genes supresores de tumores". Cuando se produce una alteración en su línea germinal, el sujeto portador presenta dicha mutación en todas sus células. Un alelo sano permite que el gen mantenga su funcionalidad, por tanto, para que se produzca la aparición de un carcinoma es necesario la desaparición ó pérdida de ese alelo 8.
La expresión de BRCA1 y BRCA2 tiene una regulación hormonal 9. Se expresan en diferentes células epiteliales durante el desarrollo y sus niveles aumentan en el embarazo y disminuyen en el parto. En células cancerosas de mama se observan niveles elevados de mRNA de ambos genes, mediante estimulación por estrógenos 10.
En la tabla 1 aparecen recogidas las características más significativas de ambos genes BRCA1 y BRCA2.
| BRCA1 | BRCA2 | |
| Fue identificado en | 1990 | 1994 |
| Clonado en | 1994 | 1995 |
| Localizado en el cromosoma | 17q | 13q |
Tabla 1.- Características más significativas de los genes BRCA1 y BRCA2.
En la figura 4 aparece recogida esquematicamente la estructura y principales dominios de la proteína BRCA2.
ANALISIS DE MUTACIONES
Se han encontrado más de 1700 mutaciones o polimorfismos diferentes para los genes BRCA1 y BRCA2. Sólo algunas de ellas se han descrito más frecuentemente en determinadas poblaciones, tales como la población de judios Ashkenazi 11,12 o en Islandia 13.
Las principales técnicas de screening utilizadas en el laboratorio se detallan a continuación 14.
No obstante cualquiera de las técnicas descritas bien aisladamente o de forma combinada 14, no asegura la detección de todas las mutaciones. Entre las limitaciones existentes está la de no poder identificar delecciones de exones que ocurren en una de las dos copias del gen u heterocigotos. Así mismo otra limitación se debe a los errores de procesamiento del transcrito del ARN no relacionado con la secuencia de ADN exónico. Una limitación verdaderamente importante y potencial fuente de error es la imposibilidad de establecer diferencias entre los polimorfismos en el gen y las mutaciones que causan la enfermedad.
MODELOS DE PREDICICON DE RIESGO
A lo largo de los años se han ido desarrollando diferentes modelos de estimación o valoración del riesgo de padecer cáncer.
Los modelos clásicos más conocidos en la estimación de riesgo de cáncer de mama son el modelo Gail 15 y el modelo de Claus 16,17. Ambos modelos utilizan diversas variables para calcular el riesgo entre las que se encuentran la edad, el diagnóstico y familiares de primer grado con cáncer de mama, entre otros. Sin embargo ninguno de ellos tiene en cuenta la historia familiar de cáncer de ovario, ni que la mujer sea portadora de mutación en el BRCA1 o en el BRCA2. Por tanto, ambos modelos infravaloran el riesgo en portadoras de mutación BRCA y lo sobrevaloran en las no portadoras.
Posteriormente se desarrollaron diferentes modelos que sí tienen en cuenta la presencia de mutaciones en los genes BRCA1 y BRCA2. Cada modelo utiliza un tipo de población y un tipo de metodología concretos, presentando por tanto limitaciones inherentes a la hora de aplicarlos a poblaciones de características diferentes a las estudiadas.
A pesar de la existencia de estos métodos o modelos matemáticos o probabilísticos para establecer criterios de riesgo, no existe validación ni consenso para ninguno de ellos.
PREVALENCIA Y PENETRANCIA
No todas las mutaciones contribuyen de igual manera al desarrollo de la enfermedad. La prevalencia de las mutaciones en los distintos estudios pueden variar mucho en función de la población seleccionada. Así en familias con historial familiar amplio y gran carga genética, la prevalencia de mutaciones puede llegar a ser del 80%, disminuyendo notablemente hasta un 45% en familias de menor historial familiar.
En los casos de cáncer de mama sin antecedentes familiares de cáncer de ovario o cáncer de mama en varones, la prevalencia de ambos genes BRCA1 y BRCA2 es la misma. Sin embargo, en familias con cáncer de mama y ovario la prevalencia del BRCA1 es muy superior y en casos de cáncer de mama en hombres la prevalencia de BRCA2 es mayor 18,24-28.
La penetrancia también es variable según el tipo de estudio, sobrestimándose en algunos casos en los que la población familiar es de alto riesgo. Las mutaciones genéticas que predisponen al cáncer de mama y ovario no son totalmente penetrantes, es decir no todos los portadores de mutación desarrollan cáncer 29. Existen múltiples factores como medio ambiente, dieta, obesidad, estado hormonal o interacciones con otros factores genéticos necesarios para el desarrollo de la enfermedad.
Se estiman cifras de portadoras de BRCA1 y BRCA2 mutados de riesgo entre un 50 y un 85% de padecer cáncer de mama a lo largo de la vida. En portadoras de BRCA1 se estiman cifras entre un 40-60% de riesgo de cáncer de ovario y en portadores de BRCA2 estos porcentajes bajan al 10-20% 30,31. Al aumentar la edad, la frecuencia de mutaciones disminuye considerablemente, debido a la disminución de cáncer de mama por herencia autonómica dominante 32. No obstante globalmente el riesgo de padecer cáncer de mama se incrementa con la edad 33.
PREVENCION
Existen básicamente tres medidas profilácticas, que habrá que valorar de forma individualizada teniendo además en cuenta la esperanza de vida y los efectos psicológicos del paciente.
REFERENCIAS
1.- Health Oasis Mayo Clinic Web site. http://www.mayohealth.org. January 2000; 12.
2.- Miki Y., Swensen J., Shattuck-Eidens D., et al. A strong candidate for the breast and ovarian cancer susceptibility gene BRCA1. Science, 1994; 266: 66-71.
3.- Saurin AJ, Borden KL, Boddy M.N, Freemont P.S. Does this have a familiar RING? Trends Biochem Sci, 1996; 21: 208-214.
4.- Koonin EV, Altschul SF, Bork, P. BRCA1 protein products ... Functional motifs. Nat Genet, 1996; 13: 266-268.
5.- Bork P., Blomberg N, Nilges M. Internal repeats in the BRCA2 protein sequence. Nat Genet, 1996; 13: 22-23.
6.- Wooster R, Neuhausen SL, Mangion J, et al. Localization of a breast cancer susceptibility gene, BRCA2, to chromosome 13q12-13. Science, 1994; 265: 2088-2090.
7.- Wooster R. Bignell G, Lancaster J, et al. Identification of the breast cancer susceptibility gene BRCA2. Nature, 1995; 378: 789-792.
8.- Kinzler KW, Vogelstein B. Cancer-susceptibility genes. Gatekeepers and caretakers. Nature, 1997; 386: 761-763.
9.- Rajan JV, Marquis ST, Gardner HP, Chodosh LA. Developmental expression of BRCA2 colocalizes with BRCA1 and is associated with proliferation and differentiation in multiple tissues. Dev Biol, 1997; 184: 385-401.
10.- Spillman MA, Bowcock AM. BRCA1 and BRCA2 mRNA levels are co-ordinately elevated in human breast cancer cells in response to estrogen. Oncogene, 1996; 13: 1639-1645.
11.- Oddoux C, Struewing JP, Clayton CM, et al. The carrier frequency of the BRCA2 6174delT mutation among Ashkenazi Jewish individuals is approximately 1%. Nat Genet, 1996; 14: 188-190.
12.- Roa BB, Boyd AA, Volcik K, Richards C.S. Ashkenazi Jewish population frequencies for common mutations in BRCA1 and BRCA2. Nat Genet, 1996; 14: 185-187.
13.- Thorlacius S, Sigurdsson S, Bjarnadottir H, et al. Study of a single BRCA2 mutation with high carrier frequency in a small population. Am J Hum Genet, 1997; 60: 1079-1084.
14. CIC Actual IXX. Actualización y Revisión Técnica del Laboratorio Clínico. Estudio molecular de los genes BRCA1 y BRCA2. 2003: Nº XI.
15.- Gail MH, Brinton LA, Byar DP, Corle DK, Green SB, Schairer C, Mulvihill JJ. Projecting individualized probabilities of developing breast cancer for white females who are being examined annually. J Natl Cancer Inst, 1989; 81: 1879-1886.
16. Claus EB, Risch N, Thompson, W.D. Genetic analysis of breast cancer in the cancer and steroid hormone study. Am J Hum Genet, 1991; 48: 232-242.
17.- Claus EB Schildkraut JM, Thompson WD, Risch NJ. The genetic attributable risk of breast and ovarian cancer. Cancer: 1996; 77, 2318-2324.
18.- Couch, F.J., Farid LM., DeShano, et al. BRCA2 germline mutations in male breast cancer cases and breast cancer families. Nat Genet, 1996; 13: 123-125.
19.- Frank TS, Manley SA, Olopade OI, et al. Sequence analysis of BRCA1 and BRCA2: correlation of mutations with family history and ovarian cancer risk. J Clin Oncol, 1998; 16:2417-2425.
20.- Euhus DM, Smith K, Robinson L, et al. Pretest Prediction of BRCA1 or BRCA2 Mutation by Risk Counselors and the Computer Model BRCAPRO. J Natl Cancer Inst, 2002; 94: 844-851.
21.- Berry DA, Iversen ES, Gudbjartsson DF, et al. BRCAPRO Validation, Sensitivity of Genetic Testing of BRCA1/BRCA2, and Prevalence of Other Breast Cancer Susceptibility Genes. JCO, 2002; 1: 2701-2712.
22.- De la Hoya M, Osorio A, Godino J, et al. Association between BRCA1 and BRCA2 mutations and cancer phenotype in Spanish breast/ovarian cancer families: implications for genetic testing. Int J Cancer, 2002; 97: 466-467.
23.- De la Hoya, M., Perez-Segura, P., Van Orsouw, N., Diaz-Rubio, E, Caldes, T. Spanish family study on hereditary breast and/or ovarian cancer: analysis of the BRCA1 gene. Int J Cancer, 2002; 91: 137-140.
24.- Friedman LS, Gayther SA, Kurosaki et al. Mutation analysis of BRCA1 and BRCA2 in a male breast cancer population. Am J Hum Genet, 1997; 60: 313-319.
25.- Struewing JP, Hartge P, Wacholder S, Baker SM, Berlin M, McAdams M, Timmerman MM, Brody LC, Tucker MA. The risk of cancer associated with the 185delAG and 5382insC mutations of BRCA1 and the 6174delT mutation of BRCA2 among Ashkenazi Jews. N Engl J Med 1997; 336, 1401.
26.- Krainer M; Silva-Arrieta S; FitzGerald M; et al. Differential contributions of BRCA1 and BRCA to early-onset Breast Cancer. N Engl J Med 1997; 336 (20) 1416.
27.- Osorio, A. Robledo, M. Martínez, et al. Molecular analysis of the BRCA2 gene in 16 breast/ovarian cancer Spanish families. Clinical Genetics 1998, 54(2) 142.
28.- Takahashi H, Behbakht K, McGovern PE, et al. Mutation analysis of the BRCA1 gene in ovarian cancers. Cancer Res 1995; 55:2998-3002.
29.- Poveda M, Espinoza G, Engracia R, Sanchez J. Gen BRCA y susceptibilidad heredada al cáncer de mama. Oncología 2003; 13: 184-187.
30.- Easton, DF, Ford D, Bishop, D.T. Breast and ovarian cancer incidence in BRCA1- mutation carriers. Breast Cancer Linkage Consortium. Am J Hum Genet, 1995; 56: 265-271.
31.- Ford D, Easton DF, Peto J. Estimates of the gene frequency of BRCA1 and its contribution to breast and ovarian cancer incidence. Am J Hum Genet, 1995; 57: 1457-1462.
32.- Brose MS, Rebbeck TR, Calzone KA, Stopfer JE, Nathanson KL, Weber BL. Cancer risk estimates for BRCA1 mutation carriers identified in a risk evaluation program. J Natl Cancer Inst, 2002; 18: 1365-1372
33.- Serova OM, Mazoyer S., Puget N., et al. Mutations in BRCA1 and BRCA2 in breast cancer families: are there more breast cancer-susceptibility genes? Am J Hum Genet, 1997; 60: 486-495.
34.- Fischer B, Constantino JP, Wickerham DL, et al. Tamoxifen for prevention of breast cancer: Report of the National Surgical Adjuvant Breast and Bowel Proyect P-1 study. Journal of National Cancer Institute 1998; 90: 1371-1388
35.- Narod, S.A., Ford, D., Devilee, P., Barkardottir, R.B., Lynch, H.T., Smith, S.A., Ponder, B.A., Weber, B.L., Garber, J.E., Birch, J.M. & . (1995) An evaluation of genetic heterogeneity in 145 breast-ovarian cancer families. Breast Cancer Linkage Consortium. Am J Hum Genet, 56: 254-264.
36.- Meijers-Heijboer, H., van Geel, B., van Putten, W.L., et al. Breast cancer after prophylactic bilateral mastectomy in women with a BRCA1 or BRCA2 mutation. N Engl J Med, 2001; 345: 159-164.
37.- Hartmann LC, Schaid DJ, Woods JF, et al. Efficacy of bilateral prophylactic mastectomy in women with family history of breast cancer. N Eng J Med 1999; 340: 77-84.
38.- Rebbeck TR, Lynch HT, Neuhausen SL, et al. Prevention and Observation of Surgical End Points Study Group. Prophylactic oophorectomy in carriers of BRCA1 or BRCA2 mutations. N Engl J Med, 2002; 346:1616-1622.
39.- Kauff ND, Satagopan JM, Robson M, et al. Risk-reducing Salpingo-oophorectomy in Women with a BRCA1 or BRCA2 Mutation. N Engl J Med, 2002; 346: 1609-1615
40.- Sloots K, Ausems MGEM, de Haan HH. Ovarian cancer in BRCA-positive women: vigilance is mandatory despite screening programs. European Journal of Obstetrics & Gynecology and Reproductive Biology 2002; 101: 196-198.
Se trata de un buen trabajo de revisión y puesta al día del tema. Tiene la virtud de reconocer que no todos los casos de incidencia familiar están controlados por estas alteraciones y que aparecen también en varios tipos de tumores, señalando como principales el de mama y el de ovario. En nuestra Comunidad Autónoma, estan en funcionamiento dos centros del diagnóstico del cáncer familiar uno en Salamanca y otro en Burgos, por lo que se trata de un estuio de revisión oportuno.
Por todo lo anteriormente plasmado creo que el trabajo puede ser de gran utilidad a una amplia gama de médicos de diferentes especialidades como los médicos de familia, mastólogos, cirujanos, radiólogos y patólogos pues permite ampliar nuestros conocimientos en el papel actual que juegan los genes en la génesis y patogenia de muchas enfermedades malignas. También detalla como se pueden aplicar estos conocimientos a la práctica, con la descripción de los modelos de prediccion de riesgo y las medidas que pudieran aplicarse para la prevencion de la neoplasia.
Recibido: 12 de Septiembre de 2006. Recibido corregido: 20 de Diciembre de 2006
Comentario del revisor Dr. Manuel Claver Criado. Jefe del Servicio de Patología del Complejo Asistencial de Burgos. España
Debe señalarse que son los inhibidores de la aromatasa, los medicamentos que van sustituyendo al Taxomifeno, por su posible relación con el cáncer de útero. Anecdóticamente, hay que considerar que la "edad media" es el periodo de tiempo que transcurre aproximadamente desde el siglo V, hasta el siglo XV. Cuando en el texto se habla de edad media, se refieren más bien a "media de edad"
Comentario del revisor Dr. Isidro Machado Puerto MD. Especialista en Histopatología. Valencia. España.
Considero que en el trabajo se realiza una revisión detallada sobre el papel que juegan los genes BRCA1 y BRCA 2 en la patogenia de las neoplasias malignas sobre todo en el cáncer de mama que sigue siendo la neoplasia de mayor morbimortalidad en el sexo femenino. Los autores realizan una caracterizacion estructural y funcional de ambos genes y explican las principales técnicas para detectar alteraciones y mutaciones en esto genes. Profundizan en los modelos de predicción de riesgo de padecer cáncer de mama lo cual permite realizar screening y detectar tempranamente a los pacientes que pudieran desarrollar un cáncer de mama. Afortunadamente en muchos de estos modelos se tiene en cuenta la presencia de mutaciones de los genes BRCA1, BRCA2. Finalmente plantean como en aquellos casos con mutaciones de los genes se pueden realizar tratamientos preventivos que evitarian en cierto sentido la aparicion del cáncer.
Correspondencia:
Dr. Angel San Miguel Hernández
Servicio de Análisis Clínicos. Hospital Universitario Rio Hortega.
47010. Valladolid
asanmiguel@hurh.sacyl.es
Publicado: 23 de diciembre de 2006