Indice del volumen Volume index
Comité Editorial Editorial Board
Comité Científico Scientific Committee
EXPRESIÓN DEL RECEPTOR DE FACTOR DE CRECIMIENTO EPIDÉRMICO (EGFR) EN EL CARCINOMA COLORRECTAL PRIMARIO Y METASTÁSICO.
Manuel Claver Criado1, Marta Herreros Villanueva2, Carlos García Girón3,Celina Echevarria Iturbe1,
Belen Perez Mies1, María Jesús Coma-del-Corral2
Servicio de Patología1, Unidad de Investigación2, Servicio de Oncología Médica3.
Hospital General Yagüe, Complejo Asistencial de Burgos. Burgos. España
mjcoma @ uninet.edu
Rev Electron Biomed / Electron J Biomed 2008;1:43-53
Comentario del revisor Prof. Francisco Abad Santos MD PhD. Profesor de Farmacología Clínica. Universidad Autónoma de Madrid. España
Comentario del revisor Prof. Valentín del Villar Sordo MD PhD. Catedrático de Medicina. Jefe del Servicio de Medicina Interna del Complejo Hospitalario de Soria. España
RESUMEN
Se ha estudiado la expresión del Receptor del Factor de Crecimiento Epidérmico (EGFR) en el tumor primario y metastásico de 50 pacientes consecutivos atendidos en el Servicio de Oncología del Hospital General Yagüe de Burgos, por presentar enfermedad metastásica de un tumor colorrectal.
Además de valorar la expresión del marcador en el tumor primario y metastásico, se analizó la relación entre el tipo histológico o grado de diferenciación tumoral y el grado de atipia citológica con la expresión del EGFR, y las diferencias en el tiempo de progresión de la enfermedad y la diferenciación tumoral cuando el EGFR se expresa tanto en el tumor primario como en la metástasis, o cuando dicha expresión ocurre únicamente en el tumor primario o sólo en las metástasis.
Nuestros datos ponen de manifiesto que la expresión del EGFR puede aparecer en el tumor primitivo, en la metástasis, o en ambos casos, pero no se puede predecir si la metástasis expresará o no ese factor a partir de su expresión en el tumor primario. Por otro lado, la expresión del Factor de Crecimiento Epidérmico no guarda relación con la atipia citológica del tumor considerada aisladamente respecto de la diferenciación tumoral, pero si con la diferenciación tumoral, siendo más frecuente su aparición cuanto más desdiferenciado está el tumor, y esa relación tiene significación estadística.
PALABRAS CLAVE: Cancer colorrectal. Receptor del Factor de Crecimiento Epidérmico. dianas terapéuticas
SUMMARY: EPIDERMAL GROWTH FACTOR RECEPTOR (EGFR) EXPRESSION IN PRIMARY AND METASTATIC COLORECTAL CANCER
We studied Epidermal Growth Factor Receptor (EGFR) expression in primary and metastatic tumor of 50 consecutive patients treated at the Oncology Service in General Yagüe Hospital in Burgos, with metastatic disease of colorectal tumours.
In addition to evaluate EGFR expression in primary and metastatic tumor, we analyzed the relationship between the histological type or degree of tumor differentiation, and the degree of cytologic atypia with EGFR expression, and the differences in time to progression of the disease and the tumor differentiation when EGFR is expressed both in the primary tumor and metastasis, or when that expression occurs only in the primary tumor or metastasis only.
Our data show that EGFR expression can appear on the primary tumour, metastasis, or both, but we can not predict whether or not metastasis expressed that factor from its expression in the primary tumor. On the other hand, Epidermal Growth Factor expression is not related to cytologic atypia alone regarding the tumor differentiation, but yes if tumor differentiation is considered. It is more frequent in more undifferentiated tumors, and this relationship have statistical significance.
KEY WORDS: Colorectal cancer. Epidermal Growth Factor Receptor. Targeted therapies
INTRODUCCION
El Receptor del Factor de Crecimiento Epidérmico (EGFR) es una glicoproteína trans-membrana involucrada en los mecanismos implicados en el crecimiento, la diferenciación y la proliferación celular. El EGFR pertenece a la familia de receptores del factor de crecimiento con actividad tirosina-quinasa. El EGFR se expresa en muchos tejidos humanos normales y la activación de este protooncogén provoca su sobreexpresión en muchos tipos de tumores humanos. Como glicoproteína transmembrana, el dominio extracelular del EGFR es un sitio de ligadura para el factor de crecimiento transformante alfa (TGFa), el factor de crecimiento epidérmico (EGF) y otros factores.
Tras la unión del ligando, se activa el dominio intracelular del EGFR, lo que desencadena mecanismos celulares que incrementan la proliferación celular, la metástasis y la angiogénesis 1, 2. Análisis in vitro utilizando células que expresan grandes cantidades de EGFR y producen ligandos para esos receptores, han demostrado que el EGFR puede ser activado a través de una vía autocrina, induciendo así la proliferación de células en cultivo3. Para inhibir la proliferación de células ricas en EGFR, se han producido antagonistas del EGFR que bloquean el sitio de unión al ligando.
Se ha demostrado que los anticuerpos monoclonales contra el EGFR inhiben la proliferación de las células que producen TGFa y EGFR4. Un antagonista dirigido contra el sitio de unión al ligando del EGFR ofrece un enfoque interesante para el tratamiento de los cánceres en los que intervienen vías dependientes de aumento de EGFR5. Entre los cánceres que sobreexpresan el EGFR se encuentran algunos de los más prevalentes el cáncer colorrectal (72%), el cáncer de cabeza y cuello, (92%), el cáncer pancreático (95%), de ovario (35-70%), de células renales (50-90%), el cáncer pulmonar no microcítico (40-80%) y los gliomas (40-50%). El pronóstico para muchas de esas neoplasias malignas es malo si no se diagnostican en una etapa temprana y el tratamiento para la enfermedad avanzada es limitado6-7.
Se han investigado los efectos del bloqueo de los EGFR en el progreso del ciclo celular en varios tipos celulares humanos, entre ellos las células del adenocarcinoma de colon. Estos estudios sugieren que el bloqueo de los EGFR con anticuerpos monoclonales induce la detención del ciclo celular en la Fase Gl,8 y se ha demostrado también que el bloqueo del EGFR induce la muerte celular mediante apoptosis en las células de adenocarcinoma de colon9.
Los estudios iniciales sobre el uso de anticuerpos monoclonales dirigidos directamente contra el sitio de unión del EGFR han mostrado resultados prometedores en el tratamiento del cáncer colorrectal metastásico y se espera que aumente en el futuro los tratamientos disponibles para los pacientes diagnosticados con esta enfermedad10-16.
Actualmente se asume que hay una correlación entre la expresión del EGFR en células cancerosas y la respuesta al tratamiento con fármacos dirigidos al EGFR. La evaluación inmunohistoquímica de la expresión del EGFR es el método más ampliamente utilizado para la inclusión de pacientes en ensayos clínicos que investigan el uso de anticuerpos dirigidos al EGFR.
Sin embargo, en estos ensayos, una considerable proporción de tumores colorrectales con elevada expresión del EGFR han sido refractarios al tratamiento, mientras que pacientes con tumores que muestran una baja expresión del EGFR respondieron al tratamiento. Sorprendentemente, han sido referidas respuestas objetivas aún en tumores colorrectales avanzados EGFR negativos tratados con anticuerpos monoclonales contra el EGFR17. Estos hallazgos muestran el fracaso en demostrar que el nivel de EGFR pudiese tener algún papel en la predicción de la tasa de respuesta.
Aunque diversos mecanismos podrían explicar esta aparente falta de correlación entre el estado del EGFR y la eficacia de la terapia dirigida contra el EGFR con anticuerpos monoclonales, es posible que la detección del EGFR, que habitualmente es realizado en el tumor primario, no siempre correlacione con la situación del EGFR en las distintas metástasis, siendo así resistentes al tratamiento a las células cancerosas en estos sitios.
Por lo tanto, parece importante corroborar si los tumores que expresan el EGFR en tumor primario, lo expresan también en los sitios metastásicos, así como si existe relación con otra serie de características histológicas y de localización.
El objetivo principal de este estudio fue analizar el grado de concordancia en la expresión del factor de crecimiento epidérmico (EGFR) entre el tumor primario y las metástasis en los tumores colorrectales. Y secundariamente, analizar si el tipo histológico ó grado de diferenciación tumoral y el grado citológico en los tumores de colon son diferentes cuando la expresión del EGFR ocurre en el tumor primario y en las metástasis, respecto a los que dicha expresión sólo ocurre en el tumor primario.
MATERIAL Y MÉTODOS
El trabajo fue realizado a lo largo de 1 año, correspondiendo a los casos en que la progresión apareció en el año 2004 o 2005. Los pacientes incluidos en el estudio fueron seleccionados en el Servicio de Oncología por padecer cáncer colorrectal en fase metastásica, previa obtención del consentimiento informado. Asimismo se recogieron los datos clínicos pertinentes.
En los pacientes seleccionados, se procedió a la obtención de nuevos cortes histológicos del tumor primitivo, a partir del bloque de tejido incluido en parafina existente en el archivo de biopsias, en los que se realizaron técnicas histopatológicas rutinarias y técnicas de inmunohistoquímica con los anticuerpos monoclonales anti EGFR (DAKO®, K-1492).
La observación de las preparaciones microscópicas y la valoración del resultado de la técnica histoquímica fue realizado por dos patólogos de forma aleatoria y ciega respecto del estadio clínico del paciente (MCC y BPM), quedando registrados los resultados.
Se llevó a cabo un estudio retrospectivo, con 50 pacientes vistos en el servicio de Oncología Médica, seleccionados por padecer adenocarcinoma de colon con progresión de la enfermedad, que disponían de biopsia del tumor metastásico y/o primario archivada o disponible en el Servicio de Patología del Hospital General Yagüe de Burgos.
Se revisaron los datos clínicos y se recogieron en una base de datos la edad en años, sexo, periodo de latencia hasta la aparición de metástasis o progresión de la enfermedad, tipo histológico del tumor primario (adenocarcinoma bien diferenciado, moderadamente diferenciando, pobremente diferenciando y otros), el grado citológico (I, II, III) y el estadio tumoral (clasificación según TNM).
La determinación del factor de crecimiento epidérmico se realizó tanto en el tumor primario (EGRF-p) como en la metástasis (EGFR-m) de todos los tumores colorrectales incluidos en el estudio, a partir de las muestras de tejido tumoral almacenadas en el laboratorio de Patología del Hospital General Yagüe de los pacientes diagnosticados de cáncer colorrectal metastásico, mediante Inmunohistoquímica, de acuerdo a los procedimientos normalizados del laboratorio de Patología.
Con el fin de evitar posibles sesgos del observador, la presencia del factor de crecimiento epidérmico en las metástasis (EGFR-m) fue realizada de forma ciega respecto a la presencia del factor de crecimiento epidérmico en el tumor primario (EGFR-p).
Análisis estadístico: Las pruebas estadísticas y el procesamiento y análisis de los datos se llevaron a cabo con la ayuda del paquete estadístico SPSS v11.0. Se realizó un análisis descriptivo de las variables a través de distribuciones de frecuencia para las cualitativas y media y desviación estándar para las cuantitativas. Se calculó el porcentaje de muestras que expresan el factor de crecimiento epidérmico tanto en el tumor primario (EGFR-p) como en el metastático (EGFR-m), con su correspondiente intervalo de confianza al 95%.
Se analizaron las características histológicas de los tumores analizados, en concreto, grado de diferenciación tumoral y grado citológico y se busco la relación entre la expresión del EGFR y las características histológicas, a través de pruebas de 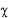 2 con las correspondientes correcciones en su caso. También se compararon los casos que expresaron conjuntamente EGFR-p y EGFR-m con aquellos que expresaron EGFR únicamente en el tumor primario o metastásico.
2 con las correspondientes correcciones en su caso. También se compararon los casos que expresaron conjuntamente EGFR-p y EGFR-m con aquellos que expresaron EGFR únicamente en el tumor primario o metastásico.
RESULTADOS
La serie estudiada está formada por 50 pacientes tratados en el Servicio de Oncología del Hospital General Yagüe, afectos de adenocarcinoma colorrectal que progresó a enfermedad generalizada, con metástasis a distancia. De éstos, aproximadamente la tercera parte eran mujeres y el resto varones. La edad de los pacientes seleccionados, oscilaba entre 31 y 77 años, con una media de 63,30 ± 9,126 años (Tabla 1).
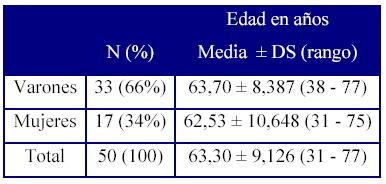
Tabla 1.- Sexo y edad de los pacientes en la primera biopsia
El periodo medio de tiempo entre la escisión del tumor primario, y la aparición de franca progresión de la enfermedad osciló entre 15 y 3639 días, con una media de 812,66 ± 683,097 días. El intervalo entre biopsias, en los 9 casos en que se practicó segunda escisión o biopsia osciló entre 1 y 3188 días, con una media de 726,11 ± 985,812 días.
Con respecto al grado de diferenciación histológica del adenocarcinoma, había predominio de tumores moderadamente diferenciados (39 casos, 78,0%), mientras que eran pobremente diferenciados 11 casos (22,0%). Ninguno de los 50 casos fué considerado adenocarcinoma bien diferenciado.
El tipo citológico II es decir, con atipia moderada (33 casos, 66%) predominaban sobre aquellos que tenían intensa atipia citológica (17 casos, 34%). No hubo ningún caso fue de tipo citológico I (atipia escasa o ausente).
En 46 casos analizados, la expresión del Factor de Crecimiento Epidérmico en el tumor primitivo (EGFR-p) fue positivo en 22 (47.8%) y negativo en 24 (52.2%); en los 4 pacientes restantes, no obtuvimos muestra del tumor primitivo (Figura 1).
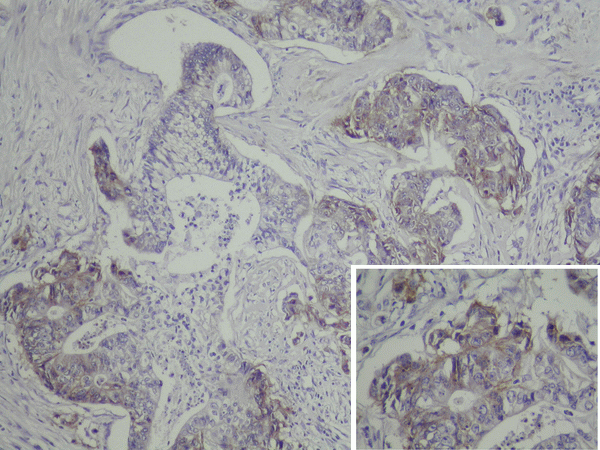
Figura 1. Pared de intestino grueso infiltrada por un adenocarcinoma moderadamente diferenciado.
EGFR positivo en las células tumorales (EGFR-p). Recuadro: detalle
La expresión del EGFR en el tumor metastásico (EGFR-m) pudo estudiarse en 34 de los 50 casos. Era positivo en 20 casos (58.8%) y negativo en 14 (41.2%). Ver figura 2.
Relacionando conjuntamente esta expresión del EGFR-p (tumor primario) y EGFR-m (tumor metastásico) en los 31 casos válidos para el análisis, obtenemos los resultados que se expresan en la Tabla 5.
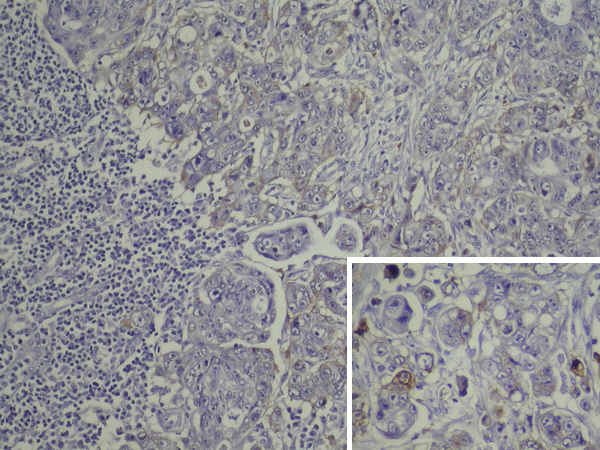
Figura 2: Ganglio linfático con infiltración por adenocarcinoma pobremente diferenciando,
que expresa el Factor de Crecimiento Epidérmico (EGFR-m). Recuadro: detalle
La concordancia de expresión en el tumor primitivo y en la metástasis a distancia es del 58,1% de los casos estudiados. En el restante 41,9% de los casos hay disparidad en la expresión del EGFR en el tumor primitivo y en la metástasis.
En la serie analizada fue más frecuente la aparición de casos en que el EGFR se expresa en la metástasis (25.8% de los casos restantes) y no en el tumor primario, mientras que fueron minoría los casos de tumor primitivo con expresión del EGFR (EGFR-p positivo), que deja de ser expresado en el tumor metastásico (EGFR-m negativo). No obstante, en la tabla de contingencia de EGFR-p sobre EGFR-m, vemos que no hay diferencias estadísticamente significativas (Tabla 2).
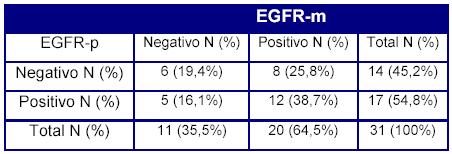
Tabla 2. Tabla de contingencia de la expresión de EGFR en tumor primario y metástasis.
(EGFR-p = tumor primario EGFR-m = metástasis).
p =0,581 (NS)
Al analizar la expresión del EGFR con respecto a la diferenciación tumoral, observamos que, en los 24 casos en que el EGFR-p era negativo, 20 correspondían a un adenocarcinoma moderadamente diferenciado, y solo en 4 pacientes era de tipo pobremente diferenciado. Por el contrario, cuando el EGFR-p era positivo en el tumor primario, seguían siendo mayoría los casos de adenocarcinoma moderadamente diferenciado, pero la proporción es de 16 de 22 casos, mientras que los 6 restantes eran pobremente diferenciado. Si nos fijamos en la diferenciación, constatamos que cuando se trata de un tumor moderadamente diferenciado, es mas frecuente que el tumor no exprese el EGFR, mientras que es más frecuente que éste factor sea expresado cuando el adenocarcinoma es pobremente diferenciando. La prueba del 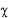 2 demostró que estas diferencias eran estadísticamente significativas (p = 0.012). Ver Tabla 3.
2 demostró que estas diferencias eran estadísticamente significativas (p = 0.012). Ver Tabla 3.
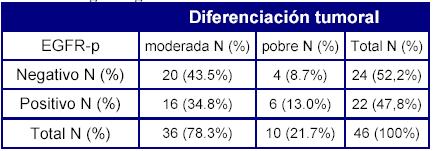
Tabla 3. EGFR en el tumor primario (EGFR-p) según el grado histológico diferenciación tumoral
p = 0.012
Una situación semejante ocurre en el tumor metastásico respecto del grado histológico de diferenciación, siendo asimismo estadísticamente significativa la asociación entre el EGFR en la metástasis y la desdiferencianción tumoral (Tabla 4).
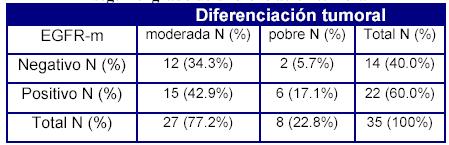
Tabla 4. EGFR en el tumor metastásico (EGFR-m) según el grado histológico de diferenciación tumoral
p = 0.002
En cuanto a la asociación de la expresión del EFGR y la atipia citológica, vemos que, respecto del tumor primario (EGFR-p) no es estadísticamente significativa la relación entre la atipia citológica y la presencia o ausencia de la expresión de EGFR (Tabla 5).
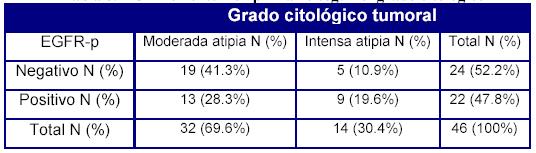
Tabla 5. EGFR en el tumor primario según el grado de atipia citológica
p= 0.096 (NS)
Tampoco es estadísticamente significativa la relación entre grado de atipia citológica y la expresión del factor de crecimiento epidérmico en el tumor metastásico (EGFR-m), como se observa en la Tabla 6.
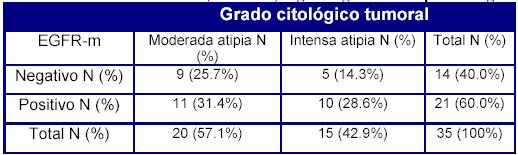
Tabla 6. EGFR en metástasis (EGFR-m) según el grado de atipia citológica
p= 0,21 (NS)
Es decir, es mas frecuente que el EGFR sea positivo cuando se trata de un adenocarcinoma pobremente diferenciado. Por el contrario, un grado mas elevado de atipia citológica no esta asociado de forma estadísticamente significativa con la expresión del EGFR.
Al valorar el EGFR como factor pronóstico encontramos que la positividad o negatividad de dicho factor, en nuestra serie no guardó correlación con el intervalo de tiempo hasta la aparición de la diseminación metastásica, como se aprecia en la tabla 7, siendo la diferencia de medias de 107'51 días ± 203'4 (IC al 95% -302,4 - 517,4)
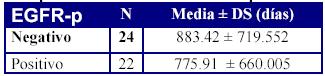
Tabla 7. Intervalo de tiempo hasta la progresion del tumor,
según la expresión del EGFR en el tumor primario
p = 0.73 (NS)
Tampoco la expresión del EGFR en la metástasis parece guardar relación con el intervalo de tiempo desde la resección del tumor inicial hasta la progresión de la enfermedad (tabla 8), siendo la diferencia de medias de 325,45 días ± 184,41 (IC al 95% -60,61 - 711,51).
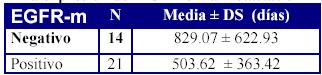
Tabla 8. Intervalo hasta la progresión según la expresión del EGFR en la metástasis
p = 0.117 (NS)
De ello, podemos inferir que en la casuística analizada, no encontramos relación pronóstica a la expresión del EGFR en el tumor primitivo ni en el metastásico.
Analizamos también si grado de diferenciación tumoral y el grado citológico es diferente cuando la expresión del EGFR ocurre tanto en el tumor primario como en el metastásico, con respecto a los casos en los que sólo el tumor metastásico demuestra expresión del factor de crecimiento epidérmico. Los datos obtenidos en nuestra serie no mostraron diferencias estadísticamente significativas, tanto por lo que respecta al grado de diferenciación tumoral como al de atipia citológica. Sin embargo, la muestra es demasiado pequeña para obtener conclusiones definitivas, pues solo había 20 casos válidos para el análisis y en dos grupos había 5 ó menos casos (Tabla 9).
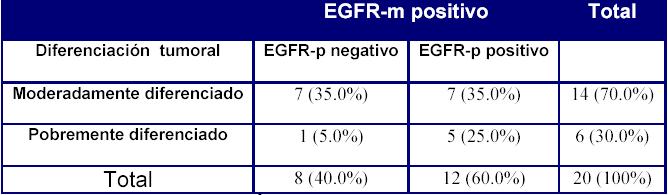
Tabla 9.Grado de diferenciación tumoral cuando la metástasis expresa el EGFR, según si lo expresa o nó el tumor primario
p= 0,163 (NS)
Un resultado similar obtuvimos en esa comparación cuando era únicamente el tumor primario el que demostraba expresión del EGFR.
DISCUSIÓN
Diversos estudios tratan de identificar un perfil genético, detectable por métodos inmunohistoquímicos que pueda ser marcador de cáncer colorrectal, con especial atención a los aspectos pronósticos. La importancia de la detección consiste en que el paciente con carcinoma colorrectal metastásico resistente a la quimioterapia se puede beneficiar de tratamientos con anticuerpos monoclonales como el cetuximab dirigidos contra el EGFR18, encontrando los diversos autores que la proporción de pacientes con cáncer colorrectal metastático, que expresan el EGFR mediante técnicas inmunohistoquímicas oscila entre el 53%19 y el 83%20-21.
En general, hay buena correlación entre la expresión del EGFR en el tumor primario y en la metástasis22. Utilizando técnicas de inmunohistoquímica la concordancia de EGFR-alcanza el 78% de los casos entre el tumor primario y el metastásico, sea cual sea el número de localizaciones y el intervalo transcurrido hasta la manifestación del tumor a distancia, es decir, ya sea sincrónico o metacrónico20. Por el contrario, otros estudios exponen la disparidad entre la expresión del EGFR en el tumor primario y en la metástasis23.
El fenómeno biológico descrito, es decir, la ausencia de correlación entre la detección del EGFR en el tumor primario y en las metástasis puede estar relacionado con alteraciones genéticas aun no suficientemente exploradas, posiblemente relacionadas con la resistencia a las dianas terapéuticas contra el EGFR, lo cual es de importancia en el tratamiento de estos pacientes23. Otros autores han observado que las recurrencias después de la quimioterapia postoperatoria tienen menores niveles de expresión de EGFR en comparación con los pacientes que no recibieron quimioterapia antes del análisis de la metástasis, y han atribuido la discordancia precisamente a la quimioterapia antitumoral aun no siendo específica contra el EGFR24.
Estudios recientes cuestionan la fiabilidad del método inmunohistoquímico para detectar el EGFR en tejidos incluidos en parafina. Comparando la validez de la técnica según los distintos preparados comerciales, se ha observado alta concordancia en las pruebas de evaluación de 3 test inmunohistoquímicos comerciales distintas por lo que no hay distinciones evidentes a favor de uno u otro25. Mediante procedimientos con test comerciales y técnicas que emplean microondas, han sido recuperados cómo casos EGFR positivos, cierto número de tumores anteriormente considerados negativos26.
Diversos autores como Moroni et al27, han propuesto utilizar técnicas de amplificación del DNA mediante hibridación in situ por fluorescencia (FISH), para la selección de pacientes con cáncer colorrectal susceptibles de tratamiento con bloqueadores del EGFR (cetuximab). Sin embargo los resultados no correlacionaron el nivel de amplificación con el resultado de la inmunohistoquímia. En los diferentes estudios, la amplificación fue rara (4,5%) y sólo aparece en pacientes con fuerte positividad en la técnica inmunohistoquímica convencional28. Italiano et al.29, comparando ambos métodos analíticos, y relacionándolos con la tasa de respuesta al tratamiento con cetuximab, concluyen que el análisis de FISH no parece ser una técnica suficientemente sólida para la selección de los pacientes.
Spindler et al.30 han comparado diferentes técnicas para la detección del EGFR en muestras de sangre y del tumor de pacientes con carcinoma colorrectal, mediante FISH, reacción en cadena de la polimerasa a tiempo real (RT-PCR), ELISA e inmunohistoquímia. Los resultados pusieron de manifiesto una pobre correlación entre la condición de EGFR en el ADN, detectado por PCR, ARN detectado por FISH y la proteína, detectado por Inmunohistoquímia.
El EGFR ha sido detectado en un 66% de las muestras de sangre periférica recogidas de los pacientes con cáncer colorrectal metastático31.
Hay notables discrepancias acerca de la correlación entre la detección del EGFR en el tumor primario y metastásico. Italiano et al 21 hallaron concordancia en el 94% de un total de 80 pacientes estudiados, de los que en dos casos la expresión del EGFR aparecía en el tumor primario pero no en la metástasis, y a la inversa en otros tres pacientes en los que había positividad para el EGFR en la metástasis pero no en el tumor primario, siendo concordantes los 75 pacientes restantes. La concordancia fue del 78% en dos distintas e independientes series de pacientes, estudiados por Bibeau et al20 y por Spindler et al 30.
Por el contrario, Scarzzoti et al.19 hallaron que el tumor primario era positivo en 53 de 99 pacientes (53%), pero en 19 de estos pacientes (36%), el tumor metastásico no expresaba el EGFR, mientras que el caso inverso, es decir, metástasis con expresión de EGFR que no fue detectada en el tumor primario ocurrió en 7 pacientes (15%). En nuestra serie el EFGR fue positivo en el tumor primario de 17 de 31 pacientes (54,8%) donde 5 de 31 (16.1%) pacientes expresaban el EGFR en el tumor primario pero no en la metástasis, y en otros 8 pacientes (25.8%), el EGFR se pudo demostrar en el tumor metastásico pero no en el primario, por lo que la concordancia de expresión en el tumor primitivo y en la metástasis a distancia es del 57.1%, lo que se acerca más a los resultados obtenidos por Scarzzoti et al19.
CONCLUSIONES.
La expresión del Factor de Crecimiento Epidérmico en el cáncer colorrectal puede aparecer en el tumor primitivo, en la metástasis, o en ambos casos, pero no se puede predecir si la metástasis expresará o no ese factor a partir de su expresión en el tumor primario.
La expresión del Factor de Crecimiento Epidérmico no guarda relación con la atipia citológica del tumor considerada aisladamente respecto de la diferenciación tumoral.
La expresión del Factor de Crecimiento Epidérmico en el cáncer colorrectal es más frecuente cuanto más desdiferenciado está el tumor, y esa relación tiene significación estadística.
REFERENCIAS
-
1. Imclone: Investigator Brochure. Imclone Systems Incorporated. Cetuximab: Epidermal Growth Factor Receptor (EGFR) Antibody, 20-May-2004,Version 10
2. Yarden Y, Ullrich A. Growth Factor Receptor Tyrosine Kinases. Ann Rev Biochem 1988; 57:443-78
3. Van de Vijver MJ, KumarR, MendelsohnJ.Ligand-induced Activation of A431. cell epidermal growth factor receptors occurs primarily by an autocrine pathway that acts upon receptors on the surface rather than intracellularly. J Biol Chem 1991; 266: 7503-8
4. Modjtahedi H, Affleck K, Stubberfield C, Dean C. EGFR blockade by tyrosine kinase inhibitor or monoclonal antibody inhibits growth, directs terminal differentiation and induces apoptosis in the human squamous cell carcinoma HN5. Int J Oncol. 1998;13:335-342.
5. Baselga J, Norton L, Masui H, Pandiella A, Coplan K, Miller Jr WH, Mendelsohn J. Antitumor Effects of Doxorubicin in Combination With Anti-epiderma1 Growth Factor Receptor Monoclona1 Antibodies. J Nat Canc Inst 1993; 85: 1327-33
6. Al-Kasspooles M, Moore JH, Orringer MB et al. Amp1ification and over-expression of the EGFR and erbB2 genes in human esophageal adenocarcinomas. Int J Cancer1993; 54: 213-9
7. Grandis JR, Tweardy DJ. Elevated levels of transforming growth factor alpha and epidermal growth factor receptor messenger RNA are early markers of carcinogenesis in head and neck cancer. Cancer Res 1993; 3: 3579-84
8. Chou JL, Fan Z, DeBlasio T, et al. Constitutive overexpression of cyclin D1 in human breast epithelial cells does not prevent G1 arrest induced by deprivation of epidermal growth factor. Breast Cancer Res Treat 1999;.55: 267-83
9. Fan Z, Shang BY, Lu Y, et al. Reciprocal changes in p27(Kip1) and p21(Cip 1) in growth inhibition mediated by blockade or overstimulation of epidermal growth factor receptors. Clin Cancer Res 1997; 3: 1943-8
10.- Carpenter G, Cohen S. Epidermal growth factor. J Biol Chem 1990;265:7709-7712.
11.- Goldstein NI, Prewett M, Zuklys K, et al. Biological efficacy of a chimeric antibody to the epidermal growth factor receptor in a humar tumor xenograft model. Clin Cancer Res 1995;1:1311-1318.
12. Ciardiello F, Tortora G. Epidermal growth factor receptor (EGFR) as a target in cancer therapy: Understanding the role of receptor expression and other molecular determinants that could influence the response to anti-EGFR drugs. Eur J Cancer 2003;39:1348-1354.
13.- Kluftinger AM, Robinson BW, Quenville NF, et al. Correlation of epidermal growth factor receptor and c-erB2 oncogene product to known prognostic indicators of colorrectal cancer. Surg Oncol 1992;1:97-105.
14.- Mayer A. Takimoto M, Fritz E, et al. The prongnostic significance of proliferating cell nuclear antigen, epidermal growth factor receptor, and mdr gene expression in colorectar cancer. Cancer 1993;71:2454-2460.
15.- Ellis LM, Hoff PM. Targeting the epidermal growth factor receptor: An important incremental step in the battle against colorrectal cancer. J Clin Oncol 2004;22:1177-1179.
16.- Cunningham D, Humblet Y, Siena S, et al. Cetuximab monotherapy and cetuximab plus irinotecan in irinotecan-refractory metastatic colorrectal cancer. N Engl J Med 2004;351:337-345.
17.- Lenz HJ, Mayer RJ, Gold PJ, et al. Activity of cetuximab in patients with colorrectal cancer refractory to both irinotecan and oxiplatin. Proc Am Soc Clin Oncol 2004;23:248 (abstr 3510).
18.-Lyall MS, Dundas SR, Curran S, Murray GI. Profiling markers of prognosis in colorrectal cancer. Clin Cancer Res. 2006 Feb 15;12:1184-91
19.-Scartozzi M, Bearzi I, Berardi R, et al: Epidermal growth factor receptor EGFR status in primary colorrectal tumors does not correlate with EGFR expression in related metastatic sites: Implications for treatment with EGFR-targeted monoclonal antibodies. J Clin Oncol 2004; 22:4772-4778
20.-Bibeau F, Boissière-Michot F, Sabourin JC, Gourgou-Bourgade S, Radal M, Penault-Llorca F, Rochaix P, Arnould L, Bralet MP, Azria D, Ychou M. Assessment of epidermal growth factor receptor (EGFR) expression in primary colorrectal carcinomas and their related metastases on tissue sections and tissue microarray. Virchows Arch. 2006;449:281-287.
21.-Italiano A, Follana P, Caroli FX, Badetti JL, Benchimol D, Garnier G, Gugenheim J, Haudebourg J, Keslair F, Lesbats G, Lledo G, Roussel JF, Pedeutour F, François E. Cetuximab shows activity in colorrectal cancer patients with tumors for which FISH analysis does not detect an increase in EGFR gene copy number. Ann Surg Oncol. 2008;15:649-54.
22.-Bralet MP, Paule B, Falissard B, Adam R, Guettier C. Immunohistochemical variability of epidermal growth factor receptor (EGFR) in liver metastases from colonic carcinomas. Histopathology. 2007;50:210-216
23.-Bralet MP, Paule B, Adam R, Guettier C. Loss of epidermal growth factor receptor expression in lymph node and liver metastases of colon carcinoma. J Clin Oncol. 2005;23:5844-5845
24.-Khalifa MA, Rowsell CH, Gladdy R, Ko YJ, Hanna S, Smith A, Law C. Is EGFR expression altered following postoperative chemotherapy for colorrectal adenocarcinoma?. World J Surg Oncol. 2006;4: 92
25.-Penault-Llorca F, Cayre A, Arnould L, Bibeau F, Bralet MP, Rochaix P, Savary J, Sabourin JC. Is there an immunohistochemical technique definitively valid in epidermal growth factor receptor assessment?. Oncol Rep. 2006;16:1173-1179
26.-Derecskei K, Moldvay J, Bogos K, Tímár J. Protocol modifications influence the result of EGF receptor immunodetection by EGFR pharmDx in paraffin-embedded cancer tissues. Pathol Oncol Res. 2006;12:243-246.
27.-Moroni M, Veronese S, Benvenuti S, Marrapese G, Sartore-Bianchi A, Di Nicolantonio F, Gambacorta M, Siena S and Bardelli A: Gene copy number for epidermal growth factor receptor (EGFR) and clinical response to anti-EGFR treatment in colorrectal cancer: a cohort study. Lancet Oncol 2005; 6: 279-286.
28.-Ooi A, Takehana T, Li X, Suzuki S, Kunitomo K, Iino H, Fujii H, Takeda Y and Dobashi Y: Protein overexpression and gene amplification of HER-2 and EGFR in colorrectal cancers: an immunohistochemical and fluorescent in situ hybridization study. Mod Pathol. 2004; 17: 895-904.
29.-Italiano A, Saint-Paul MC, Caroli-Bosc FX, François E, Bourgeon A, Benchimol D, Gugenheim J, Michiels JF. Epidermal growth factor receptor (EGFR) status in primary colorrectal tumors correlates with EGFR expression in related metastatic sites: biological and clinical implications. Ann Oncol. 2005;16:1503-1507.
30.-Spindler KL, Lindebjerg J, Nielsen JN, Olsen DA, Bisgård C, Brandslund I, Jakobsen A. Epidermal growth factor receptor analyses in colorrectal cancer: a comparison of methods. Int J Oncol. 2006;29:1159-1165.
31.-Zieglschmid V, Hollmann C, Mannel J, Albert W, Jaeschke-Melli S, Eckstein B, Hillemann T, Greten TF, Gross E, Böcher O. Tumor-associated gene expression in disseminated tumor cells correlates with disease progression and tumor stage in colorrectal cancer. Anticancer Res. 2007;27(4A):1823-1832
AGRADECIMIENTO: Proyecto Subvencionado por la Consejería de Sanidad de la Junta de Castilla y Léon SAN/1052/BU01/05
Dirección para la correspondencia:
Dra. María Jesús Coma del Corral
Unidad de Investigación. Hospital General Yagüe. 09005 Burgos
mjcoma @ uninet.edu
