Indice del volumen Volume index
Comité Editorial Editorial Board
Comité Científico Scientific Committee
EL NÚMERO Y POSICIÓN DE LOS ÁTOMOS DE BROMO EN COMPUESTOS DERIVADOS DEL 2-FURILETILENO AFECTAN LA CITOTOXICIDAD E INDUCEN RESISTENCIA EN CÉLULAS DE MAMÍFEROS
Oscar Hernándeza, Yudiska Martínezb, Lizdenia Barruetaa,
Nayadis Vazqueza, Sandra Fernándeza, Gisselle Perezc.
a Centro de Inmunología y Productos Biológicos (CENIPBI),
bDepartamento de Farmacología. Universidad Ciencias Médicas. Camagüey.
c Centro de Bioactivos Químicos (CBQ), Universidad Central de Las Villas. Villa Clara.
Cuba.
osamuel1964 @ gmail.com
Rev Electron Biomed / Electron J Biomed 2011;3:44-52.
Comentario de la revisora Dra. María Cristina Tarrés. Profesora e Investigadora, Facultad de Ciencias Médicas. Universidad Nacional de Rosario. Rosario. Argentina.
Comentario de la revisora Dra. Larisa Ivón Carrera. Profesora e Investigadora, Facultad de Ciencias Médicas. Universidad Nacional del Litoral. Santa Fe. Argentina.
RESUMEN:
El efecto del número y posición de los átomos de bromo en la estructura molecular de cuatro compuestos derivados del 2-furiletileno sobre la proliferación celular fue evaluado en un ensayo in vitro utilizando líneas celulares normales y neoplásicas. Mediante la prueba de captación del rojo neutro fue revelada una discreta actividad antiproliferativa (valores de IC50 superiores a 100 µM) para todos aquéllos.
El compuesto con dos átomos de bromo mostró el mayor valor de IC50 (256.62 µM), evidenciando una marcada inhibición de su citotoxicidad. Éste exhibió, asimismo, una curva dosis respuesta no convencional, típica del efecto de resistencia y dependiente de la línea celular ensayada. La sustitución del átomo de bromo por el grupo metilo en la cadena carbonada lateral incrementó ligeramente la citotoxicidad del producto.
PALABRAS CLAVE: Bromo. Citotoxicidad. Furiletileno. Resistencia a drogas. Rojo neutro. Células.
SUMMARY:
The effect of the number and the position of bromine atoms in the molecular structure of four derivative compounds from 2-furylethylene on cell proliferation was assessed. In this regard, an in vitro essay, employing normal and neoplastic lines of cells, was performed. A moderate antiproliferative activity (values of IC50 higher than 100 µM) was put into evidence in the referred four compounds when the neutral red uptake test was used.
The presence of two bromine atoms in the molecule showed a higher IC50 value (256.62 µM) which markedly inhibited its cytotoxicity. Likewise, this compound exhibited an unconventional dose-response curve, typical in the resistance effect and dependent from the analyzed cell line. The bromine atom substitution with a methyl group in the lateral carbonated chain slightly increased its cytotoxicity.
KEYWORDS: Bromine. Cytotoxicity. Furylethylene. Drug resistance. Neutral red. Cells.
INTRODUCCIÓN
El empleo de los citostáticos y nuevas drogas en el tratamiento del cáncer es una práctica cada vez más creciente de la medicina moderna, encaminada a definir blancos moleculares específicos. La efectividad limitada de estos fármacos según el tipo y localización del tumor así como la aparición de resistencia a los mismos debido a diversos factores1 ha conducido a la búsqueda y caracterización de nuevos productos, naturales o sintéticos, destinados a combatir esta enfermedad.
Desde la década de los 90, los derivados del 2-furiletileno (vinilfuranos o etenofuranos, por provenir del eteno) han sido percibidos como compuestos con interesantes propiedades biológicas. Se trata de agentes sintéticos con una amplia gama de actividades biológicas (bactericidas, antifúngicas y antiprotozoarias)2-5.
En la mayoría de los derivados 2-furiletilenos reportados en la literatura hasta los años 80, la presencia del grupo nitro en la posición 5 del anillo furánico limitó su uso dadas las propiedades mutagénicas y carcinogénicas de los nitrofuranos6-7. Estudios posteriores les abrieron nuevas perspectivas al demostrar que tal presencia no era condición necesaria para desarrollar la actividad antimicrobial de estos químicos8-9.
Por su parte, el número y la posición de los átomos de bromo en sustancias naturales10-11 y sintéticas12-14 ha llamado la atención de muchas investigaciones biomédicas con la finalidad de usar estos compuestos en el tratamiento de pacientes. Algunos de estos trabajos muestran que la bromación y la posición de este átomo incrementan la citotoxicidad de los compuestos ensayados15-17. Otros resultados evidencian que modificaciones químicas, como la sustitución de grupos por bromo o iodo, posee un efecto significativo en las propiedades de unión de estos compuestos al ADN 18-19 y las proteínas20+21.
Hay una tendencia reciente a la incorporación de enlaces de halógenos a los compuestos sintetizados para controlar la conformación macromolecular22. Estos enlaces son interacciones electrostáticas entre átomos de cloro, bromo o iodo con aceptores clásicos de hidrógenos tales como el O, N o el S23-25.
Dadas: (a) la obtención de cientos de moléculas con potencial farmacéutico diverso en el Centro de Bioactivos Químicos de la Universidad Central de Las Villas, entre las que se hallan derivados del 2-furiletileno en los que se demostró una potente actividad antimicrobial y antifúngica2-5, y (b) la ausencia de estudios que analicen el rol que juega el número y la posición del átomo de bromo, presente en su estructura molecular, sobre la actividad citotóxica in vitro, este trabajo se encaminó a dilucidar la utilidad de este átomo en el efecto antiproliferativo, comparando el efecto de cuatro de estos compuestos bromados en líneas celulares normales y neoplásicas.
MATERIAL Y METODOS
Las investigaciones se llevaron a cabo en los laboratorios de Cultivo Celular y de Inmunoanálisis del Centro de Inmunología y Productos Biológicos (CENIPBI) de la Universidad de Ciencias Médicas Carlos J Finlay de Camagüey. Las mismas fueron económicamente sustentadas por el Sistema Nacional de Salud Cubano.
Productos sintéticos utilizados en los ensayos
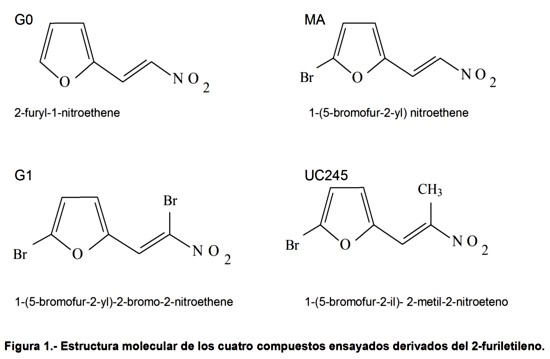
Fueron empleados cuatro productos codificados como G0, G1, UC245 y MA (Figura 1), obtenidos por el Grupo de Síntesis Química del Centro de Bioactivos Químicos, (Universidad Central de Las Villas, Cuba) y donados para este estudio, a fin de evaluar el efecto que tiene el número y posición de los de átomos de bromo (Br) presentes en la estructura de estos compuestos derivados del 2-furiletileno.
Líneas celulares y condiciones de cultivo
La actividad citotóxica de los productos fue analizada en las líneas celulares no tumorales CHO-K1 (epiteliales de Ovario de Hámster Chino, ECACC No.85050302), y en la línea tumoral P3-X63/AG8/653 (mieloma murino), gentilmente donadas por el Centro de Inmunología Molecular (La Habana, Cuba).
En todos los casos, la suspensión celular obtenida de los cultivos en frascos de 25 cm2 con una confluencia de 70-80%, fueron contados en cámara de Neubauer mediante el método de exclusión con Tripán Azul. El porcentaje de viabilidad en todos los ensayos fue superior al 90%. La densidad celular de siembra varió entre 20 y 30 x 103 células/pozo en placas de 96 pozos (COSTAR Nº-402037310) en un volumen de 150 µL. Las placas se incubaron durante 24 horas antes de aplicar el tratamiento con los diferentes compuestos. Las líneas celulares se cultivaron en medio RPMI 1640 (GIBCO 31800-014) suplementado con 10% suero fetal bovino (SFB) y glutamina piruvato 2 mM en ausencia de antibióticos. Los cultivos tratados se incubaron a 37°C durante 72 horas en atmósfera de 5% de CO2 y 100% de humedad relativa.
Soluciones de trabajo y controles
Los compuestos fueron disueltos en una mezcla de dimetilsulfóxido/etanol (DMSO/ETOH) (v/v) donde la concentración final de esta mezcla en el medio de cultivo fue inferior a 0.1%. Se preparó una solución madre de 500 mM de cada producto a partir de las cual se prepararon las diferentes dosis de trabajo. Para la línea CHO-K1 se ensayaron dosis de 50, 100, 200, 250, 300 y 400 µM y para la P3-X63/AG8/653, dosis de 100, 200, 250, 300 y 400 µM.
El control negativo lo representaron las células creciendo en medio RPMI con 10% de SFB en presencia de 0.1 % del vehículo empleado como diluyente y en ausencia de los productos a estudiar. El control positivo fueron las células expuestas a 10 µg/mL de 5 fluorouracilo (5-FU).
Ensayo de citotoxicidad
De los diferentes ensayos in vitro descritos para evaluar la citotoxicidad se seleccionó la captación del rojo neutro (CRN). Aquéllos fueron llevados a cabo en triplicado (3 pozos/dosis), permaneciendo las células en contacto durante 72 horas con los diferentes tratamientos. La densidad óptica fue medida a 540 nm en el lector de placa de ELISA (Lab Systems MULTISKAN Plus).
Los datos de la inhibición del crecimiento (IC50) del GO, G1, UC245 y MA son brindados como el valor de la concentración en micromoles/L (µM) del producto que causa la inhibición del 50% del cultivo con relación al control negativo.
Procesamiento estadístico
Se realizó el ANOVA múltiple combinada con la matriz de comparación de medias de Tukey para definir diferencias significativas entre los grupos. El cálculo de los valores IC50 para cada producto y línea celular se determinó empleando la regresión lineal26 mediante el programa GraphPad Prim. Versión 5.02. El paquete estadístico empleado fue SPSS 15.0 for windows. La diferencia se consideró significativa para valores de p<0.05.
RESULTADOS Y DISCUSIÓN
Citotoxicidad y determinación de los valores de IC50
El Gráfico 1 muestra el resultado del ensayo de CRN donde se emplearon seis dosis de cuatro productos sintéticos en un rango de 50 a 400 µM en la línea celular no tumoral, CHO-K1.
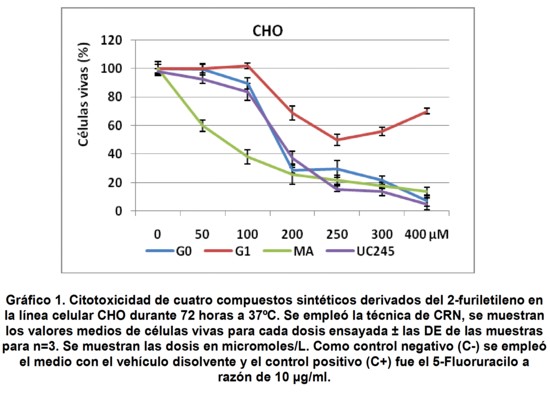
Los compuestos sin átomo de Br (G0) o con un solo átomo del mismo en la molécula (MA y UC245) mostraron una actividad citotóxica mayor que el compuesto G1, con dos átomos de Br. La adición de un grupo metilo (CH3) en la cadena carbonada lateral del anillo (UC245), inhibió significativamente (p=0,0421) la citotoxicidad del compuesto MA con un Br en el anillo furánico. En cambio, la sustitución del Br por el grupo CH3 en la misma posición del carbono exocíclico en G1 para dar lugar al UC-245, mejoró ligeramente la actividad antiproliferativa de este compuesto en células CHO-K1 (256.62 µM vs 173.1 µM, respectivamente).
De los cuatro productos ensayados, el compuesto MA con un solo átomo de Br en el anillo furánico, evidenció el mayor efecto antiproliferativo en la línea CHO-K1, con un IC50 de 134,5 µM. Este efecto se vio inhibido por la adición de un átomo de Br en posición 2 de la cadena carbonada lateral (G1), lo que afectó significativamente (p=0,023) la citotoxicidad de este compuesto. Además, un resultado interesante se observó en la curva dosis respuesta del producto G1 con dos átomos de Br. Este compuesto, más allá de presentar un valor discreto de IC50 (256.6 µM), mostró una curva dosis respuesta no convencional. La mayor inhibición del crecimiento se obtuvo con dosis de 250 µM. Finalmente, concentraciones por encima de esta dosis generaron un efecto de resistencia al producto, evidenciado por una recuperación e incremento en los porcentajes de células vivas a las 72 horas de iniciado el ensayo. Con el objetivo de corroborar este resultado se realizaron dos nuevos experimentos empleando esta misma línea celular CHO-K1 con tres de los productos antes mencionados (G0, G1 y MA).
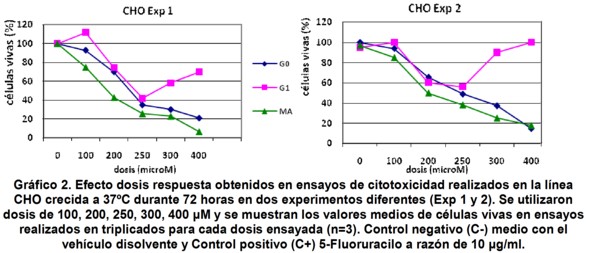
En el Gráfico 2, puede confirmarse una vez más que el máximo efecto inhibitorio para G1 se logró con una dosis de 250 µM. Ambos experimentos corroboraron que el empleo de dosis superiores a 250 µM, no lograron inhibir el crecimiento celular y generaron una curva dosis respuesta no usual, que sugiere un efecto de resistencia de esta línea celular al producto G1. Las alteraciones genéticas y bioquímicas responsables de la resistencia simultánea a múltiples drogas han sido objeto de intensas investigaciones por más de 25 años, 27-28 llegándose a conocer varios genes, proteínas y vías metabólicas implicadas en este proceso. El efecto observado pudiera estar asociado a la sobreexpresión de la proteína del gen mdr1 que codifica una proteína de 170 kd (p170), también conocida como glicoproteína p (Gp) presente en la membrana celular y que participan en un amplio rango de eventos como la expulsión de sustancias nocivas, secreción de toxinas y movilización de iones y péptidos29-30. Con el objeto de demostrar esta hipótesis deberán ser diseñados experimentos que podrían cuantificar los niveles del transcripto primario de este gen o bien los niveles de expresión de la proteína en las células tratadas que manifiesten resistencia al producto.
Resultó de interés indagar si este particular efecto observado en la curva dosis respuesta con altas concentraciones de G1 en CHO-K1 se repetía en otras líneas celulares. Para dar respuesta a esta interrogante ensayamos la citotoxicidad en la línea murina P3 X63/AG8/653, con características de cultivo diferentes a las células CHO K1, por ser estas células tumorales independientes de anclaje.
El empleo de líneas celulares con características de crecimiento diferentes (libres y ancladas a la matriz), nos brindó información sobre las variaciones que tiene lugar para obtener las dosis efectivas para cada producto y evidenció que estas dosis son dependientes del origen de la línea utilizada en el estudio.
El Gráfico 3 muestra la curva dosis respuesta para tres productos sintetizados y mostrados en la Figura 1.
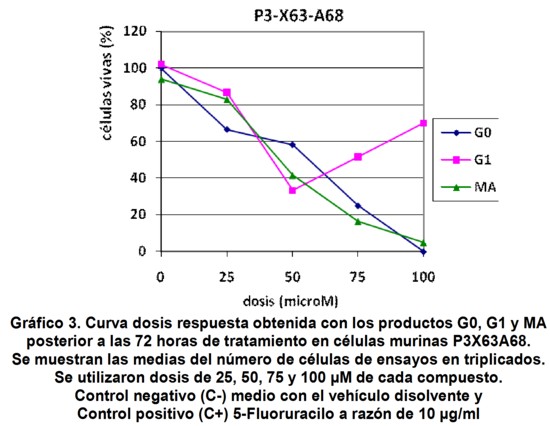
Aunque con valores de IC50 inferiores a los obtenidos en la línea CHO-K1, se observó el mismo efecto de resistencia a G1 con dosis superiores a 50 µM (dosis máxima efectiva), donde se incrementó el porcentaje de células vivas a las 72 horas de iniciados los ensayos, al igual que los experimentos donde se empleó la línea celular CHO-K1. Corresponde destacar que el efecto de resistencia registrado en estos estudios dependió de la línea celular. Si bien en ambas líneas este fenómeno fue observado con G1, en otros experimentos empleando líneas celulares normales de fibroblastos de riñón de mono verde (VERO) y tumorales (SK-MEL-3 y T47 D) de melanoma humano y adenocarcinoma de mama respectivamente, este fenómeno antes mencionado no fue evidenciado (Resultados no mostrados).
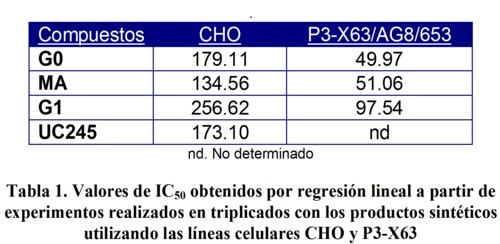
La Tabla 1 resume los valores de IC50 calculados mediante regresión lineal para los derivados del 2-furiletileno en dos líneas celulares. Los resultados obtenidos y allí mostrados reflejan los valores de IC50 para los cuatro productos. El rango de estos valores fueron menores en la línea celular P3-X63/AG8 (49.97 97,54 µM) que el rango de valores de IC50 obtenidos con la línea CHO-K1 de anclaje dependiente (134.56 256.62 µM). Entre otras causas, este resultado podría estar asociado a las diferentes características culturales que ambas líneas celulares presentan durante su crecimiento, por ejemplo; las líneas celulares dependiente de anclaje como CHO-K1, a diferencia de la línea de mieloma murino P3 X63/AG8, forman una monocapa con una matriz celular que presupone la presencia del complejo proteico garantizador de la unión entre células, y de éstas con el soporte al que están ancladas. La unión estrecha presente en las células dependientes de anclaje puede constituir una barrera a la acción del xenobiotico, al dejar solamente la cara apical de la célula expuesta al producto.
En el caso de las células de mieloma, al crecer libres en el medio de cultivo presentan toda su superficie expuesta al producto, lo que hace que las células al desarrollarse independientes una de la otra, queden vulnerables a la acción del "fármaco". En estudios realizados con el extracto de Aloe, Kametani S y col., 2007 mostraron que este extracto causó un efecto inhibidor del crecimiento dosis dependiente en las células ascíticas de Ehrlich, las que crecen en suspensión y no, en los fibroblastos de embriones de ratón NIH3T3 que lo hacen anclados a la superficie del frasco31.
A pesar de que existen pocos trabajos en la literatura revisada que comparan el efecto de compuestos antitumorales entre células ancladas y células libres en el medio, hay una tendencia actual al surgimiento y desarrollo de los estudios tridimensionales in vitro mediante la construcción de biomodelos que emplean los esferoides celulares, dado que la acción del fármaco sobre la célula no es igual cuando éstas crecen en monocapas que cuando lo hacen en pequeños agrupamientos o "clusters" celulares aislados32-33, formas como naturalmente migran y se implantan en otros tejidos durante el proceso metastásico.
Sabido es que varios nitrocompuestos aromáticos inducen mutagénesis mediante modificaciones químicas del ADN como resultado de un ataque electrofílico del nitrógeno activado a las bases purínicas del ADN34-35. En el caso de los derivados furiletilenos, aquí estudiados, y con un grupo nitro acoplado a un doble enlace fuera del anillo furánico, se producen cambios significativos en las propiedades físico químicas, químicas y biológicas diferentes a los compuestos 5-nitrofuriletilenos. La adición del átomo de Br en diferentes combinaciones puede causar distintas respuestas dado lo voluminoso de este elemento, tal como queda reseñado en este trabajo.
En la familia de los 2-furiletilenos, el átomo de Br se ha ubicado en diferentes posiciones (Figura 1). Cuando se observan los resultados de los experimentos de citotoxicidad in vitro obtenidos aquí con estas entidades moleculares, llama la atención que el G1 con dos átomos de Br en su molécula haya sido el compuesto con menor actividad antiproliferativa, independientemente de la línea celular utilizada. Los demás compuestos sin Br (G0) o con un solo átomo del mismo en el anillo furánico (MA) presentaron valores inferiores de IC50 en la línea CHO-K1 y, por consiguiente, fueron mas citotóxicos que el G1. Varios trabajos muestran que la posición del átomo de Br en C24 o C44, definió la actividad de las propiedades farmacológicas en dos derivados diferentes de la Daunorubicina, las moléculas WP401 (activa) y WP400 (inactiva)34-36.
Los resultados que se exponen prueban la importancia que tiene la ubicación de estos átomos de Br sobre la molécula y su relación con la actividad biológica mediada por la unión a una molécula diana aun no identificada. Estos resultados contribuyen al entendimiento de los trabajos dedicados a la predicción de actividad biológica de compuestos sintetizados.
En la actualidad, el descubrimiento de nuevas drogas se ha movido desde la identificación de compuestos citotóxicos por tamizaje hasta la acción sobre blancos moleculares específicos, por tal motivo es importante el descubrimiento de nuevos agentes citotóxicos, válidos y confiables, que sean ampliamente activos en una amplia gama de tumores. En suma, nuevos fármacos deberán ser obtenidos y ensayados en la búsqueda de una entidad molecular prometedora para el tratamiento del cáncer.
CONCLUSIONES
La posición y el número de átomos de Br afectó la citotoxicidad de los cuatro derivados 2-furiletileno estudiados.
Todos ellos mostraron valores discretos de citotoxicidad al comparárselos con los datos existentes en la literatura para fármacos antitumorales comerciales con valores de IC50 superiores a los 100 µM.
G1, con dos átomos de Br en su estructura molecular, mostró el mayor valor de IC50 (256.62 µM), evidenciando una marcada inhibición de su citotoxicidad, y exhibió, asimismo, una curva dosis respuesta no convencional, típica del efecto de resistencia y dependiente de la línea celular ensayada.
G1 sugirió la activación de un mecanismo de resistencia en la línea celular CHO K1 y P3-X63/AG8, debiéndose esto complementarse con experimentos al efecto a fin de confirmar este resultado.
La sustitución del átomo de bromo por el grupo metilo en la cadena carbonada lateral incrementó ligeramente la citotoxicidad del producto.
REFERENCIAS
1.- Gottesman M. Mechanisms of cancer drug resistance. Rev Med 2002;53:615-627.
2.- Estrada E. Structure-mutagenicity relationships in 2-furylethylene derivatives. A molecular orbital study of the role of nitro groups. Mutat Res 1998;420(1-3):67-75.
3.- González-Díaz H, Olazábal E, Santana L, Uriarte E, González-Díaz Y, Castañedo N. QSAR study of anticoccidial activity for diverse chemical compounds: Prediction and experimental assay of trans-2-(2-nitrovinyl)furan. Bioorganic and Medicinal Chemistry 2007;15(2):962-968.
4.- Castañedo N, Goizueta R, Perez J, Gonzalez J, Silveira E, Cuesta M, et al., inventors; Procedure for the obtainment of 1-(5- bromofur-2-il)-2-bromo-2-nitroethene and its microcide action. Cuba 1994.
5.- Hulbert P, Bueding E, Robinson C. Structure and antischistosomal activity in the nitrofuryl series. J Med Chem 1973;16:72-78.
6.- Yahagi T, Nagao N, Hara K, Matsushima T, Sugimura T, Bryan T. Relationships between the carcinogenic and mutagenic or DNA modifying effects of nitrofuran derivatives, including 2 2-furyl.-3 5-nitro-furyl.acrylamide, a food additive. Cancer Res 1974;34:2266-2273.
7.- McCalla D. Mutagenicity of nitrofuran derivatives. Environ Mutagen 1983;5:745-765.
8.- Sturdik E, Drobnica L, Balaz S. Interactions of 2-furylethylenes with thiol enzimes. Coll Czech Chem Commun 1983;48:327-335.
9.- Rosenberg M, Balaz S, Sturdik E, Kucha´r A. Reactivity of 2-furylethylenes with nucleophilic groups and its biological significance. Coll Czech Chem Commun 1987;52:425-436.
10.- Hertiani T, Edrada-Ebel R, Ortlepp S, van Soest RW, de Voogd NJ, Wray V, et al. From anti-fouling to biofilm inhibition: new cytotoxic secondary metabolites from two Indonesian Agelas sponges. Bioorg Med Chem 2010;18(3):1297-311.
11.- de Oliveira MF, de Oliveira JH, Galetti FC, de Souza AO, Silva CL, Hajdu E, et al. Antimycobacterial brominated metabolites from two species of marine sponges. Planta Med 2006;72(5):437-441.
12.- Abdel-Aziz HA, Hamdy NA, Gamal-Eldeen AM, Fakhr IM. Synthesis of new 2-substituted 6-bromo-3-methylthiazolo[3,2-alpha]-benzimidazole derivatives and their biological activities. Z Naturforsch C 2011;66(1-2):7-16.
13.- Serra AC, Pineiro M, Rocha Gonsalves AM, Abrantes M, Laranjo M, Santos AC, et al. Halogen atom effect on photophysical and photodynamic characteristics of derivatives of 5,10,15,20-tetrakis(3-hydroxyphenyl)porphyrin. J Photochem Photobiol B 2008;92(1):59-65.
14.- Jiang Y, Lin HX, Li M, Wu BL, Chen JM. Preparation and evaluation of new brominated paclitaxel analogues. J Asian Nat Prod Res 2005;7(3):231-236.
15.- Sisa M, Pla D, Altuna M, Francesch A, Cuevas C, Albericio F, et al. Total synthesis and antiproliferative activity screening of (+/-)-aplicyanins A, B and E and related analogues. J Med Chem 2009;52(20):6217-6223.
16.- Hladon B, Goslinski T, Laskowska H, Baranowski D, Ostrowski T, Zeidler J, et al. In vitro cytostatic activity of 8-substituted and tricyclic analogues of acyclovir. Pol J Pharmacol 2002;54(1):45-53.
17.- Narita T, Suga A, Kobayashi M, Hashimoto K, Sakagami H, Motohashi N, et al. Tumor-specific cytotoxicity and type of cell death induced by benzo[b]cyclohept[e][1,4]oxazine and 2-aminotropone derivatives. Anticancer Res 2009; 29(4):1123-1130.
18.- Lai Y, Lu M, Lin S, Wu H, Z. C. Electrospray ionization tandem mass spectrometric characterization of DNA adducts formed by bromobenzoquinones. Rapid Commun Mass Spectrom 2011;25(19):2943-2950.
19.- Fekry MI, Price NE, Zang H, Huang C, Harmata M, Brown P, et al. Thiol-activated DNA damage by alfa-bromo-2-cyclopentenone. Chem Res Toxicol 2011;24(2):217-228.
20.- Koch C, Heine A, Klebe G. Tracing the detail: How mutations affect binding modes and thermodynamic signatures of closely related aldose reductase inhibitors. Journal of Molecular Biology 2011;406(5):700-712.
21.- Hardegger LA, Kuhn B, Spinnler B, Anselm L, Ecabert R, Stihle M, et al. Halogen Bonding at the Active Sites of Human Cathepsin L and MEK1 Kinase: Efficient Interactions in Different Environments. Chem Med Chem 2011 Sep 6.
22.- Hernandes MZ, Cavalcanti SMT, Moreira DRM, De Azevedo Jr WF, Leite ACL. Halogen atoms in the modern medicinal chemistry: Hints for the drug design. Current Drug Targets 2010;11(3):303-314.
23.- Kraut D, Churchill M, Dawson P, Herschlag D. Evaluating the potential for halogen bonding in the oxyanion hole of ketosteroid isomerase using unnatural amino acid mutagenesis. ACS Chemical Biology 2009;4(4):269-273.
24.- Riley KE, Murray JS, Fanfrlik J, Rezac J, Sola RJ, Concha MC, et al. Halogen bond tunability I: the effects of aromatic fluorine substitution on the strengths of halogen-bonding interactions involving chlorine, bromine, and iodine. J Mol Model 2011 Mar 4.
25.- Melandri S. "Union is strength": how weak hydrogen bonds become stronger. Phys Chem Chem Phys. 2011 Aug 21;13(31):13901-1311.
26.- Barbini L, Lopez P, Ruffa J, Martino V, Ferraro G, Campos R, et al. Induction of apoptosis on human hepatocarcinoma cell lines by an alkyl resorcinol isolated from Lithraea molleoides. World J Gastroenterol 2006;12(37):5959-5963.
27.- Arias J. Drug targeting strategies in cancer treatment: an overview. Mini Rev Med Chem 2011;11(1):1-17.
28.- Arias JL, Clares B, Morales ME, Gallardo V, MA. R. Lipid-based drug delivery systems for cancer treatment. Curr Drug Targets 2011;12(8):1151-1165.
29.- Mayur YC, Padma T, Parimala BH, Chandramouli KH, Jagadeesh S, Gowda NM, et al. Sensitization of multidrug resistant (MDR) cancer cells to vinblastine by novel acridones: correlation between anti-calmodulin activity and anti-MDR activity. Med Chem 2006;2(1):63-77.
30.- Hasegawa H, Inui N, Suda T, Shibata K, Nakamura Y, Watanabe H, et al. Expressions of multidrug resistance protein 1 and multidrug resistance-associated protein 1 in lung dendritic cells. Life Sci 2011;89(7-8):282-287.
31.- Kametani S, Oikawa T, Kojima A, Opare D, Norikura T, Honzawa M, et al. Mechanism of growth inhibitory effect of cape aloe extract in Ehrlich ascites tumor cells. J Nutr Sci Vitaminol 2007;53:540-546.
32.- do Amaral JB, Rezende-Teixeira P, Freitas V, G. M. MCF-7 Cells as a Three-Dimensional Model for the Study of Human Breast Cancer. Tissue Eng Part C Methods 2011 Sep 1. [Epub ahead of print].
33.- Lee SY, Jeon EK, Jeon HM, Kim CH, Kang HS. Implication of necrosis-linked p53 aggregation in acquired apoptotic resistance to 5-FU in MCF-7 multicellular tumour spheroids. Oncol Rep 2010;24(1):73-79.
34.- Gao Y, Priebe W, Wang H. Substitutions at C2' of daunosamine in the anticancer drug daunorubicin alter its DNA-binding sequence specificity. Eur J Biochem 1996;240:331-335.
35.- Priebe W. Mechanism of action-governed design of anthracycline antibiotics : A "turn-off/turn-on" approach. Curr Pharm Design 1995;1:51-68.
36.- Dutta R, Gao G, Priebe W, Wang A. Binding of the modified daunorubicin WP401 adjacent to a T-G base pair induces the reverse Watson-Crick conformation: crystal structures of the WP401-TGGCCG and WP401-CGG[br5C]CG complexes. Nucleic Acids Res 1998;26(12):3001-3005.
CORRESPONDENCIA:
Oscar Hernández Betancourt
Centro de Inmunología y Productos Biológicos (CENIPBI), Universidad Médica. Apdo 150.
General Gómez ? 3, apto 2.
Camagüey, CP70100.
Cuba
mail osamuel1964 @ gmail.com
