Indice del volumen Volume index
Comité Editorial Editorial Board
Comité Científico Scientific Committee
MICROSCOPIA ELECTRONICA DE BARRIDO DE LA VELLOSIDAD PLACENTARIA CORRESPONDIENTE A FETO CON MÚLTIPLES MALFORMACIONES CONGÉNITAS
Prof. Olivar C Castejón S
Laboratorio de Microscopía Electrónica. Facultad de Ciencias de la Salud. Universidad de Carabobo - Núcleo Aragua.
Director del Centro de Investigación y Análisis Docente Asistencial del Núcleo Aragua (CIADANA). Maracay, Edo.
Aragua. Venezuela.
olivar.ciadanauc @ gmail.com
Rev Electron Biomed / Electron J Biomed 2012;1:50-59
RESUMEN:
Describir la estructura tridimensional de la vellosidad placentaria con técnicas de microscopía electrónica de barrido en un caso de aborto espontáneo, de 16 semanas de gestación, con múltiples malformaciones congénitas, es el propósito de este trabajo.
Muestras fueron tomadas de 4 regiones marginales de la placenta y una región central a las cuales se aplicaron los procedimientos convencionales de microscopía electrónica de barrido siendo previamente observadas con la microscopía de luz. Vellosidades de otro caso de aborto terapéutico, a la misma edad gestacional, se tomaron como control. De cada región cinco especimenes fueron tomadas en sala de parto y fijadas en 2% de glutaraldehido para su procesamiento.
Los resultados muestran vellosidades intermedias inmaduras con depósitos de fibrinoide, escasos brotes sincitiales, superficie carente de microvellosidades y algunas con estroma compacto o fibrótico. La superficie que no mostraba brotes sincitiales en exceso se presenta con ondulaciones y profundas invaginaciones. No se notaron alteraciones en la forma de ramificación. Se encontró ausencia de hiperplasia y de lagunas o cisternas estromales. Vellosidades intermedias maduras, alargadas, delgadas y rectas se observaron con membranas vásculo sincitiales.
Las observaciones en la placenta estudiada exhiben un patrón morfológico correspondiente a la semana 16 el cual no permite predecir sobre anormalidad cariotípica alguna aunque con algunas diferencias morfológicas cuando se comparan con las obtenidas del control. Dada la carencia de determinación cariotípica, se ha sugerido que mutaciones ligadas al cromosoma X durante la blastogénesis pudieran ser las causantes de las múltiples malformaciones fetales.
PALABRAS CLAVE:Microscopia Electrónica de Barrido. Vellosidad placentaria. Malformaciones congénitas.
SUMMARY:
To describe the three dimensional structure of the placental villi with technics of scanning electron microscopy in a case of spontaneous abortion of 16 weeks gestation with multiple inherited malformations is the proposal of this work.
Samples were taken of four marginal regions of the placenta and one of central region which were examined with conventional procedures of scanning electron microscopy previously being observed with light microscopy. Villi of another case of induced abortion at same gestational week were taken as control. Five specimens of each region were selected in delivery room and fixed in 2 percent of glutaraldehyde for their processing.
The results showed immature intermediate villi with deposits of fibrinoid and scarce syncytial sprouts. The placental villi showed trophoblastic surface absent of microvilli and with a dense stroma or fibrotic. The surface no showed abundant syncytial sprouts. Villus scalloping with trophoblastic invaginations, were noted without alterations in branching of placental villi. It was found absence of placental hyperplasia or of stromal cisterns.
The observations in the studied placenta exhibited a morphological pattern according to week 16 which no permit to predict about abnormal karyotypic. These no karyotyped samples observed sugest that mutations linked to X chromosome during blastogenesis could be cause of the multiple inherited fetal malformations.
KEYWORDS: Scanning Electron Microscopy. Placental Villi. Congenital Malformations.
INTRODUCCIÓN
La Microscopía Electrónica de Barrido (MEB) ha sido una técnica valiosa en la evaluación de material placentario procedente de abortos la cual confirma los hallazgos realizados con la microscopía de luz, complementando los estudios histopatológicos1 en los cuales no son bien conocidos los agentes etiológicos del mal desarrollo fetal en el aborto espontáneo2. La agregada consideración de la estructura tridimensional de la vellosidad placentaria en la evaluación de abortos tempranos proporciona una mayor confianza al histopatólogo3. Correlación entre la morfología de la vellosidad placentaria y el cariotipo subyacente ha sido demostrada4. Sobre la base de diámetro velloso estimado, superficie vellosa, patrón de ramificación, número de brotes sincitiales y depósitos de fibrina 5 grupos (ABCDE) de vellosidades se clasificaron de porciones de placenta con la MEB de abortos espontáneos entre las 6 y 16 semanas de gestación. En 4 de esos grupos el cariotipo fue determinado. Así por ejemplo el grupo B presentó vellosidades poco ramificadas, con muchos brotes sincitiales densamente cubiertos con microvellosidades, pero con poca deposición de fibrina que caracterizaba a una trisomia o bien una monosomia X, de aborto espontáneo4.
En este trabajo se propone evaluar la vellosidad placentaria con MEB correspondiente a un feto de 16 semanas afectado por la malformación de Dandy-Walker, ventriculomegalia cardiaca severa, encefalocele, gastroquisis, retardo de crecimiento en miembros superiores e inferiores y polidramnios. RaSgos diagnosticados mediante ultrasonografía durante el inicio del segundo trimestre del embarazo.
Dado que no se presenta la determinación del cariotipo en este caso nos interesamos en investigar si las vellosidades exhiben en el trofoblasto las características ya descritas en casos de monosomías, triploidias o trisomias que nos permita por similitud sugerir alguna anomalía cromosómica. Desórdenes de la ramificación, arrugas del sincitio, brotes sincitiales en grupos, disposición de la fibrina, organización de microvellosidades y grosor de las vellosidades han sido características de interés observados en placentas asociadas a embriones desorganizadas severamente.
El propósito de este trabajo describir la estructura tridimensional de la vellosidad placentaria con técnicas de MEB en un caso de aborto espontáneo de 16 semanas de gestación con múltiples malformaciones congénitas.
MATERIAL Y METODOS
Material de una placenta obtenida por curetaje de un aborto espontáneo, de 16s de gestación, con múltiples malformaciones congénitas ya indicadas en la introducción y diagnosticadas mediante ultrasonografía fue obtenido para la observación con el MEB sin estudio genético. Material de otra placenta procedente de un aborto terapéutico a la misma semana de gestación fue tomado como control cuyo feto no presentó malformaciones congénitas. Diez láminas, por cada placenta fueron teñidas con H&E para su observación con la microscopía de luz. Cinco biopsias fueron tomadas de ambas placentas: una de la región central parabasal y cuatro de las regiones marginales abarcando placa corial y placa basal. De cada biopsia cinco secciones de 5x5x2mm fueron lavadas en sala de parto en buffer fosfato 0.1M, pH 7.3 y colocadas por inmersión en 2% de glutaraldehido en el mismo buffer por 2 horas. Posteriormente lavadas por tres veces, 1/2 hora cada vez en el buffer fosfato y finalmente en agua destilada para eliminar los cristales del buffer. De seguida se fijaron en 1% de tetraoxido de osmio, en buffer fosfato durante 18 horas, lavadas tres veces ½ hora cada vez en buffer y finalmente en agua destilada5.
La deshidratación se inició a partir del etanol de 70% con dos pases de 15 minutos; se continuó igualmente con la serie de 85%, 95% y 100%. Una mezcla de etanol y amyl acetato, en frío, en concentraciones sucesivas de 3:1; 1:1; 1:3, fue empleada después del alcohol de 100% durante 15 minutos. Posteriormente se dejaron en amyl acetato puro, a 4ºC, por el mismo tiempo y se llevaron al desecador de punto crítico HCP-2 Hitachi. Una vez desecadas las secciones fueron disecadas, para eliminar vellosidades, bajo la lupa estereoscópica Zeiss y de esta manera exponer la zona de observación. Las secciones se montaron en el porta especimen y se limpiaron con un chorro de aire comprimido. Luego se cubrieron con Pt-Pd, en un cobertor iónico Eiko-IB3 Hitachi. Las secciones de material ya cubierto fueron observadas en un microscopio electrónico de barrido Hitachi S2300. Microfotografías fueron tomadas en un rango de 500x a 1500x.
RESULTADOS
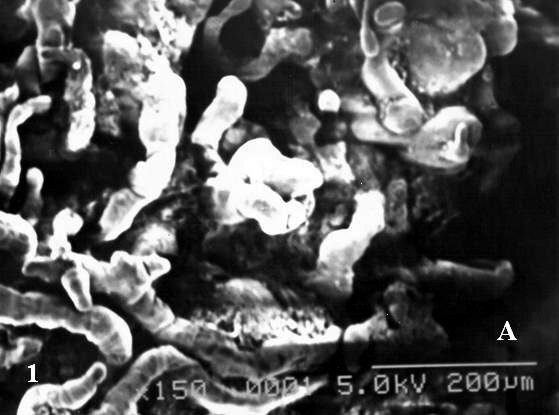
Una panorámica general (Fig. 1 A) nos muestra una visión tridimensional de algunas de los diferentes tipos de vellosidades encontradas en las regiones analizadas. En estas se encontraron vellosidades intermedias inmaduras (vii) en una mayor proporción que las vellosidades intermedias maduras (vim), vellosidades terminales (vt) y troncales (vtr). Las vii predominan en las observaciones del grupo estudio al igual que en el control.
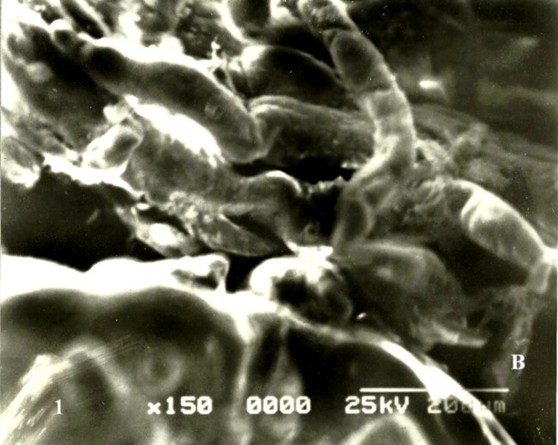
Saliendo de la superficie de las vii se notan brotes sincitiales en una cantidad mínima de uno a tres. Numerosas vim son demasiadas delgadas cuando se comparan con el control (Fig 1B) conservando una trayectoria mas o menos recta o con ligeras ondulaciones. Estas vim presentaron una superficie trofoblástica con arrugas durante su trayecto. En algunas de estas el contenido del estroma se ha separado completamente del trofoblasto quedando un anillo periférico edematoso subyacente al trofoblasto cuando son vistas con el MEB. La superficie de la vellosidades en muchas de ellas se nota muy lisa con escasas microvellosidades. No se notaron cambios respecto a las ramificaciones vellosas.
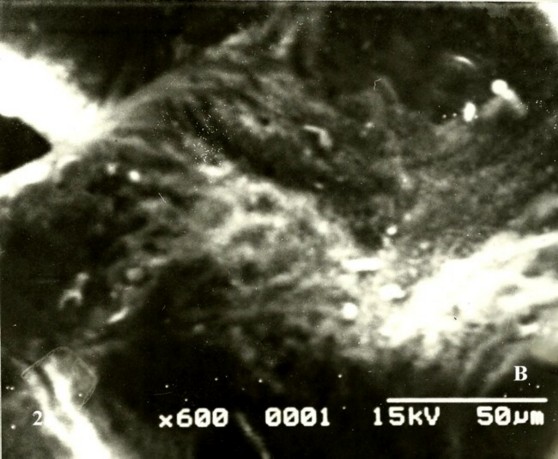
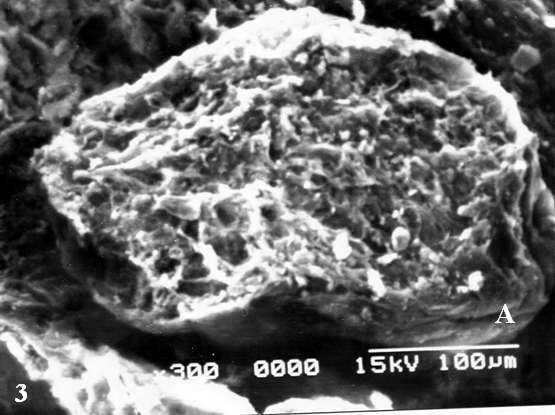
Cuando se observa a mayor amplificación las superficies de la vii se notaron cubiertas por fibrinoide con notables cambios degenerativos y corrugadas (Fig. 2A).En el control la superficie permaneció normal (Fig.2B). Vellosidades avasculares conformadas por un estroma muy compacto o fibrótico fueron observadas (Fig. 3A).

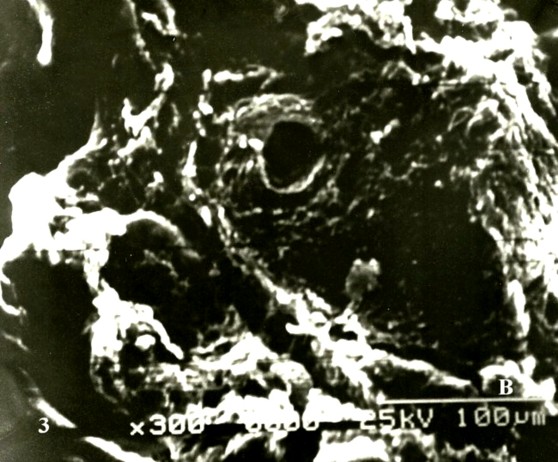
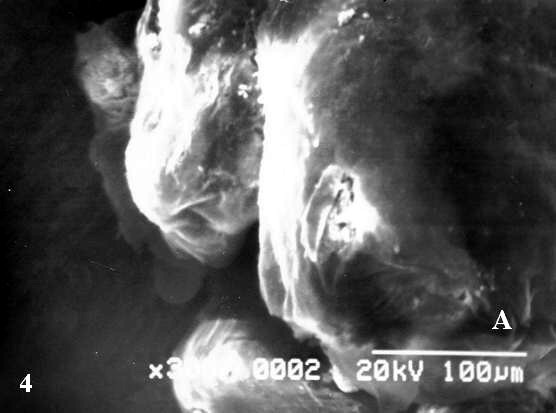
Sobre la superficie de vii no se observaron abundantes formaciones trofoblásticas con forma de mazo, gotas o comas que caracterizan a algunas de las vellosidades que presentan anormalidades cariotípicas ni tampoco una superficie cubierta por un cesped de microvellosidades; por el contrario las superficies se observaron lisas (Fig. 4A) mientras que el control presentó brotes sincitiales (Fig 4B).
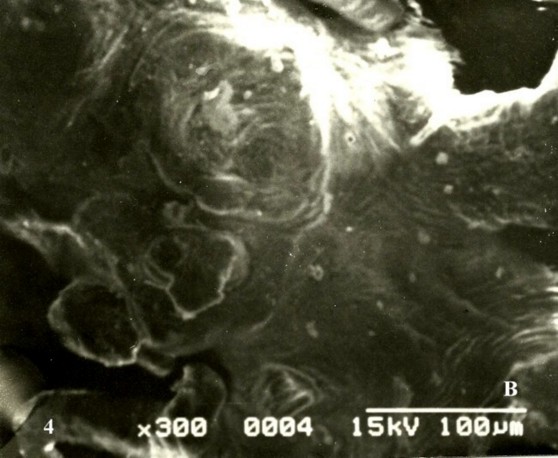
En algunas vim se notaron profundas invaginaciones o intraproyecciones del trofoblasto hacia el estroma quedando una concavidad que mira hacia el espacio intervelloso de forma cilíndrica, esférica u ovoide según se realice la invaginación (Fig. 5A).Estas no se observaron en el control (Fig.5B).

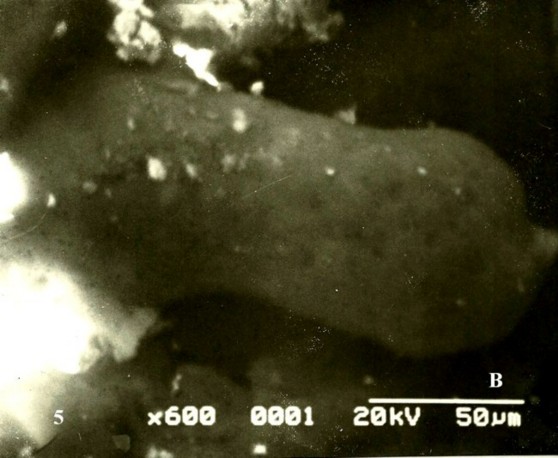
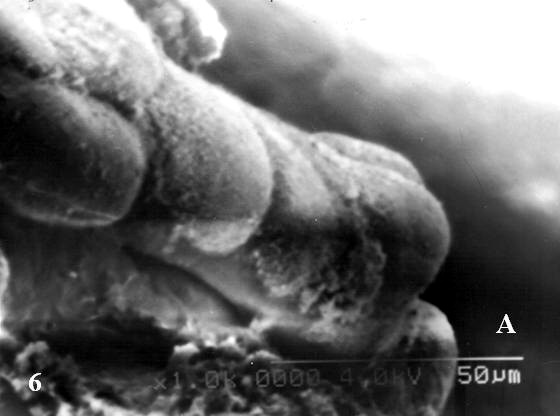
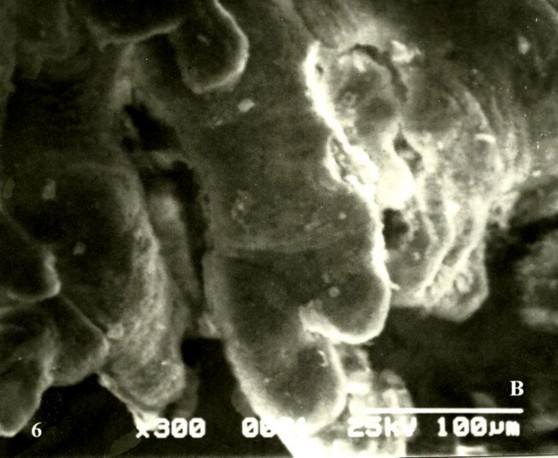
En los extremos de algunas de las vim suelen verse hasta seis de los abultamientos correspondientes a la formación de las primeras membranas vásculo-sincitiales cubiertas por algunas microvellosidades trofoblásticas (Fig. 6A). Solo dos abultamientos se observaron en el control (Fig.6B).
No se encontró hiperplasia del trofoblasto. Además se notaron vellosidades con regiones de superficies trofoblásticas ausentes o interrumpidas dejando al descubierto el estroma y mirando cuando "in vivo", hacia el espacio intervelloso. Brotes sincitiales tapizados por depósitos de fibrina estuvieron ausentes así como su aparición en grupos. Vellosidades esféricas muy abultadas o globulosas, notablemente arrugadas no se encontraron.
DISCUSIÓN
De las anomalías fetales diagnosticadas por ultrasonografía en este caso, teóricamente, podemos correlacionar con los siguientes trastornos cromosómicos: 45, X; trisomía 13, 18; o triploidia6. Las vellosidades placentarias con estas anomalías cromosómicas presentan una serie de características agrupadas según la ramificación vellosa, diámetro velloso, superficie del sincitio, brotes sincitiales y deposición de fibrina. Así por ejemplo, vellosidades con brotes sincitiales gruesos con forma de dedos u hojas se corresponden con trisomía 164 o brotes con forma de mazo dispuestos en grupos sin depósitos de fibrina se corresponden con trisomía 9. Nuestros resultados no describen razgos atribuidos a un cariotipo anormal. Esto significa que si bien el feto presenta múltiples malformaciones congénitas no hay una evidencia ultraestructural demostrada con la MEB que sugiera una anormalidad cromosómica. Este tipo de especimen fetal teniendo anomalías pero, probablemente, un cariotipo normal ha sido descrito en la literatura7.
La importancia de este estudio radica en que hay casos cuando colocadas las vellosidades en medio de cultivo, para iniciar rápidamente el estudio citogenético, la determinación del cariotipo resulta fallida y nos encontramos como el caso acá planteado. En otros estudios de malformaciones no siempre el análisis cromosómico resulta anormal. Tetramelias asociadas a otras anomalías dan cariotipo normal8. En un caso donde el cariotipo resultó fallido relacionado con amelia del miembro superior asociado con otras malformaciones la hibridización "in situ" de tejido incluido en parafina demostró conjuntos de cromosomas 13, 18, 21, X & Y normales no demostrándose defecto genético alguno9. Si bien el cariotipo puede ser normal una mutación recesiva autosómica rara, debido al estado homocigótico, pudiera ser responsable de las malformaciones donde el feto aparece sin extremidades además de tener otras malformaciones asociadas10.
Por otro lado, la presencia de invaginaciones trofoblásticas hacia el estroma en nuestro material visto con MEB ratifica lo observado también por nosotros como inclusiones trofoblásticas estromales vistas mediante microscopía de luz, en un trabajo cuyos resultados han sido enviados a publicación. La presencia de inclusiones trofoblásticas diagnosticadas previamente en el material observado han sido consideradas como marcadores de anomalías genéticas durante el embarazo temprano11-12.
La evaluación de material procedente de abortos espontáneos del primer trimestre de embarazo adquiere cada vez más su importancia en la búsqueda de cambios histopatológicos que contribuyan con el mejor diagnóstico13. Otros han encontrado abundantes apoptosis y disminución de proliferación de células estromales en vellosidades cromosómicamente anormales14 o una disminución del diámetro de la vellosidad y de los capilares estromales observados en secciones histológicas transversales15.
Con respecto a las membranas vásculo-sincitiales observadas si bien se corresponden con la edad gestacional se ha encontrado una disminución de ellas en estos casos de muerte embrionaria o embarazos anembrionados por mal desarrollo mediante estudios de inmunocitoquímica con CD34 y control de casos16. La fibrosis vellosa y el borde festoneado del trofoblasto, con inclusiones trofoblásticas cuando vistas con la microscopía de luz en nuestros resultados son rasgos que han sido utilizados para predecir un cariotipo anormal, aunque parcialmente, como por ejemplo, una triploidia1. Además la hiperplasia del trofoblasto 17 asociada a lagunas hidrópicas estromales son también características predictivas de una identificación de triploidia18 las cuales no fueron encontradas en el material acá empleado.
A iguales resultados se han llegado en casos de malformación de Chiari tipo II donde las vellosidades permanecen morfológicamente normales, sin exhibir rasgos que puedan predecir anormalidad del cariotipo aún y cuando coexisten con trisomías 13 o 1819-20. Es posible que las observaciones captadas tanto por la microscopía de luz y confirmada tridimensionalmente por la MEB sean producto de mutaciones genéticas en condición homocigótica ligadas al cromosoma X en etapas entre las 7 y 28 s de embarazo, durante la blastogénesis que no producen variaciones en el número diploide de cromosomas permaneciendo el cariotipo normal21.
En conclusión una visión tridimensional de la vellosidad placentaria en caso de feto con múltiples malformaciones congénitas ha sido realizada con la MEB la cual no refleja características predictivas de trisomías, triploidias o de alguna anormalidad en el cariotipo por lo que se presume que mutaciones genéticas son la causa de las múltiples anomalías congénitas fetales mientras que la placenta permaneció normal.
REFERENCIAS
1. Novak R, Agamonalis D, Dasu S, Igel H, Platt M, Robinson H et al. Histological analysis of placental tissue in first trimester abortions. Pediat Pathol 1988; 8:477-482.
2. Baldwin VJ, Kalousek DK, Dimmick JE, Applegarth DA, Hardwick DF. Diagnostic pathologic investigation of the malformed conceptus. Pediat Pathol 1988; 9:65-108.
3. Ludwig H, Metzger H, Wolf H. The placenta (man). En: Hafez ESE ed Scanning Electron Microscopic. Atlas of Mammalian Reproduction. Tokyo, Georg Thieme Publishers Stuttgart. Igaku Shoin Ltd, 1975; 346-357.
4. Röckelein G, Ulmer R, Schwille R. Surface and branching of placental villi in early abortion: relationship to Karyotype Scanning electron microscopic study. Virchows Archivo A Pathol Anat 1990; 417:151-158.
5. Castejón OC. La superficie intervellosa de la placa basal de la placenta humana: estudio con el microscopio electrónico de barrido. Rev Obstet Ginecol Venez 2005; 65:167-173.
6. Redman CWG, Sargent IL, Starkey PM. La placenta humana. Guía para perinatólogos. Barcelona, Masson SA, 1995, p.103.
7. Sing RP, Carr DH. Congenital anomalies in embryos with normal chromosomes. Biol Neonate 1968; 13:121-128.
8. Sousa SB, Pina R, Ramos L, Pereira N, Krahn M, Borozdin W et al. Tetra-amelia and lung hipo/aplasia syndrome: new case report and review. Am J Med Genet A 2008; 146:2799-2803.
9. Zimpfer, Miny P, Dombrowski U, Tolnay M, Meyer P, Bruder E. Upper limb amelia, facial clefts, holoprosencefaly, and interrumpted aortic arch. Fetal Pediat Pathol 2007; 26:169-176.
10. Ohdo S, Madokoro H, Sonada T, Takei M, Yasuda H, Mori N. Association of tetra-amelia, ectodermal dysplasia, hypoplastic lacrimal ducts and sacs opening towards the exterior, peculiar face and developmental retardation. J Med Genet 1987; 24:609-612.
11. Kliman HJ, Segel L. The placenta may predict the baby. J Theor Biol 2003; 225:143-145.
12. Kliman HJ, Mc Sweet JC, Franco AM, Ying X, Zhao Y, Stellen G. Trophoblast inclusions are rare in elective terminations and normal deliveries, but common in cases with karyotypic abnormalities. Fertil Steril 2003; 80:88.
13. Tasci Y, Dilbaz S, Secilmis O, Dilbaz B, Ozfuttu A, Haberal A. Routine histopathologic analysis of product of conception following first-trimester spontaneous miscarriages. J Obstet Gynaecol Res 2005; 31:579-582.
14. Qumsiyeh MB, Kim KR, Ahmed MN, Bradford W. Cytogenetics and mechanisms of spontaneous abortions: increased apoptosis and decreased cell proliferation in chromosomally abnormal villi. Cytogenet Cell Genet 2000; 88:230-235.
15. Roberts L, Sebire NJ, Fowler D, Nicolaides KH. Histomorphological features of chorionic villi al 10-14 weeks of gestation in trisomic and chromosomally normal pregnancies. Placenta 2000; 21:678-683. 16. Lisman BA, Boer K, Bleker OP, van Wely M, van Gromingen K, Exalto N. Abnormal development of the vasculosyncytial membrane in early pregnancy failure. Fertil Steril 2004; 82:654-660.
17. Sebire NJ, Fowler D, Roberts L, Mahmood S, Nicolaides KH. Short communication: trophoblast proliferation is increased in chorionic villi from pregnancies with fetal trisomy 18. Placenta 2000; 21:584-586.
18. Castejón S O, Castejón M O. Microscopía electrónica de barrido de la hiperplasia en la vellosidad molar. Rev Chil Obstet Ginecol 2010; 75:101-106.
19. Castejón OC, Molinaro M, Quiroz D. La vellosidad placentaria en la malformación de Chiari tipo II. Rev Obstet Ginecol Venez 2005; 65:23-28.
20. Castejón OC, Quiroz D. Microscopía electrónica de barrido de la vellosidad placentaria en la malformación de Chiari tipo II. Salus 2005; 9:14-20.
21. Opitz JM, Wilson GN. Causes and pathogenesis of birth defects. In: Gilbert-Barness E ed. Potter´s pathology of the fetus and infant. Vol I. St Louis, Mosby-year Book, 1997, pp 44-64.
AGRADECIMIENTOS:
A la Histotecnóloga Dolores Martínez del Hospital Central de Maracay por facilitar la preparación de las láminas histológicas. A la Coordinación Administrativa de la Facultad de Ciencias de la Salud del Núcleo Aragua por el fondo fijo institucional para el CIADANA. Al personal médico del Servicio de Anatomía Patológica del Hospital "José A Vargas" del IVSS en Palo Negro, Maracay; Edo Aragua- Venezuela por la obtención del material placentario.
CORRESPONDENCIA:
Prof. Olivar C Castejón.
Prof. Titular en Biología Celular. Director del CIADANA.
Laboratorio de Microscopía Electrónica. Facultad de Ciencias de la Salud. Universidad de Carabobo - Núcleo Aragua. Centro de Investigación y Análisis Docente Asistencial del Núcleo Aragua (CIADANA).
Maracay, Edo. Aragua.
Venezuela.
olivar.ciadanauc @ gmail.com
Recibido, 28 de abril de 2012.
Publicado, 30 de abril de 2012
