Indice del volumen Volume index
Comité Editorial Editorial Board
Comité Científico Scientific Committee
EL ENZIMA INDOLEAMINA 2,3 DIOXIGENASA (IDO)
Y LA TOLERANCIA INMUNE
María Jesús Coma-del-Corral1, Pilar Muñiz Rodríguez2,
Joaquín Terán Santos3
1Unidad de Investigación del Hospital Universitario de Burgos.
2Departamento de Biología y Bioquímica molecular de la
Universidad de Burgos
3Unidad de Sueño del Hospital Universitario de Burgos.
Burgos. España
mjcoma @ hubu.es
Rev Electron Biomed / Electron J Biomed 2013;3:47-52.
Comentario de la revisora Dra Paula A. Enz. Jefa de Sección linfomas cutáneos, fotoféresis y fototerapia del Servicio de Dermatología.Hospital Italiano de Buenos Aires. Argentina.
Comentario del revisor Dr Carlos G. Musso. Subjefe del Servicio de Nefrología y Medio Interno del Hospital Italiano de Buenos Aires. Argentina
RESUMEN:
La indolamina 2,3-dioxigenasa (IDO) es un enzima predominante extrahepática intracelular y se encuentra en numerosas células, principalmente macrófagos. La degradación del triptófano genera quinurenina, y esta vía del metabolismo del triptófano, constituye un mecanismo eficaz de modulación de la respuesta inmune.
La IDO facilita la tolerancia inmunológica, y es uno de los principales actores implicados en la inhibición de la proliferación celular, incluyendo las células T activadas. La IDO induce la producción de especies reactivas de oxígeno (ROS) y radicales de óxido nítrico (NO). Varias vías implicadas en la regulación de respuesta inmunológica se regulan por mecanismos redox. Las especies reactivas del oxígeno y nitrógeno (ROS-RNS) y otras moléculas activas redox cumplen funciones clave en la inmunidad.
PALABRAS CLAVES: Indolamina 2,3-dioxigenasa. Metabolismo del Triptófano. Quinurenina
SUMMARY:
Indoleamine 2,3-dioxygenase (IDO) is an intracellular and extrahepatic enzyme predominantly found in many cells, especially macrophages. Tryptophan degradation generates kynurenine, and this pathway of tryptophan metabolism is an effective mechanism for modulating the immune response.
The IDO facilitates immune tolerance and is one of the main actors involved in the inhibition of cell proliferation, including activated T cells. IDO induces production of reactive oxygen species (ROS) and nitric oxide (NO) radicals. Several pathways involved in the regulation of immune response are regulated by redox mechanisms. Reactive oxygen and nitrogen species (ROS-RNS) and other redox active molecules play key roles in immunity.
KEYWORDS: Indoleamine 2,3-dioxygenase. Tryptophan metabolism. Kynurenine
Triptófano y quinurenina
Hay nueve aminoácidos llamados 'esenciales' porque el cuerpo humano es incapaz de sintetizarlos y, por tanto, el organismo debe adquirirlos en fuentes externas, principalmente a través de la dieta. Uno de ellos es el triptófano. Una vez que el triptófano ingerido ha sido absorbido por el organismo, podemos encontrarlo en la circulación en forma libre o, más frecuentemente, unido a la albúmina. El triptófano juega un papel tanto en la génesis de proteínas, como en diversas vías metabólicas, produciendo diferentes metabolitos, entre los que se cuenta la quinurenina1.
El triptófano puede ser metabolizado a través de diferentes vías; se oxida por la escisión del anillo de indol, ya sea iniciado por el enzima triptófano 2,3-dioxigenasa (TDO), que reside principalmente en el hígado y es inducida por corticoides2 o bien por el enzima llamada indolamina 2,3-dioxigenasa (IDO)3.
La indolamina 2,3-dioxigenasa (IDO) es un enzima predominante extrahepática y se puede encontrar en numerosas células, incluyendo macrófagos, microglia, neuronas y astrocitos4-6. La degradación del triptófano genera quinurenina, y esta vía es la ruta más importante que recorre el metabolismo del triptófano, pues constituye un mecanismo eficaz de modulación de la respuesta inmune. Además otros metabolitos de esa vía, pueden sinergizar o antagonizar estos efectos3. Esta vía está regulada por ciertas citoquinas y moléculas inflamatorias, entre las que destaca el interferón gamma (IFN-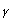 7. que induce la IDO en las células del sistema inmune8-9. En efecto, la IDO, que es el primer enzima de dicha vía, se activa cuando se produce una respuesta inmune a través del IFN-
7. que induce la IDO en las células del sistema inmune8-9. En efecto, la IDO, que es el primer enzima de dicha vía, se activa cuando se produce una respuesta inmune a través del IFN-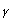 . A su vez, la deplección del triptófano y la producción de quinurenina modulan esta respuesta inmune.
. A su vez, la deplección del triptófano y la producción de quinurenina modulan esta respuesta inmune.
La vía de quinurenina está implicada en muchas enfermedades y trastornos, y son muchas las entidades patológicas en las que se han encontrado desequilibrios entre el triptófano y la quinurenina. La lista, por ahora, incluye enfermedades neoplásicas, infecciones por protozoos como la malaria, bacterianas y virales entre las que destaca el Virus de la Inmunodeficiencia Humana (VIH), enfermedades autoinmunes como la artritis reumatoide y la esclerosis múltiple y un amplio espectro de entidades neurológicas como enfermedad de Alzheimer, esclerosis lateral amiotrófica, corea de Huntington, y psiquiátricas como la depresión y la esquizofrenia. Veamos una panorámica:
La IDO posee un efectivo mecanismo bactericida y se ha relacionado con inmunosupresión de células T. La actividad de la IDO en las células infectadas, provoca un potente efecto bactericida, para luchar contra la propagación de la infección, mediante la degradación del triptófano de las bacterias autotróficas, provocando su muerte. También tienen efecto bactericida los metabolitos que resultan tóxicos para las bacterias, entre los que se cuenta la quinurenina. En los últimos años, se ha acumulado evidencia que IDO también juega un papel importante en las infecciones víricas, incluyendo VIH10, hepatitis B y C 11 e influenza12.
En los pacientes en hemodiálisis está incrementada la degradación del triptofano, asociada a un incremento de la concentracion de neopterina, lo que indica la implicación activa de la IDO13.
Algunos síntomas neuropsiquiátricos que aparecen en personas de edad avanzada parecen estar relacionados con una inflamación crónica de bajo grado, propiciadas por alteraciones en la vías enzimáticas del metabolismo del triptofano mediadas por la IDO. Se ha asociado a trastornos como esquizofernia o depresión14 Experimentalmente Capuron y col.15 comprobaron que el grado de inflamación, medido por los niveles séricos de interleuquina-6 y proteína C reactiva, se relacionó con la disminución de concentracion de triptófano y aumento del nivel de quinurenina en sangre, lo cual sugiere un incremento del catabolismo del triptófano inducido por la IDO.
El aumento del catabolismo del triptófano se asoció también con síntomas depresivos como astenia, desmotivación, anorexia, y pesimismo. La edad correlacionó significativamente con las concentraciones de marcadores inmunológicos y síntomas neuropsiquiátricos.
Son muchos los trabajos acerca de la importancia de la IDO en la enfermedad neoplásica, y en nuestra Unidad de Investigación hemos aportado algunas experiencias 16-18. Se ha demostrado que la IDO juega un papel fundamental en la inmunotolerancia a las células neoplásicas. Song y col. 19 demostraron el efecto inductor de la apoptosis de quinurenina sobre la línea celular neoplásica humana NK92 MI. En los cultivos, el tratamiento con L-quinurenina indujo la inhibición del crecimiento debido a la apoptosis, con dependencia de la dosis empleada. Y esto abre las puertas a nuevas dianas terapéuticas, que están siendo exploradas20.
El papel de IDO en la inducción de tolerancia inmunológica
La IDO se va desvelando como una importante molécula, implicada en la tolerancia inmunológica, ya que es uno de los principales actores implicados en la inhibición de la proliferación celular, incluyendo la de las células T activadas, y jugando de esta manera un papel decisivo, que permite el embarazo, los trasplantes, media en la autoinmunidad, e interviene en las neoplasias20.
La IDO fue descrita inicialmente como un enzima esencial para tolerancia materno-fetal. En 1998, Munn y col.21 vieron que la gestación en ratones era inmediatamente rechazada cuando se administraba un inhibidor de la IDO a ratones gestantes y formularon la hipótesis de que la expressión de la IDO era necesaria para prevenir el rechazo inmunológico del feto. Conceptuaron la IDO como un enzima catabolizador del triptófano, expresado en trofoblastos y macrófagos. Mediante la degradación del triptófano, la IDO podía suprimir la actividad de las células T, previniendo el rechazo de la gestación.
El control del suministro de micronutrientes, es una estrategia para regular las respuesta inmune mediada por células. Las células que expresan la IDO, provocan el catabolismo del triptófano, que es un aminoácido esencial, necesarios para la proliferación celular, y de esta manera, intervienen en la respuesta inmune. En este sentido, se ha demostrado que la actividad IDO promueve cambios metabólicos celulares que afectan a la respuesta celular y sistémica debida a estímulos inflamatorios o inmunológicos en diferentes entidades clínicas como procesos neoplásicos, infecciones crónicas, autoinmunes, síndromes alérgicos, y trasplantes22.
El carácter antiproliferativo de la IDO en bacterias, protozoos y células tumorales fue descrito por primera vez por Pfefferkorn23 en 1984 y por Taylor y Feng24 en 1991.
La IDO provoca la degradación del triptofano en quinurenina, en el interior de las células. Esto tiene amplias implicaciones en la respuesta inmune del organismo.
Hoy en día, se sabe que la IDO forma parte de un mecanismo de regulación local inmune rápida, llamada "regulación inmune metabólica" mediante la provocación de un nivel de tolerancia inmune sistémica, protectora de reacciones inmunes violentas22.
Es evidente el papel de las quinureninas en el sistema inmune, como consecuencia del efecto inmunosupresor de IDO. Hay evidencia de interaccion entre la vía de quinurenina, las citocinas y el sistema nervioso. La IDO juega un papel clave conectando el sistema inmunológico con la vía de la quinurenina. Los estímulos proinflamatorios activan la vía metabólica triptófano, mientras que la IDO, al propiciar la degradación del triptofano, ejerce un efecto inmunosupresor, que incluye la inhibición de las funciones de células T, la activación de las células T reguladoras, y la inhibición de linfocitos NK. Hay una estrecha relación entre las citocinas (IFN-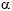 , IFN-
, IFN-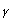 , TNF-
, TNF-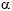 , TGF-
, TGF- , IL-4 e IL-23) y el sistema quinurenina. Frente a la activación mediada por interferón de las células presentadoras de antígenos, la IDO ejerce un efecto regulador, con un mecanismo de retroalimentación que modula la respuesta inmune, manteniendo la homeostasis25.
, IL-4 e IL-23) y el sistema quinurenina. Frente a la activación mediada por interferón de las células presentadoras de antígenos, la IDO ejerce un efecto regulador, con un mecanismo de retroalimentación que modula la respuesta inmune, manteniendo la homeostasis25.
Estrés oxidativo e inmunomodulación
La IDO induce la producción de especies reactivas de oxígeno (ROS) y radicales de óxido nítrico (NO). Gostner y col.26 vieron que las especies reactivas del oxígeno y nitrógeno (ROS-RNS) y otras moléculas activas redox cumplen funciones clave en la inmunidad. Junto a otras estrategias de defensa de agentes patógenos, las reacciones redox activan y modulan la respuesta inmune y juegan un papel activo en el inicio y terminación de los procesos de restauración celular.
Varias vías implicadas en la regulación de respuesta inmunológica se regulan por mecanismos redox. El enzima óxidonítricosintetasa (NOS) induce la generación de óxido nítrico (NO) en varios tipos celulares. Este compuesto, a pesar de su baja reactividad, es un potente antioxidante e inhibe la expresión y función de la IDO27. La inducción de la IDO y NOS en la respuesta inflamatoria mediada por IFN-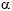 parece estar mutuamente regulada28. La ausencia de NO permite mayor actividad de IDO en el sitio de la inflamación.
parece estar mutuamente regulada28. La ausencia de NO permite mayor actividad de IDO en el sitio de la inflamación.
Los mecanismos de regulación debidos a la activación redox garantizan el correcto desarrollo de los procesos inmunológicos, y el desequilibrio en la homeostasis redox, como puede ocurrir con estados crónicos de anoxia, provocan fallos de los mecanismos de control que favorecen el desarrollo de diversas condiciones patológicas, como hemos observado en recientes estudios clínicos29.
El interferón-gamma es el inductor más potente de la formación de ROS-RNS en las células diana, como los macrófagos. La inmunomodulación que permite la degradación del triptófano a través de la IDO, es iniciada durante la respuesta inmune de tipo celular, concomitante a la producción de ROS-RNS por las células inmunocompetentes. El tratamiento con el antioxidante N-acetil-cisteina (NAC) protege completamente a los linfocitos NK contra la apoptosis inducida por L-quinurenina. Además, Song y col. 19 encontraron que el tratamiento con el inhibidor z-VAD-fmk (pan-caspase z-Val-Ala-Asp (OMe) fluorometilcetona) y ZB4 (un Fas-anticuerpo antagonista), inhibió ligeramente la apoptosis inducida por L-quinurenina, lo que sugiere que dicha apoptosis inducida se produce principalmente a través de una vía mediada por ROS. Por tanto, la quinurenina resultante de la actividad de la IDO puede causar la muerte celular a través de la ruta ROS en linfocitos NK, por procesos de interacción entre linfocitos y células cancerosas, en la modulación de la respuesta inmune.
Es preciso continuar investigando sobre la compleja interacción entre el triptófano, la IDO y las quinureninas entre sí y en las diversas condiciones patológicas. Ya se están explorando la capacidad de la vía quinurenina en el diseño nuevas estrategias de tratamiento.
AGRADECIMIENTOS
A la Gerencia Regional de Salud de la Junta de Castilla y León, por la ayuda nº GRS 389A09 y al Instituto de Salud Carlos III (Ministerio de Sanidad) por la ayuda PI10/00334
REFERENCIAS
1.- Ruddick JP, Evans AK, Nutt DJ, Lightman SL, Rook GA, Lowry CA. Tryptophan metabolism in the central nervous system: medical implications. Expert Rev Mol Med. 2006;8:1-27
2.- Salter M, Pogson CI. The role of tryptophan 2,3-dioxygenase in the hormonal control of tryptophan metabolism in isolated rat liver cells. Effects of glucocorticoids and experimental diabetes. Biochem J. 1985;229:499-504.
3.- Chen Y, Guillemin GJ. Kynurenine pathway metabolites in humans: disease and healthy States. Int J Tryptophan Res. 2009;2:1-19.
4.- Takikawa O. Biochemical and medical aspects of the indoleamine 2,3-dioxygenase-initiated L-tryptophan metabolism. Biochem Biophys Res Commun. 2005;338:12-19.
5.- Ball HJ, Sanchez-Perez A, Weiser S, et al. Characterization of an indoleamine 2,3-dioxygenase-like protein found in humans and mice. Gene. 2007;396:203-213.
6.- Metz R, Duhadaway JB, Kamasani U, Laury-kleintop L, Muller AJ, Prendergast GC. Novel tryptophan catabolic enzyme IDO2 is the preferred biochemical target of the antitumor indoleamine 2,3-dioxygenase inhibitory compound D-1-methyl-tryptophan. Cancer Res. 2007;67:7082-7087.
7.- Werner-Felmayer G, Werner ER, Fuchs D, Hausen A, Reibnegger G, Wachter H. Characteristics of interferon induced tryptophan metabolism in human cells in vitro. Biochim Biophys Acta.1989;1012:140-147.
8.- Werner ER, Bitterlich G, Fuchs D, Hausen A, Reibnegger G, Szabo G, et al. Human macrophages degrade tryptophan upon induction by interferon-gamma. Life Sci. 1987; 41:273-280.
9.- Carlin JM, Borden EC, Sondel PM, Byrne GI. Interferon-induced indoleamine 2,3-dioxygenase activity in human mononuclear phagocytes. J Leukoc Biol.1989; 45:29-34.
10.- Brown RR, Ozaki Y, Datta SP, Borden EC, Sondel PM, Malone DG. Implications of interferon-induced tryptophan catabolism in cancer, auto-immune diseases and AIDS. Adv Exp Med Biol.1991;94:425-35
11.- Cozzi A, Zignego AL, Carpendo R, Biagiotti T, Aldinucci A, Monti M, Giannini C, Rosselli M, Laffi G, Moroni F. Low serum tryptophan levels, reduced macrophage IDO activity and high frequency of psychopathology in HCV patients. J Viral Hepat. 2006;13(6):402-408.
12.- van der Sluijs KF, Nijhuis M, Levels JH, Florquin S, Mellor AL, Jansen HM, van der Poll T, Lutter R. Influenza-induced expression of indoleamine 2,3-dioxygenase enhances interleukin-10 production and bacterial outgrowth during secondary pneumococcal pneumonia. J Infect Dis. 2006;193(2):214-222.
13.- Koenig P, Nagl C, Neurauter G, Schennach H, Brandacher G, Fuchs D. Enhanced degradation of tryptophan in patients on hemodialysis. Clin Nephrol. 2010;74(6):465-470.
14.- Müller N, Schwarz MJ. COX-2 inhibition in schizophrenia and major depression. Curr Pharm Des. 2008;14(14):1452-1465.
15.- Capuron L, Schroecksnadel S, Féart C, Aubert A, Higueret D, Barberger-Gateau P, Layé S, Fuchs D. Chronic low-grade inflammation in elderly persons is associated with altered tryptophan and tyrosine metabolism: role in neuropsychiatric symptoms. Biol Psychiatry. 2011;70(2):175-182.
16.- López AS, Alegre E, Díaz-Lagares A, García-Girón C, Coma MJ, González A. Effect of 3-hydroxyanthranilic acid in the immunosuppressive molecules indoleamine dioxygenase and HLA-G in macrophages. Immunol Lett. 2008;117(1):91-95.
17.- Cavia-Saiz M, Muñiz P, De Santiago R, Herreros-Villanueva M, Garcia-Giron C, Lopez AS, Coma-Del Corral MJ. Changes in the levels of thioredoxin and indoleamine-2,3-dioxygenase activity in plasma of patients with colorectal cancer treated with chemotherapy. Biochem Cell Biol. 2012;90(2):173-178
18.- Palamares T, De Lecea M, Armesto D, Cavia M, Al Kassam D, Alonso-Varona A. Relevance of indoleamine 2, 3-dioxygenase as prognostic biomarker in melanoma patients. In Eur J Cancer. 2013; 49: S863-S863.
19.- Song H, Park H, Kim YS, Kim KD, Lee HK, Cho DH, Yang JW, Hur DY. L-kynurenine-induced apoptosis in human NK cells is mediated by reactive oxygen species. Int Immunopharmacol. 2011;11(8):932-938.
20.- Curti A, Trabanelli S, Salvestrini V, Baccarani M, Lemoli RM. The role of indoleamine 2,3-dioxygenase in the induction of immune tolerance: focus on hematology. Blood 2009; 113:2394-2401.
21.- Munn DH, Zhou M, Attwood JT, Bondarev I, Conway SJ, Marshall B, Brown C, Mellor AL. Prevention of allogeneic fetal rejection by tryptophan catabolism. Science. 1998;281(5380):1191-1193.
22.- Munn DH, Mellor AL. Indoleamine 2,3 dioxygenase and metabolic control of immune responses. Trends Immunol. 2013;34(3):137-143.
23.- Pfefferkorn ER. Interferon gamma blocks the growth of Toxoplasma gondii in human fibroblasts by inducing the host cells to degrade tryptophan. Proc Natl Acad Sci U S A. 1984; 81:908-912.
24.- Taylor MW, Feng GS. Relationship between interferon-gamma, indoleamine 2,3-dioxygenase, and tryptophan catabolism. FASEB J. 1991; 5: 2516-2522.
25.- Mándi Y, Vécsei L. The kynurenine system and immunoregulation. J Neural Transm. 2012;119(2):197-209.
26.- Gostner JM1, Becker K, Fuchs D, Sucher R. Redox regulation of the immune response. Redox Rep. 2013;18(3):88-94.
27.- Thomas SR, Terentis AC, Cai H, Takikawa O, Levina A, Lay PA, Freewan M, Stocker R. Post-translational regulation of human indoleamine 2,3-dioxygenase activity by nitric oxide. J Biol Chem. 2007;282:23778-23787.
28.- Alberati-Giani D, Malherbe P, Ricciardi-Castagnoli P, Köhler C, Denis-Donini S, Cesura AM. Differential regulation of indoleamine 2,3-dioxygenase expression by nitric oxide and inflammatory mediators in IFN-gamma-activated murine macrophages and microglial cells. J Immunol. 1997;159:419-442.
29.- Coma-del-Corral MJ, Muniz P, Terán-Santos J. Indoleamine-2,3-dioxygenase activity in plasma of patients with sleep apnea. Unpublished observations, 2013.
CORRESPONDENCIA:
Dra María Jesús Coma
Unidad de Investigacion
Hospital Universitario de Burgos
Avda. de las Islas Baleares 3
09006 Burgos.
Spain
Mail: mjcoma @ hubu.es
