Indice del volumen Volume index
Comité Editorial Editorial Board
Comité Científico Scientific Committee
MANEJO LOCAL DE UNA FÍSTULA ENTERO-ATMOSFÉRICA EN EL ABDOMEN ABIERTO: CURA EN CHIMENEA PRESENTACIÓN DE CASO
Rocío Zambrano Muñoz, Francisco Javier Sánchez Manuel, Ester Beatriz García-Plata Polo, Jose Felipe Reoyo Pascual, Lucía González Martínez, Romina Parra López, Ivan Gil Laso, Xandra Valero Cerrato, Isabel Sánchez Pedrique, Carlos Cartón Hernández
Servicio de Cirugía General
Hospital Universitario de Burgos. Burgos. España
rzambranom @ saludcastilla yleon.es
Rev Electron Biomed / Electron J Biomed 2015;1:39-43
RESUMEN
INTRODUCCIÓN: El abdomen abierto es tanto un recurso como una secuela quirúrgica que nos ayuda a salvar la vida de pacientes críticos pero que puede tener importantes complicaciones, siendo la más grave, la fístula entero-atmosférica.
CASO CLINICO: Presentamos el caso de un paciente tratado en nuestro centro con abdomen abierto de larga evolución por pancreatitits traumática y con desarrollo de una fístula entero-atmosférica, manejada con cura en chimenea en un sistema de vacío. Con este motivo, se hace una revisión de la literatura al respecto.
RESULTADOS Y CONCLUSIONES: Este tipo de cura se demostró efectiva para el manejo de la fístula hasta la reparación diferida del tránsito. La fístula enteroatmosférica complica en gran medida el manejo de un paciente con abdomen abierto y debe diseñarse una cura capaz de proteger el lecho de la laparostomía del efluente fistuloso. La cura en chimenea representa una buena opción para fístulas distales de íleon, simplificando mucho el manejo del enfermo y permitiendo mantener el abdomen abierto limpio y la fístula aislada hasta la reparación del tránsito, que generalmente se realiza junto con la de la pared abdominal, unos meses después.
PALABRAS CLAVE: Cura de vacío. Laparostomía. Fístula digestiva. Pancreatitits traumática
SUMMARY:
INTRODUCTION: The open abdomen is both a resource and a surgical sequela after damage-control surgery, that helps saving the live of critically ill patients. It can have significant complications, the most severe one is the entero-atmospheric fistula.
CASE REPORT: We report the case of a patient from our hospital, treated with longstanding open abdomen because of a traumatic pancreatitis and development of an enteroatmospheric fistula, handled with a variation of the fistula ring technique: a "fireplace" design in a vacuum system. A review of the literature on the subject is made.
RESULTS AND CONCLUSIONS: This strategy proved effective for the management of the fistula until the final repair of the bowel. The management of an enteroatmospheric fistula is a major technical challenge to prevent the leak of intestinal contents on the surrounding exposed bowel and granulation tissue. The "fireplace" design represents a good option for distal ileum fistulas, greatly simplifying the treatment of the patient by maintaining the open abdomen clean and the fistula effluent isolated until the transit repair, which is usually carried out along with the abdominal wall repair, few months later.
KEY WORDS: Negative-presure therapy. Laparostomy. Digestive fistula. Traumatic pancreatitis
INTRODUCCIÓN
El abdomen abierto es tanto un recurso como una secuela quirúrgica que nos ayuda a salvar la vida de pacientes críticos. Una buena cobertura visceral y un cierre precoz definitivo deben ser el objetivo a perseguir ya que de otra forma comenzaremos a sufrir las consecuencias de la laparostomía crónica, siendo la más grave de ellas, la fístula enteroatmosférica1,2.
Presentamos a continuación el caso de un paciente con abdomen abierto de larga evolución complicado con una fístula enteroatmosférica cuyo manejo local cuidadoso será clave para la buena evolución del caso. Adjuntamos detalles técnicos de nuestro propio aprendizaje en la realización de estas curas, que por su localización, pueden resultar complejas.
CASO CLÍNICO
Varón de 42 años remitido a nuestro centro por mal estado general y hallazgo radiológico de inflamación pancreática tras traumatismo abdominal cerrado tres días antes por accidente de tráfico.
A su llegada a nuestro hospital el paciente se encontraba consciente y orientado con mal estado general. Presentaba TA 120/91 mmHg y taquicardia de 138 lpm, con fiebre de 38°C. La auscultación pulmonar revelaba hipoventilación basal derecha y la palpación abdominal, defensa generalizada con signos de peritonismo que traducían un abdomen agudo. Analíticamente había una leucocitosis (13.2 g/dl), hiperfibrinogenemia (623 ml/dl), creatinina de 1.67 mg/dl, amilasa de 183 U.I./L, PCR 209 mg/l y ácido láctico 1.6 con pH 7.23.
Las pruebas radiológicas que aportaba mostraban un aumento de tamaño de la cabeza del páncreas y proceso uncinado con bordes desflecados sugestivos de pancreatitis, probablemente postraumática, con líquido libre retroperitoneal y aumento de densidad de la grasa peripancreática. Ante estos hallazgos se decidió realizar una intervención quirúrgica urgente.
El abdomen fue abordado mediante laparotomía media supra e infraumbilical, encontrando una pancreatitis aguda necrohemorrágica de la cabeza pancreática con esteatonecrosis generalizada. Se realizaron lavados de la cavidad abdominal, drenaje de colecciones y control de hemorragias.
A las 48 horas, el paciente debió ser reintervenido por presentar un síndrome compartimental abdominal con fallo renal (abdomen tenso, PIA 21 mmHg con oligoanuria progresiva y creatinina 4,5 mg/dl), motivo por el cual se realizó una laparotomía descompresiva dejando el abdomen abierto y colocando una cura de vacío con esponja de poliuretano sobre bolsa de recubrimiento intestinal de polietileno (VAC). Durante su estancia en UCI precisó varias reintervenciones para extensas necrosectomías, colecistectomía por colecistitis gangrenosa y control de hemorragias, quedando, tras todas ellas, grandes cavidades retroperitoneales derechas comunicadas en un abdomen abierto. (Figuras 1, 2 y 3)
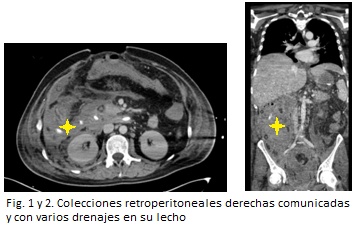
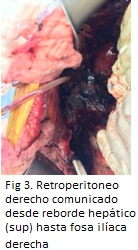
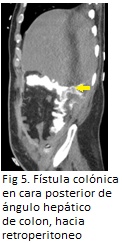
Tras cinco intervenciones quirúrgicas y 33 días en UCI, manteniendo un sistema de lavados continuos retroperitoneales a través de drenajes, se decidió colocar una malla irreabsorbible de recubrimiento intestinal de politetrafluoroetileno expandido 30 x 30 cm anclada al plano aponeurótico y cubierta con cura de vacío. Esta malla permitiría la reparación definitiva del plano aponeurótico y, al mismo tiempo, el crecimiento de tejido de granulación a su través para una posterior cobertura con un injerto cutáneo12. Sin embargo, una semana después encontramos una fístula enteroatmosférica de íleon en el lecho del abdomen abierto y posteriormente otra colónica a retroperitoneo (probablemente causada por la propia pancreatitis necrotizante) que produjo distintos episodios de sepsis que impidieron realizar la cobertura cutánea programada (Figuras 4 y 5).
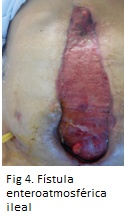
La aparición de la fístula enteroatmosférica ileal nos forzó a adoptar un sistema de curas que garantizase la protección de la herida frente a la irritación producida por el efluente intestinal.
El método consiste en crear una "chimenea" que permita recoger el débito intestinal: se cubre el incipiente tejido de granulación del lecho con gasas parafinadas hasta los alrededores de la fístula e introducimos una pequeña porción de gasa en la boca fistulosa con cuidado de no distenderla y agrandarla pero tapándola para no manchar la cura (en caso de no contar con un ayudante que pueda aspirarnos el efluente).
Sobre la herida se coloca la esponja de poliuretano en la que se hace un orificio amplio que aloje la boca fistulosa con un margen de unos 2 cm. La pared de la chimenea creada en la esponja se recubre internamente con pasta selladora de ostomías para impermeabilizarla. Esta pasta se comercializa en varios formatos. Las barras deben moldearse previamente (con los guantes humedecidos) para darles forma y pegarlas de manera superpuesta hasta sobrepasar la altura de la esponja. La pasta en tubo, debe colocarse cubriendo la pared, sin manipularla ni extenderla con pinzas y dejar secar el tiempo recomendado antes de proseguir la cura. Se debe tener la precaución de que el orificio en la esponja sea lo suficientemente amplio para alojar la fístula y la pasta recubriendo internamente las paredes de la chimenea. Si el orificio es demasiado estrecho, la pasta quedará sobre la fístula o la tapará al aplicar el vacío. Se completa entonces la cura cubriendo todo ello con el apósito adhesivo transparente aplicando una leve presión al mismo sobre los bordes de la chimenea para que el plástico quede bien adherido a la pasta.
En una zona cercana a la localización de la fístula se hace un orificio sobre el apósito adhesivo para la colocación del dispositivo de aspiración y se inicia la misma (la distancia de colocación del dispositivo debe ser lo suficientemente grande para dejar colocar posteriormente la bolsa de ostomía pero lo más cercana posible para aspirar cualquier contenido que pueda escapar de la chimenea). Ahora se debería apreciar que la cura está totalmente cerrada, con el vacío hecho, sin dar salida al efluente de la fístula. Para esto último, se recorta el apósito adhesivo sobre el borde interno de la chimenea (debemos ver que no perdemos el vacío de la cura al estar los bordes del apósito adheridos a la pasta). Una vez hecho esto, se coloca la bolsa de ostomía.
De ésta forma conseguimos mantener la cura de vacío, promotora del crecimiento de tejido de granulación a través de la malla irreabsorbible, al tiempo que recogemos el contenido intestinal de la fístula, protegiendo así la herida (y las asas intestinales) de la irritación química que supone y que favorecería la aparición de nuevas fístulas. Pero debemos recordar que por las características propias de estas fístulas (alto débito, localización periférica en el abdomen abierto, etc) las curas pueden resultar complejas y requieren de entrenamiento y minuciosidad. En nuestro caso, las primeras curas apenas duraron horas mientras que tras los cuatro meses de proceso la última cura colocada se mantuvo durante una semana completa (Figura 6).

Figura 6.- Confección de la cura en chimenea:
6a- Limpieza del lecho. 6b- Cobertura con gasas parafinadas.
6c- Colocación de esponja perforada y aislamiento de la pared con pasta para ostomías. 6d- Colocación de adhesivo.
6e- Colocación de dispositivo de aspiración, creación de vacío y apertura de la salida de la chimenea.
6f- Bolsa de ostomía sobre la chimenea.
DISCUSIÓN
El "abdomen abierto" consiste en mantener una herida de laparotomía abierta. Esto, como publicaron Diaz et al3 en el último documento de consenso sobre el manejo del abdomen abierto en 2010, está indicado en ciertas situaciones como el Síndrome Compartimental Abdominal (PIA >20 mmHg asociada a disfunción orgánica. Grado I), la Cirugía de Control de Daños (packing de vísceras sólidas, ligadura de estructuras vasculares sangrantes, control de la contaminación intestinal. Grado II), algunas cirugías urgentes (peritonitis severa, grado II. Pancreatitis necrotizante severa, grado III) y en algunas cirugías vasculares (reparaciones de aneurismas de aorta abdominal con edema intestinal que condiciones un SCA en al cierre, grado II. PIA > 21 mmHg en postoperatorio de AAA, grado III).
El abdomen abierto obliga a garantizar una buena cobertura visceral que evite sus complicaciones lógicas (pérdida de líquidos y proteínas, infecciones, problemas nutricionales y lesiones mecánicas de las vísceras) y para ello contamos con un gran arsenal de cierres temporales, desde la tradicional bolsa de Bogotá hasta los más avanzados sistemas de vacío, pasando por las mallas, el velcro de Wittman o los cierres "zipper"13.
El otro gran reto que plantea el abdomen abierto es un cierre primario definitivo lo más precoz posible (antes de 5-7 días)1 para evitar, además de las complicaciones ya mencionadas, que aparezcan las temidas fístulas enteroatmosféricas o que las paredes se tornen rígidas con pérdida del derecho a domicilio del contenido intestinal y formación de hernias ventrales posteriores.
La fístula enteroatmosférica (FEA) es la más temida complicación del abdomen abierto. Se trata de una solución de continuidad en la pared intestinal, que al no contar con tejidos blandos que la recubran, comunica la luz intestinal con la atmósfera sin tener un trayecto fistuloso real4. Se presenta en el 25% de los pacientes con abdomen abierto y tiene una mortalidad del 42%5. Su aparición está relacionada con la exposición prolongada de las asas intestinales (>5-7 días)3, las líneas de sutura anastomótica intestinal expuestas, la manipulación de la pared intestinal edematosa en los cambios de curas, la persistencia de abscesos y sepsis abdominal y el uso de mallas irreabsorbibles de polipropileno para el cierre aponeurótico6.
El vertido de contenido intestinal por estas fístulas produce una continua irritación química de otras asas intestinales con la formación de nuevas fístulas, la contaminación del abdomen y la persistencia de sepsis; trastornos hidroelectrolíticos y complica además la pauta de nutrición. La literatura describe hasta un 30% de cierres espontáneos de las FEA en circunstancias favorecedoras4 pero el resto requerirán un cuidadoso manejo hasta la reparación definitiva del tránsito, que generalmente se lleva a cabo conjuntamente con la reparación de la pared abdominal meses después.
El manejo de la fístula debe ser tanto general como local. Debemos procurar un buen estado nutricional del paciente personalizando nutriciones que sean además de absorción alta para disminuir el débito fistuloso, pudiendo tratar de enlentecer el tránsito para su absorción proximal con mórficos, octreótido, codeína, etc. Erradicar la infección será clave y para ayudar a ello, y evitar la irritación química del lecho, debemos lograr un buen control del efluente intestinal, aislándolo del abdomen abierto4 . Para esto, a lo largo de los años se han propuesto diversas estrategias. El cierre primario de las fístulas mediante sutura de sus bordes se demostró infructuoso, y los intentos de canalización con sondas Foley o similares se tratan de evitar por el agrandamiento de las bocas fistulosas. Girad S et al. propusieron el cierre con matriz humana acelular o injertos cutáneos de cadáver, en ocasiones apoyados con pegamento biológico8 pero la tasa de cierre de las fístulas fue muy baja. Recientemente, Wang y su grupo7 publicaron el control de la fístula mediante un fino parche flexible de "silica gel lamellar" que sella la fístula intraluminalmente en una corta serie de 11 pacientes, reportando buenos resultados pero sin gran repercusión en la sociedad médica.
En 2002, Subramaniam et al. propusieron la idea del "estoma flotante" consistente en la protección del lecho con unas bolsas de recubrimiento intestinal fijadas desde los alrededores de la fístula hasta los bordes externos de la herida y sobre ellas, una de ostomía que recogía el débito fistuloso9. Esta idea se perfeccionó añadiendo el beneficio de las curas de vacío para mantener el lecho limpio y favorecer su granulación. Para ello, en fístulas proximales con débito líquido, la técnica de la tetina de biberón cubre el lecho con gasas parafinadas y coloca, sobre la fístula, una tetina de biberón de silicona suave que reposa sobre una barra de pasta para ostomía. La punta de la tetina se reseca para ampliar su orificio y se inserta en él una sonda Foley con el globo ligeramente inflado para mantener la sonda anclada en la parte superior de la tetina evitando que entre en contacto con la mucosa de la fístula. El lecho se cubre con una cura de vacío convencional recortando en la esponja de poliuretano y la hoja adhesiva superior, un orificio que permita exteriorizar la tetina a su través para poder hacer el vacío aislando el drenaje de la fístula10. En fístulas más distales, con contenido más espeso, este sistema se colapsaba, así que con el mismo principio, Verhaalen y su grupo diseñaron la técnica que hemos empleado en nuestro caso y que se ha descrito anteriormente. Ésta técnica crea, en el seno de la cura de vacío, una chimenea que nos permite aislar y recoger el débito intestinal como si se tratase de una ostomía convencional11, simplificando en gran medida el manejo del enfermo hasta la reparación del tránsito conjuntamente con la de la pared abdominal que generalmente se programan unos meses más tarde.
REFERENCIAS
-
1.- Demetriades D, Salim A. Management of the open abdomen. Surg Clin North Am. 2014;94:131-153.
2.- Burlew CC. The open abdomen: practical implications for the practicing surgeon. Am J Surg. 2012;204:826-835.
3.- Diaz JJ Jr, Cullinane DC, Dutton WD, Jerome R, Bagdonas R, Bilaniuk JW, Collier BR, Como JJ, Cumming J, Griffen M, Gunter OL, Kirby J, Lottenburg L, Mowery N, Riordan WP Jr, Martin N, Platz J, Stassen N, Winston ES. The management of the open abdomen in trauma and emergency general surgery: part 1-damage control. J Trauma. 2010;68:1425-1438.
4.- Terzi C, Egeli T, Canda AE, Arslan NC. Management of enteroatmospheric fistulae. Int Wound J 2014; 11 (suppl. 1):17-21.
5.- D'Hondt M, Devriendt D, Van Rooy F, Vansteenkiste F, D'Hoore, A, Penninckx F, Miserez M. Treatment of small-bowel fistulae in the open abdomen with topical negative-pressure therapy. Am J Surg 2011;202:e20-24.
6.- Diaz JJ Jr, Dutton WD, Ott MM, Cullinane DC, Alouidor R, Armen SB, Bilanuik JW, Collier BR, Gunter OL, Jawa R, Jerome R, Kerwin AJ, Kirby JP, Lambert AL, Riordan WP, Wohltmann CD. Eastern Association for the Surgery of Trauma: a review of the management of the open abdomen--part 2 "Management of the open abdomen". J Trauma. 2011;71:502-512.
7.- Wang G, Ren J, Liu S, Wu X, Gu G, Li J. "Fistula patch": making the treatment of enteroatmospheric fistulae in the open abdomen easier. J Trauma Care Surg 2013; 74: 1175-1177
8.- Girard S, Sideman M, Spain DA. A novel approach to the problem of intestinal fistulization arising in patients managed with open peritoneal cavities. Am J Surg 2002;184:166-7
9.- Subramaniam MH, Liscum KR, Hirshberg A. The floating stoma: a new technique for controlling exposed fistulae in abdominal trauma. J Trauma 2002;53:386-8
10.- Layton B, Dubose J, Nichols S, Connaughton J, Jones T, Pratt J. Pacifying the open abdomen with concomitant intestinal fistula: a novel approach. Am J Surg 2010;199:e48-50
11.- Verhaalen A, Watkins B, Brasel K. Techniques and cost effectiveness of enteroatmospheric fistula isolation. Wounds 2010;22:212-7
12.- Cheesborough JE, Park E, Souza JM, Dumanian GA. Staged management of the open abdomen and enteroatmospheric fistulae using split-thickness skin grafts. Am J Surg. 2014 Apr;207(4):504-11.
13.- Quyn AJ, Johnston C, Hall D, Chambers A, Arapova N, Ogston S, Amin AI. The open abdomen and temporary abdominal closure systems--historical evolution and systematic review. Colorectal Dis. 2012 Aug;14(8):e429-38.
CORRESPONDENCIA:
Dra. Rocío Zambrano Muñoz
Servicio de Cirugía General
Hospital Universitario de Burgos. Burgos. España
rzambranom @ saludcastillayleon.es
Recibido, 22 de marzo de 2015.
Publicado, 20 de abril de 2015
