Indice del volumen Volume index
Comité Editorial Editorial Board
Comité Científico Scientific Committee
LESIONES ESTROMALES Y TROFOBLÁSTICAS EN VELLOSIDADES PLACENTARIAS DE GESTANTES CON SÍNDROME ANTIFOSFOLÍPIDO EN TERAPIA ANTITROMBÓTICA.
Ángela López G1, Bartolino Pante2, Leonardo Pereira3, Arlyn Páez3, Oriana Tovar3,
Maruvic Ramírez3, Luis Pérez-Ybarra4.
Departamentos de 1Ciencias Morfofisiológicas y 4Ciencias Básicas, Escuela de Bioanálisis,
2Gineco-obstetricia y 3Medicina y Cirugía, Escuela de Medicina,
Facultad de Ciencias de la Salud, Universidad de Carabobo Sede Aragua.
Laboratorio de Microscopía Electrónica del Centro de Investigación y
Análisis Docente Asistencial del Núcleo Aragua (CIADANA).
Maracay-Edo Aragua, Venezuela.
anjoslo75 @ hotmail.com
Rev Electron Biomed / Electron J Biomed 2016;2:11-22
Comentario del revisor Prof. Sandro Bustamante, M.Sc. Programa de Farmacología Molecular y Clínica. ICBM, Facultad de Medicina. Universidad de Chile. Santiago. Chile.
Comentario de la revisora Dra. María Jesús Coma. Especilista en Histopatología. Unidad de Investigación. Hospital Universitario de Burgos. España
RESUMEN
Objetivo: Describir y cuantificar lesiones estromales y trofoblásticas en vellosidades placentarias de gestantes con síndrome antifosfolípido en terapia antitrombótica
Materiales y Métodos: Estudio descriptivo, de corte transversal en el cual se analizaron dos placentas a término de gestantes con síndrome antifosfolípido y en terapia combinada. Para el control se analizó una placenta a término de gestante sana. Regiones centrales y periféricas de cada placenta fueron procesadas con la técnica de hematoxilina-eosina, evaluándose al microscopio óptico 5 variables cuantitativas las cuales fueron analizadas mediante el ANOVA y la prueba de Tukey.
Resultados: Se observó madurez placentaria. Se encontraron diferencias significativas (p < 0.05) entre la placenta control y patológicas en relación a la deposición de sustancia fibrinoide, edema, fibrosis y nódulos sincitiales, evidenciándose una mayor proporción de vellosidades afectadas en las placentas asociadas a síndrome antifosfolípido.
En conclusión: Las placentas de gestantes con síndrome antifosfolípido tratadas muestran un porcentaje mayor de vellosidades con lesiones estromales y trofoblásticas, siendo el edema una de las más significativas. Finalmente inferimos que la terapia antitrombótica tuvo un efecto beneficioso en estas pacientes logrando culminar con éxito el embarazo.
PALABRAS CLAVE: Placenta, Anticuerpos antifosfolípidos, Antitrombóticos.
SUMMARY: STROMAL AND TROPHOBLASTIC LESIONS IN PLACENTAL VILLI OF PREGNANT WITH ANTIPHOSPHOLIPID SYNDROME IN ANTITHROMBOTIC THERAPY.
Objective: Describe and quantify stromal and trophoblastic lesions in placental villi of pregnant with antiphospholipid syndrome in antithrombotic therapy.
Materials and Methods: cross-sectional descriptive study in which two placentas of pregnant women at term associated with antiphospholipid syndrome in therapy combined were analyzed. To control a placenta at term of healthy pregnant women was analyzed. Central and peripheral regions of each placenta were processed with hematoxylin-eosin, evaluating at the optical microscope 5 quantitative variables which were analyzed by ANOVA and Tukey test.
Results: placental maturity was observed. Significant differences (p < 0.05) were found between the control and pathological placenta in relation to the deposition of fibrinoid material, edema, fibrosis and syncytial nodules, showing a higher proportion of placenta villi affected in the placenta associated with antiphospholipid syndrome.
In conclusion: Placentas of pregnant women with antiphospholipid syndrome treated show a higher percentage of villous stromal and trofoblastic lesions, being the edema one of the most significant. Finally we infer that antithrombotic therapy had beneficial effect in these patients achieving successful completion of pregnancy.
KEY WORDS: Placenta, Antiphospholipid antibodies, Antithrombotic.
INTRODUCCIÓN
El síndrome antifosfolípido (SAF) es un tipo de trombofilia adquirida que afecta principalmente a las mujeres jóvenes, caracterizado por trombosis venosa o arterial, abortos de repetición y la presencia persistente de anticuerpos antifosfolípidos (AFL) especialmente: anticuerpos anticardiolipina, anticoagulante lúpico y anticuerpos  2 glicoproteína I1,2.
2 glicoproteína I1,2.
Con respecto a los AFL, algunas investigaciones3-5 han demostrado que estos juegan un papel patogénico en los fracasos reproductivos. Estudios in vitro han propuesto varias teorías, siendo algunas de ellas: la destrucción o muerte del trofoblasto6-7, la inhibición en la secreción de gonadotrofina coriónica8 y la expresión anormal de moléculas de adhesión9, lo cual afecta el proceso de invasión trofoblástica y el desarrollo de una placenta normal. Así mismo, se ha indicado que los AFL inducen la reducción de los valores de Anexina V, provocando trombosis en los vasos uteroplacentarios10-11.
Debido a que las mujeres con SAF tienen un elevado riesgo de presentar trombosis durante la gestación, se han ensayado diferentes esquemas de tratamiento, siendo uno de los que ofrece mejores resultados, la administración combinada de ácido acetilsalicílico y heparina de bajo peso molecular12-13. Aunque estos fármacos pueden aumentar las tasas de embarazos exitosos, los estudios señalan que estos no pueden prevenir la presencia de alteraciones histopatológicas en la placenta, reportándose en estos casos: coagulación perivellosa excesiva, vellosidad terminal avascular, villitis crónica, infartos y fibrosis14-16.
Si bien, en estos análisis placentarios de gestantes con SAF tratadas se han evidenciado lesiones vasculares e inflamatorias, en los mismos se ha prestado poca atención a otros cambios vellositarios como el edema; lesión placentaria que puede interferir con el transporte de nutrientes y oxígeno, afectando en algunos casos el desarrollo fetal17, 18. Por tal motivo, este estudio se planteó describir y cuantificar lesiones estromales y trofoblásticas en vellosidades placentarias de gestantes a término con SAF y tratamiento antitrombótico, permitiendo una mayor comprensión acerca de cómo se afecta la placenta en este tipo de patologías.
MATERIALES Y MÉTODOS
Investigación descriptiva y de corte transversal. El grupo de estudio abarcó las vellosidades placentarias obtenidas de dos (02) gestantes a término con diagnóstico clínico y serológico de SAF primario19 y tratadas con terapia antitrombótica combinada: ácido acetilsalicílico y heparina de bajo peso molecular según protocolo20. Ambas pacientes fueron evaluadas en la consulta de Prenatal Patológico del Hospital Central de Maracay (HCM). Para el control se analizó una (01) placenta obtenida de una paciente con embarazo a término, sin ninguna patología. A las gestantes se les dio a conocer el consentimiento informado y la aprobación del comité de ética de la institución hospitalaria para la realización de la investigación según la declaración de Helsinki. Una vez culminada la cesárea, se tomaron y evaluaron las placentas. Los pesos de las placentas oscilaron entre 470 y 500 grs. Los pesos de los recién nacidos entre 2750 y 3200 grs. Seguidamente se realizaron en el tejido cortes tipo biopsias: en la región periférica y central, abarcando las dos placas coriónica y basal.
Las piezas obtenidas fueron fijadas en formol al 10% para luego ser procesadas por la técnica de Hematoxilina-Eosina. Las láminas obtenidas (aproximadamente 22 por cada placenta) fueron observadas y fotografiadas usando un microscopio digital compuesto OMAX-MD82ES10.
Las variables analizadas en el estroma velloso fueron: la inmadurez, los cambios fibrinoides, el edema y la fibrosis. Como variable trofoblástica se consideró a los nódulos sincitiales. Para el diagnóstico de cada lesión se siguieron los criterios morfológicos señalados por Benirschke y Kaufmann21. Se analizaron 100 vellosidades por cada variable. Con el objetivo de 10X se visualizó: la fibrosis estromal y con el objetivo de 40X: la inmadurez, los cambios fibrinoides, el edema velloso y los nódulos sincitiales. Los datos o porcentajes se registraron en un protocolo y fueron analizados mediante el análisis de varianza [ANOVA] según un arreglo de tratamiento factorial de 2×2 bajo un diseño de parcelas divididas, siendo el primer factor o parcela principal la condición de las placentas y el segundo factor o parcela secundaria, las dos (2) regiones: región central y región periférica. Se extrajeron un número variable de láminas, las cuales representaron las réplicas del estudio. Para verificar si existían diferencias se utilizó la prueba de la diferencia honestamente significativa de Tukey. Se trabajó con un nivel de significancia del 5% y los valores de p < 0,05 fueron considerados estadísticamente significativos. Los datos se procesaron utilizando los programas estadísticos SAS® 9.2 para Windows®.
RESULTADOS
Inmadurez vellosa
Vellosidades intermedias inmaduras
Con respecto a esta variable, se encontraron diferencias significativas entre las placentas asociadas a SAF y la placenta control (p<0,0001), pero no entre las regiones analizadas (p=0,166). En la tabla 1 se observa que las placentas de pacientes con SAF tratadas mostraron un mayor porcentaje de vellosidades intermedias inmaduras en comparación a la placenta control.
Vellosidades troncales
El ANOVA demostró que no existen diferencias significativas entre las placentas asociadas a SAF y la placenta control (p=0,5345), ni para las regiones en estudio (p=0,4397), lo cual indica que el comportamiento de esta variable fue homogéneo para todas las placentas analizadas (Tabla 1).
Vellosidades intermedias maduras
Se observaron diferencias significativas entre las placentas asociadas a SAF y la placenta control (p=0,0001), así como entre las regiones analizadas (p=0,0398). En la tabla 1 se muestra que las placentas patológicas presentaron un porcentaje mayor de vellosidades intermedias maduras que la placenta control. Cabe señalar además, que estos altos porcentajes de vellosidades intermedias maduras (36.05%) se encontraron en las porciones centrales de las placentas en estudio (valores no mostrados).
Vellosidades terminales
El ANOVA mostró que existen diferencias significativas entre las placentas asociadas a SAF y la placenta control (p=0,0001), pero no entre la regiones analizadas (p=0,1400). En la tabla 1 se observa que la placenta control presenta una mayor proporción de vellosidades terminales que las placentas patológicas.
Sustancia Fibrinoide
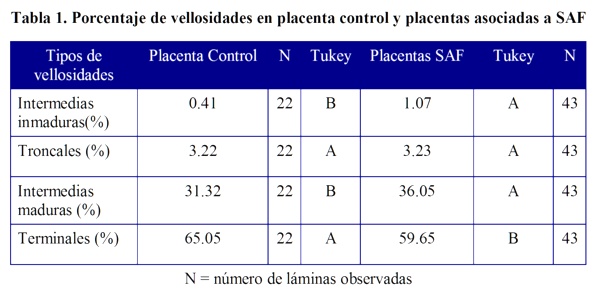
Con respecto a la deposición de sustancia fibrinoide, se encontraron diferencias significativas entre las placentas asociadas a SAF y la placenta control (p=0,0024), pero no entre la regiones en estudio (p=0,2560). En la tabla 2 se observa que las placentas patológicas mostraron un porcentaje mayor de vellosidades afectadas con sustancia fibrinoide (Figura 1) que la placenta control.
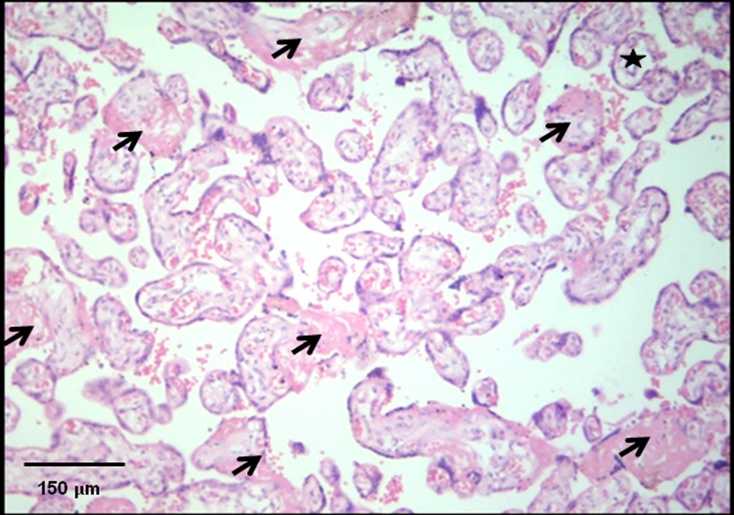
Figura 1. Vellosidades con deposición de sustancia fibrinoide en placentas de pacientes con SAF tratadas (flechas).
En la parte superior derecha una vellosidad edematizada (estrella). H-E 10X.
Edema
El ANOVA demostró que existen diferencias significativas entre las placentas asociadas a SAF y la placenta control (p<0,0001), así como entre las regiones analizadas (p=0,0448). En la tabla 2 se muestra que las placentas patológicas presentaron un porcentaje mayor de vellosidades edematizadas (Figura 2) en comparación a la placenta control. Es importante mencionar, que la mayor proporción de estas vellosidades afectadas (8.3%) se concentraron en las regiones centrales de la placenta (datos no mostrados).
Figura 2. Vellosidades con signos de edema en placentas de pacientes con SAF tratadas (flechas).
Nótese además la degeneración del trofoblasto velloso (flecha curva) y la congestión vascular (estrella). H-E 10X.
Fibrosis
Con respecto a esta variable, existen diferencias significativas entre las placentas asociadas a SAF y la placenta control (p<0,0001), así como entre las regiones consideradas (p=0,0004). En la tabla 2 se evidencia que las placentas patológicas presentaron un porcentaje mayor de fibrosis (Fig. 3) que la placenta control. Por otra parte, se observó que los cortes histológicos tomados de la región periférica (datos no mostrados) mostraron mayor porcentaje de fibrosis (1.3%) que los tomados de la región central (1.1%).
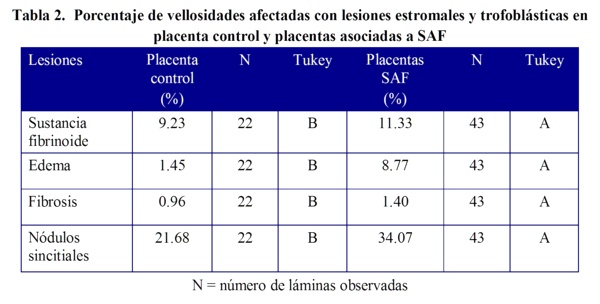
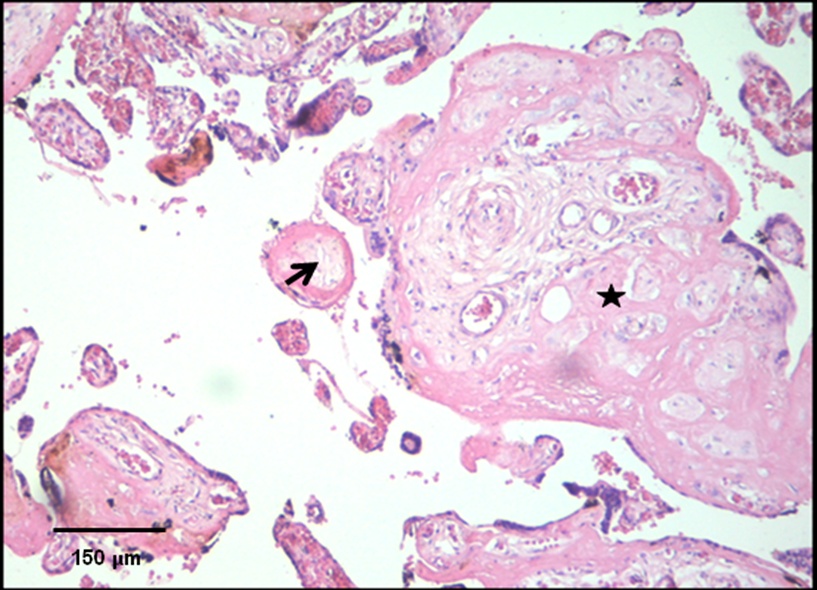
Figura 3. Vellosidad fibrótica en una placenta de gestante con SAF tratada (flecha).
Se muestra además un infarto placentario (estrella). H-E 10X.
Nódulos sincitiales
El ANOVA mostró que existen diferencias significativas entre las placentas asociadas a SAF y la placenta control (p<0,0001), pero no entre las regiones (p=0,7756). En la tabla 2 se observa que las placentas patológicas mostraron un porcentaje mayor de vellosidades afectadas con nódulos sincitiales (Fig. 4) que la placenta control.
Además de los nódulos sincitiales antes descrito, otras lesiones observadas (más no cuantificadas) en algunas vellosidades asociadas a SAF, fue la degeneración del trofoblasto y la congestión vascular (Fig. 2). Así mismo, en el espacio intervelloso de estas placentas se evidenciaron numerosos infartos (Fig. 3) dispersos en la totalidad de la lámina.
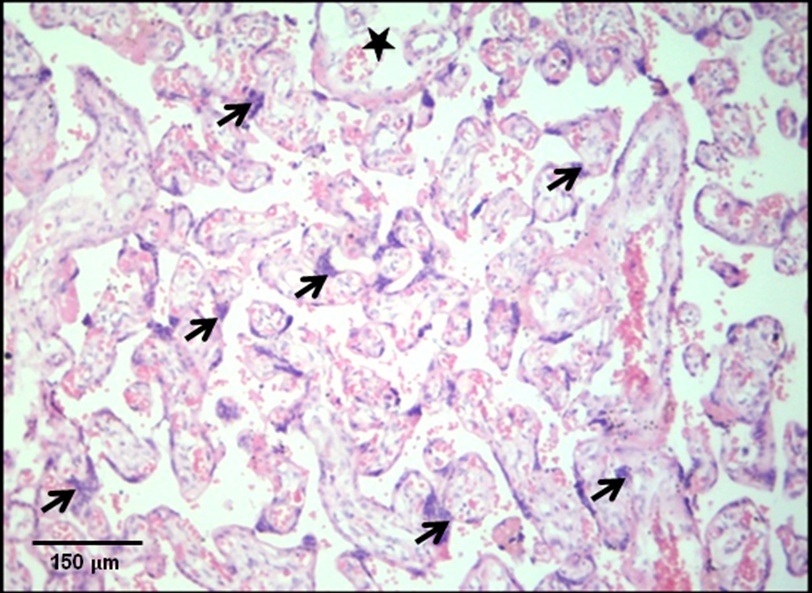
Figura 4. Vellosidades placentarias con nódulos sincitiales (flechas) en gestante con SAF tratada.
En la parte superior una vellosidad con signos de edema (estrella). H-E 10X.
DISCUSIÓN
La arquitectura del árbol velloso cambia drásticamente durante la gestación. En las primeras semanas de desarrollo, la placenta consiste en vellosidades mesenquimáticas, tiempo después se forman las vellosidades troncales, las vellosidades intermedias inmaduras y maduras, para finalmente dar origen a vellosidades terminales con abundantes membranas vasculosincitiales, necesarias para el intercambio de nutrientes y gases entre la madre y el feto. Este proceso de maduración placentaria es un prerrequisito para el desarrollo y crecimiento fetal, es por ello que la primera variable en ser analizada fue la inmadurez, la cual se determina por la prevalencia de vellosidades intermedias inmaduras (>5%).
Al respecto, el análisis estadístico mostró diferencias significativas en tres de los cuatro tipos de vellosidades coriales, evidenciándose en las placentas de gestantes con SAF tratadas, una mayor proporción de vellosidades intermedias inmaduras y maduras, así como un menor porcentaje de vellosidades terminales, en comparación al control. Sin embargo, el porcentaje de vellosidades intermedias inmaduras observado en las placentas patológicas no superaron el 5% (límite de normalidad). De igual manera, el resto de los porcentajes obtenidos se ubicaron dentro de los rangos establecidos22,23. Estos resultados indican madurez placentaria de acuerdo a la edad gestacional, tanto en la placenta control como en las asociadas a SAF, lo cual coincide con lo señalado en otros estudios24,25 en los cuales se reporta predominio de vellosidades terminales y desarrollo placentario adecuado en gestantes con SAF bajo terapia antitrombótica.
En contraste, Vora y col.26 han reportado insuficiencia placentaria, calcificaciones y fibrosis vellosa, en gestantes con trombofilias no tratadas. Además, se describe que en estos casos, el porcentaje de embarazos exitosos es bajo ubicándose entre 10 y 20%27. En nuestro estudio, creemos que la terapia antitrombótica pudo brindar un efecto beneficioso contribuyendo a la maduración de la placenta, y a la obtención de recién nacidos vivos. Sin embargo, cabe señalar que estos tratamientos son empíricos y muchas veces controversiales, puesto que no se conocen con precisión los mecanismos de acción en la placenta28. De manera, que la terapia farmacológica debe ser individualizada según las características epidemiológicas y clínicas de cada gestante29,30.
La sustancia fibrinoide es un componente no fibroso y relativamente homogéneo, que puede ser considerado un producto de secreción del citotrofoblasto o bien un derivado del plasma materno23. En la placenta normal a término es común observar pequeños depósitos de fibrinoide o fibrina perivellosa, como consecuencia de áreas de turbulencia del flujo sanguíneo intervelloso31,32. Sin embargo, una deposición excesiva puede estar asociado a una hipo-perfusión placentaria o ser consecuencia de una reacción inmunológica21,33.
La deposición masiva de fibrina perivellosa (DMFPV) a nivel de la placa basal, es una entidad que ha sido descrita en placentas de gestantes con SAF tratadas, en estos casos, las vellosidades coriales se encuentran sepultadas en dicha sustancia y el espacio intervelloso se oblitera impidiendo el intercambio de gases y nutrientes, asociándose a muerte fetal, restricción del crecimiento intrauterino y parto pretérmino16,25,34,35. Esta DMFPV está relacionada con las alteraciones en el flujo sanguíneo, el daño del trofoblasto provocado por la unión de los anticuerpos circulantes, y la reducción en la expresión de la proteína anticoagulante placentaria anexina V10,25.
En este trabajo, el incremento de esta lesión fue leve, no evidenciándose zonas con deposición masiva de fibrina o fibrinoide perivelloso. Este incremento de vellosidades afectadas (11,33%) en las placentas asociadas a SAF, puede deberse a una reacción inmune que no fue extensiva a todo el trofoblasto velloso, así como a una leve hipoxia provocada posiblemente por la congestión vascular y los infartos aquí observados. Ambos eventos conllevan a la degeneración del trofoblasto, con la subsecuente deposición de sustancia fibrinoide, no sólo en la periferia de la vellosidad, sino además en el estroma de la misma.
Una de las lesiones que obtuvo mayor presencia en las placentas asociadas a SAF, fue el edema, afectando aproximadamente a un 8% de las vellosidades coriales. Si bien, la fisiopatología del edema no está totalmente aclarada36,37, una de las teorías señala que la degeneración o necrosis del sincitio puede conducir a depósitos de fibrina, estos coágulos o tapones formados permiten el paso de macromoléculas y agua desde el espacio intervelloso hacia el estroma21. Esta acumulación de fluido puede en el transcurso del tiempo ejercer presión sobre los capilares sanguíneos y colapsarlos, lo cual interfiere con la llegada de nutrientes y gases al feto38.
En base a este mecanismo, inferimos que los altos porcentajes de edema acá mostrados pueden estar asociados a la degeneración del trofoblasto, ya que se ha postulado que los AFL pueden afectar a estas células, provocando inflamación39 y muerte6,40, además de producir daño directo sobre el endotelio vascular conduciendo a la disolución de las uniones o a la formación anormal de éstas41. Así mismo, se ha señalado a la vasculitis útero-placentaria14 como una de las entidades más frecuentes en las gestantes con SAF tratadas, este proceso inflamatorio ocasionaría la disrupción del endotelio vascular y el subsecuente edema.
El edema velloso placentario ha sido correlacionado con la muerte fetal17 y en los casos en que el feto sobrevive, con daños neurológicos y motores en la infancia42-45. Es por ello, que la detección y cuantificación del edema merece especial atención. Ante la presencia de hipoxia antenatal, placentomegalia, corioamnionitis y un alto porcentaje de vellosidades edematizadas, se debe considerar el seguimiento del recién nacido y del infante durante los primeros años de vida, con la participación de un equipo multidisciplinario44,45.
En cuanto al porcentaje de vellosidades con fibrosis, se encontró una mayor cuantía de vellosidades terminales afectadas en placentas asociadas a SAF que en la placenta control. No obstante, las diferencias son mínimas y no superan los valores establecidos31. Resultados similares han sido expuestos por Hasbun y col46. Sin embargo, en otros estudios15,25 se han reportado numerosas vellosidades fibróticas que en algunos casos estaban sepultadas en masiva sustancia fibrinoide, constituyendo verdaderos infartos placentarios, asociándose esto a condiciones de hipoxia grave y muerte fetal. En nuestro caso, los bajos porcentajes expuestos solo hacen referencia a las vellosidades terminales afectadas en forma aislada, sin considerar aquellas incluidas en los infartos.
Los nódulos sincitiales son especializaciones del sincitiotrofoblasto, caracterizados por una acumulación de núcleos con cambios apoptóticos. Al respecto, en las placentas de gestantes con SAF tratadas se evidenció una mayor proporción de vellosidades con nódulos sincitiales (34.07%) en comparación al control (21.68%). Este hallazgo coincide con lo reportado en otros estudios15,25,47,48 en los que además se señala que el incremento de esta lesión indica hipo-perfusión placentaria, vinculada a la trombosis vascular vellosa observada en gestantes con SAF tratadas y no tratadas. En la presente investigación, no evidenciamos trombosis vascular, pero sí otras lesiones como la congestión y los infartos, las cuales pueden contribuir a establecer un ambiente con bajas tensiones de oxígeno, ocasionando un incremento de vellosidades afectadas con nódulos sincitiales.
En conclusión, ante la evidencia de los resultados aquí expuestos, en las placentas de gestantes a término con SAF tratadas se pudo observar un mayor porcentaje de vellosidades afectadas con deposición de sustancia fibrinoide, fibrosis y nódulos sincitiales, siendo el edema la más significativa. Además se encontró un patrón de maduración vellosa acorde a la edad gestacional. Inferimos que si bien la terapia antitrombótica combinada no logra impedir la aparición de estas lesiones en la placenta, puede reducir su porcentaje e intensidad, lo cual contribuye a la culminación exitosa del embarazo permitiendo la obtención de recién nacidos vivos como se muestra en este estudio.
AGRADECIMIENTOS
Al personal médico y administrativo que labora en el servicio de prenatal patológico del HCM, al Histo-tecnólogo Otoniel Sandoval por el procesamiento de los tejidos placentarios y a la Coordinación administrativa de la Universidad de Carabobo- Sede Aragua por el fondo institucional de funcionamiento al CIADANA.
REFERENCIAS
1. Meschengieser S, Sánchez-Lucero A. Síndrome antifosfolípido obstétrico. Rev SAEGRE. 2011; 18(3):20-29.
2. Simcox LE, Ormesher L, Tower C, Greer IA. Thrombophilia and pregnancy complications. Int J Mol Sci. 2015; 16(12): 28418-28428.
3. Chauleur C, Galanaud JP, Alonso S, Cochery-Nouvellon E, Balducchi JP, Marès P, Fabbro-Peray P, Gris JC. Observational study of pregnant women with a previous spontaneous abortion before the 10th gestation week with and without antiphospholipid antibodies. J Thromb Haemost 2010; 8(4):699-706.
4. Sauer R, Roussev R, Jeyendran RS, Coulam CB. Prevalence of antiphospholipid antibodies among women experiencing unexplained infertility and recurrent implantation failure. Fertil Steril. 2010; 93(7):2441-2443.
5. Skrzypczak J, Rajewski M, Wirstlein P, Gozdziewicz T, Zimmer M, Wolczynski S, Leszczynska-Gorzelak B, Breborowicz G, Ludwikowski G. Frequency of antiphospholipid syndrome in women with pregnancy loss in multicenter study in Poland. Ginekol Pol. 2011; 82(10):749-754.
6. Viall CA, Chen Q, Liu B, Hickey A, Snowise S, Salmon JE, Stone PR, Chamley LW. Antiphospholipid antibodies internalised by human syncytiotrophoblast cause aberrant cell death and the release of necrotic trophoblast debris. J Autoimmun. 2013; 47:45-57.
7. Pantham P, Heazell AE, Mullard G, Begley P, Chen Q, Brown M, Dunn WB, Chamley LW. Antiphospholipid antibodies alter Cell-Death-Regulating Lipid Metabolites in First and Third Trimester Human Placentae. Am J Reprod Immunol. 2015; 74(2):181-199.
8. Schwartz N, Shoenfeld Y, Barzilai O, Cervera R, Font J, Blank M, Yacobi S, Patlas N, Cohen A, Mevorach D, Ornoy A. Reduced placental growth and hCG secretion in vitro induced by antiphospholipid antibodies but not by anti-Ro or anti-La: studies on sera from women with SLE/PAPS. Lupus. 2007; 16(2):110-120.
9. Di Simone N, Castellani R, Caliandro D, Caruso A. Antiphospholipid antibodies regulate the expression of trophoblast cell adhesion molecules. Fertil Steril. 2002; 77 (4):805-811.
10. Rand JH, Wu XX, Andree HA, Lockwood CJ, Guller S, Scher J, Harpel PC. Pregnancy loss in the antiphospholipid-antibody syndrome- A possible thrombogenic mechanism. N Engl J Med. 1997; 337(3):154-160.
11. Rand JH, Wu XX, Quinn AS, Taatjes DJ. The annexin A5-mediated pathogenic mechanism in the antiphospholipid syndrome: role in pregnancy losses and thrombosis. Lupus. 2010; 19(4):460-469.
12. Glasnovic M, Bosnjak I, Vcev A, Soldo I, Kosuta M, Lenz B, Glasnovic-Horvatic E, Soldo-Butkovic S, Micunovic N. Antibody profile of pregnant women with antiphospholipid syndrome and pregnancy outcome after treatment with low dose aspirin and low-weight-molecular heparin. Coll Antropol. 2007;31(1):173-177.
13. Serrano F, Nogueira I, Borges A, Branco J. Primary antiphospholipid syndrome: pregnancy outcome in a portuguese population. Acta Reumatol Port. 2009; 34(3):492-497.
14. Salafia CM, Cowchock FS. Placental pathology and antiphospholipid: a descriptive study. Am J Perinatol 1997; 14(8):435-441.
15. Van Horn JT, Craven C, Ward K, Branch DW, Silver RM. Histologic features of placentas and abortion specimens from women with antiphospholipid and antiphospholipid like syndromes. Placenta. 2004; 25(7):642-648.
16. Skrzypczak J1, Jasinski P, Wirstlein P, Gozdziewicz T, Rajewski M. Histologic changes in placenta and chorion of women with antiphospholipid syndrome and inherited thrombophilia. Ginekol Pol. 2011; 82(9):652-663.
17. Castejón OC, Ali S, Canache L. El edema de la vellosidad placentaria en los casos de muerte fetal. Gac Med Caracas 2006; 114 (4): 291-299.
18. Pinar H, Goldenberg RL, Koch MA, Heim-Hall J, Hawkins HK, Shehata B, Abramowsky C, Parker CB, Dudley DJ, Silver RM, Stoll B, Carpenter M, Saade G, Moore J, Conway D, Varner MW, Hogue CJ, Coustan DR, Sbrana E, Thorsten V, Willinger M, Reddy UM. Placental findings in singleton stillbirths. Obstet Gynecol. 2014; 123: 325-336.
19. Wilson WA, Gharavi AE, Koike T, Lockshin MD, Branch DW, Piette JC, Brey R, Derksen R, Harris EN, Hughes GR, Triplett DA, Khamashta MA. International consensus statement on preliminary classification criteria for definite antiphospholipid syndrome: report of an International Workshop. Arthritis Rheum 1999; 42(7):1309-1311.
20. Bates SM, Greer IA, Middeldorp S, Veenstra DL, Prabulos AM, Vandvik PO, American College of Chest Physicians. VTE, thrombophilia, antithrombotic therapy, and pregnancy: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest. 2012; 141(2 Suppl): e691S-736S.
21. Benirschke K, Kaufmann P. Pathology of the Human Placenta. 4ta edición. New York: Springer-Verlag, 2000.
22. Sen D, Kaufmann P, Schweikhart G. Classification of human placenta villi. II Morphometry. Cell Tissues Res. 1979; 200(3): 425-434.
23. Baergen RN. Manual of pathology of the human placenta. 2da edición. New York: Springer, 2011.
24. Correa A, Valderrama O, Angel R, Sáez J, Villablanca E. Síndrome antifosfolípido y embarazo. Rev Chil Obstet Ginecol 2002; 67(3): 196-202.
25. Sebire NJ, Backos M, Goldin RD, Regan L. Placental massive perivillous fibrin deposition associated with antiphospholipid antibody syndrome. BJOG. 2002; 109(5): 570-573.
26. Vora S, Shetty S, Khare M, Ghosh K. Placental histomorphology in unexplained foetal loss with thrombophilia. Indian J Med Res. 2009; 129(2):144-149.
27. Rai RS, Clifford K, Cohen H, Regan L. High prospective fetal loss rate in untreated pregnancies of women with recurrent miscarriage and antiphospholipid antibodies. Hum Reprod 1995; 10(12): 33013304.
28. Tong M, Viall CA, Chamley LW. Antiphospholipid antibodies and the placenta. A systematic review of their in vitro effects and modulation by treatment. Human Reproduction Update. 2015; 21(1): 97-118.
29. Hoppe B, Burmester GR, Dörner T. Heparin or aspirin or both in the treatment of recurrent abortions in women with antiphospholipid antibody (syndrome). Curr Opin Rheumatol. 2011; 23(3): 299-304.
30. Castillo M, Girón J, Cabrera J. Patrón clínico en gestantes con síndrome antifosfolipídico (SAF). Rev Obstet Ginecol Venez. 2014; 74(1): 3-9.
31. Castejón OC, López A, Pérez L, Castejón O. Presencia de alteraciones histopatológicas en vellosidades placentarias normales en Maracay. Rev Colomb Obstet Ginecol. 2009; 60(3): 237-246.
32. Fox H. Macroscopic abnormalities of the placenta. Pathology of the placenta. London: WB Saunders, 1997.
33. Romero R, Whitten A, Korzeniewski SJ, Than NG, Chaemsaithong P, Miranda J, Dong Z, Hassan SS, Chaiworapongsa T. Maternal floor infarction/massive perivillous fibrin deposition: a manifestation of maternal antifetal rejection?Am J Reprod Immunol. 2013; 70(4):285-298.
34. Sebire NJ, Backos M, El Gaddal S, Goldin RD, Regan L. Placental pathology, antiphospholipid antibodies, and pregnancy outcome in recurrent miscarriage patients. Obstet Gynecol. 2003; 101(2): 258-263.
35. Katzman PJ, Genest DR. Maternal floor infarction and massive perivillous fibrin deposition: histological definitions, association with intrauterine fetal growth restriction, and risk of recurrence. Pediatr Dev Pathol. 2002; 5(2): 159-164.
36. Bellini C, Rutigliani M, Boccardo F, Campisi C, Bellini T, Bonioli E, Fulcheri E. Are there lymphatic vessels in the placenta?. Lymphology. 2012; 45(1):34-36.
37. Roncati L, Barbolini G, Pusiol T, Piscioli F, Maiorana A. New advances on placental hydrops and related villous lymphatics. Lymphology. 2015; 48(1):28-37.
38. Kovalovszki L, Villányi E, Benkó G. Placental villous edema: a possible cause of antenatal hypoxia. Acta Paediatr Hung. 1990; 30(2): 209-215.
39. Mulla MJ, Brosens JJ, Chamley LW, Giles I, Pericleous C, Rahman A, Joyce SK, Panda B, Paidas MJ, Abrahams VM. Antiphospholipid antibodies induce a pro-inflammatory response in first trimester trophoblast via the TLR4/MyD88 pathway. Am J Reprod Immunol. 2009; 62(2):96-111.
40. Harper BE, Wills R, Pierangeli SS. Pathophysiological mechanisms in antiphospholipid syndrome. Int J Clin Rheumtol. 2011; 6(2):157-171.
41. Fernández-Llanio N, Alegre-Sancho J, Chalmeta-Verdejo C, Fernández-Carballido C, Román-Ivorra J. Terapias homonales, fertilidad y embarazo en el síndrome antifosfolipídico. Reumatol Clin. 2006; 2 (2): 90-106.
42. Mehta R, Nanjundaswamy S, Shen-Schwarz S, Petrova A. Neonatal morbidity and placental pathology. Indian J Pediatr. 2006; 73(1):25-28.
43. Redline RW, Minich N, Taylor HG, Hack M. Placental lesions as predictors of cerebral palsy and abnormal neucognitive function at school age in extremely low birth weight infants (<1kg). Pediatr Dev Pathol. 2007; 10(4):282-292.
44. Balanian NC, Mazzitelli NG, Solana C, Dinerstein A. Patologías placentarias y lesiones de la sustancia blanca cerebral detectadas por ultrasonografía en recién nacidos prematuros de muy bajo peso dentro de las 72 hs de vida. Rev Hosp Mat Inf Ramón Sarda. 2007; 26(2): 64-72.
45. Gutiérrez C, Beltramo P, Scavone C. Hallazgos placentarios en casos de parálisis cerebral. Arch Pediatr Urug. 2009; 80(3):178-183.
46. Hasbun J, Conte G, Sepúlveda W, Manríquez M, Martínez J. Síndrome antifosfolípidos y trombocitopenia materna en gemelar bicoriónico con restricción fetal grave. Rev Chil Obstet Ginecol. 2006; 71(6): 417-424.
47. Levy RA, Awad E, Oliveira J, Porto LC. Placental pathology in antiphospholipid syndrome. Lupus. 1998; 7 Suppl 2:S81-85.
48. Viall CA, Chamley LW. Histopathology in the placentae of women with antiphospholipid antibodies: A systematic review of the literature. Autoimmun Rev. 2015; 14(5):446-471.
CORRESPONDENCIA:
Lic. Msc. Ángela López.
Profesora Asociada de Morfología del Departamento de Ciencias Morfofisiológicas de la Universidad de Carabobo.
Investigadora del Laboratorio de Microscopía Electrónica del Centro de Investigación y Análisis Docente Asistencial del Núcleo Aragua (CIADANA).
Maracay-Edo Aragua.
Venezuela.
Email: anjoslo75 @ hotmail.com
Comentario del revisor Prof. Sandro Bustamante, M.Sc. Programa de Farmacología Molecular y Clínica. ICBM – Facultad de Medicina. Universidad de Chile. Santiago. Chile.
Se trata de un trabajo en el que los resultados son claros y las tablas están bien elaboradas, son comprensibles y aportan información al lector.
La discusión es consistente con los objetivos y los resultados descritos por los autores.
Comentario de la revisora Dra. María Jesús Coma. Especilista en Histopatología. Unidad de Investigación. Hospital Universitario de Burgos. España
Las lesiones vasculares placentarias, ya sea que afecten a los vasos maternos o a los fetales son un tema controvertido tanto para ginecólogos como neonatólogos. Es una entidad muy frecuente que puede poner en riesgo tanto la salud de la madre como del feto.
Son numerosas las enfermedades de la madre que son capaces de provocar cambios vasculares subyacentes a la mala perfusión placentaria, destacando entre ellas desde la pre-eclampsia, a las trombofilias, incluyendo hiperlipidemias diabetes mellitus y coagulopatias requieren estecho control gestacional, pues pueden ser causa tanto de muerte materna como fetal.
Estos trastornos suelen asociarse además a un incremento de la incidencia de parto prematuro, recién nacido con retraso del crecimiento intrauterino y diversas lesiones cerebrales del tipo de encefalopatía hipóxico-isquémica y parálisis cerebral.
Este trabajo consitutye un aportación más al conocimiento de la patología vascular placentaria.
