Indice del volumen Volume index
Comité Editorial Editorial Board
Comité Científico Scientific Committee
- IRA subclinica (determinada por los biomarcadores de IRA antes de la aparición de la IRA instalada)
- IRA (primeros 7 días). A su vez se divide si:
- Resolucion del cuadro de IRA antes de las 48 horas transitoria o rapidamente reversible
- Persistencia del cuadro de IRA por mas 48 horas
- ERA (Enfermedad renal aguda) persistencia de la injuria renal aguda desde el día 7 al 90
- ERC luego del día 90 desde el evento agudo
- Hiperfiltración glomerular: En muchos modelos de enfermedad renal aguda (ERA), una pérdida de la masa nefronal genera un fenómeno de hiperfiltración resultante en los glomérulos remanentes o de la reserva funcional renal. Hecho que se asemeja a las secuelas siguiente a una nefrectomía subtotal. Así mismo, también se observa un aumento de la carga de trabajo y del aumento del consumo de oxígeno, debido a un aumento del flujo sanguíneo, con la consiguiente activación de las señales de hipoxia y a la estimulación de la fibrosis túbulo-intersticial, fenómeno esencial en el desarrollo de ERC23-24.
- Desregulación mitocondrial: Durante la homeostasis los procesos de dinámica mitocondrial alternan constantemente entre procesos de fisión y fusión25.
Durante la lesión celular, la dinámica se desplaza hacia la fisión, este tipo de fragmentación mitocondrial se asocia con el daño de las membranas exteriores e interiores de estas organelas con la consiguiente disminución de la función y muerte celular, hecho que se objetiva durante la IRA y estaría implicado un aumento desmesurado de las especies reactivas del oxigeno (ROS) junto a la perdida de los sistemas antioxidantes competentes25-26.
Una interrupción persistente de la homeostasis mitocondrial después de la IRA, puede dar lugar a un proceso de respiración celular subóptimo, con la reducción celular consecuente de la adenosina trifosfato (ATP) y la consiguiente disfunción del tejido, todo lo cual contribuye al desarrollo de los daños crónicos27.
- Lesión endotelial y reducción de la densidad capilar. Varios modelos animales diferentes han demostrado que una disminución de la densidad vascular después de un episodio de IRA deriva en focos de fibrosis túbulo-intersticial. 62, 67-69 Tal rarefacción vascular conduce a la activación de las vías inducibles de hipoxia y promueve procesos pro-inflamatorios y pro-fibróticos24.
- Inflamación tubulointersticial / fibrosis. La fibrosis túbulo-intersticial es una característica predominante de la ERC tras la IRA. La hipertrofia tubular y la reducción de la densidad capilar juegan un papel importante en la patogénesis. La inflamación se ha demostrado que es un proceso clave en tanto en la IRA isquémica y séptica, que se caracteriza por la infiltración intersticial por neutrófilos durante la fase aguda y la infiltración monocítica-linfocítica en etapas posteriores23-24. La infiltración por monocitos potencia la lesión, así como la promoción de la proliferación de fibroblastos y consecuente fibrosis23.
Tales procesos pro-fibróticos se inician y mantienen por la producción y secreción de una variedad de péptidos, incluyendo citoquinas y factores de crecimiento. A pesar de que son necesarios para la reparación y regeneración de túbulos, estas moléculas bioactivas también tienen un efecto estimulante sobre los fibroblastos perivasculares contribuyendo a la fibrosis23.
Estos procesos celulares y paracrinos combinados conducen a cambios en la arquitectura del tejido en el que predomina la fibrosis.
- Potenciales reguladores claves
Transforming Growth Factor beta (TGF- beta) es una citoquina profibrotica clave que ejerce una amplia gama de acciones en el riñón, tanto en los estados de homeostasis y en la enfermedad28. La IRA es una condición proinflamatoria que implica una interacción compleja de citoquinas, distintos tipos celulares renales e infiltración por leucocitos29-30. El TGF- beta está aumentado en la IRA y tiene un efecto directo y perjudicial a través de la iniciación de la apoptosis tubular renal y el depósito de matriz extracelular31-32. - Recuperación temprana 26,6%
- Sin recuperación 25,5%
- Recuperación tardía 9,7%
- Recuperación tardía con episodios de reagudización con recuperación 22,5%
- Recuperación tardía con episodios de reagudización sin recuperación 14,7%
Letters to the Editor / Cartas al Editor
INJURIA RENAL AGUDA COMO ORIGEN DE LA NEFROPATÍA CRÓNICA
Fernando Lombi, Hernan Trimarchi
Servicio de Nefrología. Hospital Británico.
Buenos Aires, Argentina.
Email: fernandolombi @ gmail.com
Rev Electron Biomed / Electron J Biomed 2016;3:52-67.
Sr. Editor:
La visión tradicional de la recuperación después de una injuria renal aguda (IRA) sostenia que los pacientes que superaban con éxito la enfermedad grave, presentaban una restauración completa cuando su función renal retornaba a sus valores basales, previos al evento patológico ponderados por los niveles séricos de creatinina (sCr) o del clearence de creatinina (ClCr)1
La IRA es un síndrome clínico asociado con: aumento de la morbilidad, aumento de la mortalidad a corto y largo plazo, aumento de la incidencia de enfermedad renal crónica (ERC), progresión a ERC estadio V, reducción de los scores de calidad de vida y aumento desproporcionado de los costos de salud2
Al no existir un tratamiento específico de la IRA dada su multicausalidad, el objetivo de su abordaje se centra en que las intervenciones sean más oportunas, con el fin de mejorar los resultados de los pacientes con IRA. En tal sentido, la disponibilidad de los nuevos biomarcadores de daño y la evaluación de las combinaciones simultáneas de los clásicos biomarcadores funcionales y de daño tisular, ayudarían a estratificar a los pacientes en 4 subgrupos:
-
a) Ningún cambio en los biomarcadores
b) Solo cambios en los biomarcadores funcionales (Alteraciones hemodinámicas: depleción de volumen, inhibición del sistema renina-angiotensina-aldosterona (SRAA), síndrome (Sdme) cardiorenal, Sdme hepatorenal)
c) Solo cambios en los biomarcadores de daño (stress celular estimulo por DAMPs y PAMPs de los Toll-like receptors 4 en la sepsis)
d) Cambios en los dos biomarcadores funcionales y de daño (IRA instalada: Transitoria vs Persistente, Causa, Nefrotoxinas vs Isquémicas vs Sepsis; Evolución: Restitución vs Fibrosis; Evolución: ERC vs Óbito).3
Esta nueva forma de abordaje permitiría la identificación de una nueva categoría de pacientes con IRA, llamada 'IRA subclínica' o 'Angina Renal' o 'Estrés Renal Agudo', representada por un aumento de los marcadores de daño sin un aumento de la sCr (sin aumento de los biomarcadores de funcion)4.
Sobre la base de éste nuevo marco conceptual, se ha recomendado una modificación de los criterios KDIGO para incorporar el uso de marcadores de daño renal, además de la sCr, la tasa de filtración glomerular (TFG) y la diuresis. En tal sentido, la identificación de los biomarcadores de detención del ciclo celular indican el potencial desarrollo de la IRA como parte de una evolución en el diagnóstico molecular y la comprensión de la IRA. Estos biomarcadores pueden ser liberados por las células renales durante una fase anterior a la lesión lo que constituiría también un intento del riñón para proceder a la reparación y evitar la reparación mala adaptativa y su consecuente evolución hacia fibrosis3-4.
El objetivo que se persigue es mejorar la evolución, a través de un enfoque personalizado de los pacientes en riesgo de IRA o con una IRA instalada, Nefrología de Precisión. Es de suma importancia tener en cuenta que aún cuando no se observa un aumento "diagnóstico" de la sCr, esto no equivale a ausencia de daño renal y justamente los biomarcadores tempranos de daño podrían ser un indicador del fenómeno de "estrés renal agudo" antes de que se manifieste la lesión renal per se y como tal proporcionar el catalizador necesario para la intervención temprana4. Así mismo, un panel de biomarcadores podría mejorar incluso tanto el reconocimiento, como el tratamiento haciéndolo personalizado (nefrología de precisión) obteniendo mejores resultados y una probable reducción en la evolución de la ERC, sin necesariamente introducir nuevos agentes terapéuticos nefrotóxicos, pero si guiar en forma apropiada la administración de las terapias disponibles en la actualidad5.
A partir de estas consideraciones la Acute Disease Quality Initiative (ADQI) conference6 sugiere diferenciar temporalmente el entorno de las enfermedades agudas del riñón en (Figura 1)
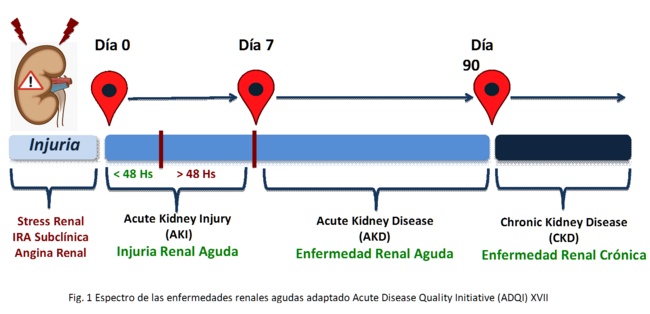
En dicho escenario establecer una definición clínica de recuperación renal resulta difícil, dado que se pueden incurrir en errores basados en la evaluación de los valores de referencia. ¿Cuál es la función renal basal? Es la sCr y la tasa de filtrado glomerular estimada en base a ella (eTFR) entre los 7 y 365 días antes del comienzo de la enfermedad7, a pesar de que estos parámetros carecen de sensibilidad para detectar la ERC subyacente y la incapacidad para detectar la presencia o ausencia de la reserva funcional renal (RFR)8. Así mismo, estos parámetros están supeditados al nivel de hidratación, la cuantía de la masa muscular, el tipo de dieta, etc.
Por otro lado, en ausencia de un valor basal de la concentración previa de la sCr, las guías derivadas de la Kidney Diseases Improving Global Outcomes (KDIGO) AKI workgroup, sugieren que la estimación de los niveles basales de sCr se haga extrapolando el valor a la ecuación Modifcation of Diet in Renal Disease (MDRD) la cual coincida con un valor de 75 mL / min / 1,73 m2 para la edad, sexo y raza del paciente9. Dicha circunstancia tampoco permite detectar la presencia de ERC preexistente o bien de la función renal basal, lo cual sin duda confunde la evaluación de la recuperación10.
En los pacientes que tienen un nivel de sCr de referencia desconocido o ausente, una alternativa es usar la creatinina en la admisión como línea de base11. Sin embargo, esta alternativa ignora la IRA pre-admisión y tiene muchos otros posibles factores de confusión, incluida la ausencia del estado estable, el efecto de la dilución después de la resucitación y la reducción de la producción de creatinina en la enfermedad crítica12.
Epidemiologia:
Actualmente la IRA constituye el motivo más frecuente de consulta en los servicios de nefrología13, la razón de ello se centra en la elevada incidencia de esta patología, la cual varía entre los 200014 a 1500015 pacientes / millón de habitantes / año de acuerdo a diferentes publicaciones. Así mismo, la incidencia de la IRA que requiere terapia de reemplazo renal (TRR) se ubica en 533 pacientes / millón de habitantes / año16. Cuando se analiza la distribución la IRA varia también de acuerdo al entorno donde se presente, siendo de 3,7 % en las salas de admisión, 9,6% salas de internación general y 70% en las salas de UTI17.
Un aspecto interesante es que la consideración de la IRA usualmente se basa en datos epidemiológicos provenientes de países desarrollados, donde la incidencia está valorada en entornos eminentemente urbanos. Ésta situación es plenamente diferente a la de los países en vías de desarrollo en los cuales la IRA se desarrolla en entornos eminentemente suburbanos y rurales, en donde la incidencia es sensiblemente mayor afectando a una población más joven prevaleciendo causas como las infecciosas (dengue, malaria, leptospirosis), síndrome urémico hemolítico, desastres naturales, enfrentamientos armados, picadura de ofidios o arácnidos, diarrea, Nefropatía de Mesoamérica18. No obstante, la IRA es un síndrome que se presenta prevalentemente en ancianos19.
Recientes publicaciones sugieren que la evolución adversa de la IRA se debe en parte a escasez y a una formación inadecuada en el personal sanitario, falta de conciencia acerca de las consecuencias, accesos limitados a los servicios de atención de salud, limitaciones en los medios diagnósticos, falta de guías de prácticas clínicas, y limitaciones en las ofertas de tratamiento20.
El efecto de la IRA es devastador y genera más muertes por año que el cáncer de próstata, cáncer de mama, insuficiencia cardiaca, e incluso todos ellos combinados21. La mortalidad anual asociada a la IRA es de 1, 4 millones de pacientes22.
Fisiopatologia de la relación IRA - Insuficiencia renal crónica (IRC)
En la IRA varios procesos se inician tanto de injuria como los de reparación, incluyendo la detención prematura del ciclo celular, la secreción de moléculas bioactivas, el reclutamiento e infiltración de células inflamatorias y células madres, la activación de miofibroblastos y fibrocitos23.
Dentro de los mecanismos subyacentes al proceso de reparación renal hay evidencia creciente que en el proceso de reepitelizacion se encuentran involucrados células tubulares que han sobrevivido al episodio de injuria con stem cells derivadas de la medula ósea cuya rol principal se centra en la secreción paracrina de factores de crecimiento24.
La frecuencia, gravedad, tipo y duración de la lesión, así como la reserva renal premórbida que se relacionan directamente con la edad y la ERC preexistente, todas estas condiciones parecen ser factores de riesgo para el desarrollo de un proceso de reparación maladaptativa.
Este tipo de reparación maladaptativa se relaciona con inflamación, fibrosis y rarefacción vascular, fenómenos que se relacionan con una disfunción celular y tisular persistente, con el riesgo consecuente de desarrollo de ERC.
Tanto las células epiteliales tubulares lesionadas como los macrófagos juegan un papel importante en el proceso de reparación. Perturbaciones del ciclo celular con detención en la fase G2/S llevan a la liberación de factores proinflamatorios y señales proliferativas con un especial impacto en la población de fibroblastos residentes24. Algunas de estas vías están directamente relacionadas con los procesos que se cree pueden causar la progresión de la ERC. Entre otros se destacan:
Evolución IRA a corto y largo plazo:
Para abordar la evolución de la IRA a corto y largo plazo, el gran desafío se centra en tratar de dilucidar el impacto que provoca la IRA sobre la reserva funcional renal (RFR) con el consecuente riesgo de un desarrollo de deterioro de la función renal mayor igual al 25% del valor basal con el consecuente desarrollo de ERC, necesidad de hemodiálisis crónica y mortalidad a mediano y largo plazo, lo cual se engloba dentro de lo que se conoce como Major Adverse Kidney Events (MAKE), el cual idealmente debería ser valorado a los 90 días.
Conceptualmente entonces, un tratamiento particular podría no afectar el pico máximo de sCr en sí, pero puede tener un efecto sustancial sobre la regeneración y la prevención de la fibrosis, produciendo por lo tanto un beneficio a largo plazo representado por una mayor RFR.
Hay pocas dudas de que los grupos de pacientes que desarrollan IRA tienen peores resultados que los grupos de pacientes que no lo hacen, pero la gran incógnita se centra en dilucidar el grado de afectación que muchas veces no se ve reflejado en un parámetro tan imperfecto de función renal como es la sCr.
Es importante entonces, pensar en el tratamiento de la IRA, no sólo para prevenir o para intervenir con el fin de evitar un aumento de la sCr, sino que es más importante, mejorar los pobres resultados clínicos33.
Las investigaciones futuras deberían centrarse en estos pacientes con terapias dirigidas evaluadas por la medida de los resultados a largo plazo34.
La supervivencia hospitalaria es un pobre subrogante de la sobrevida a largo plazo. La supervivencia a largo plazo sigue siendo pobre; pues es peor que muchas formas de cáncer35.
Se estima que 2,7 de cada 100 pacientes con IRA que requirieron TRR evolucionarán en los próximos 3 años con IRC terminal requiriendo hemodiálisis crónica36, menos del 40% de los pacientes están vivos y libres de diálisis al 1 año37.
La evidencia existente sugiere que la relación entre la IRA y el riesgo de ERC depende de la presencia y de la gravedad de la IRA. Chawla et al.38 demostraron a partir del análisis de datos de una cohorte de 5.351 pacientes con una función basal normal ingresados con IRA, por medio de una serie de modelos para predecir la probabilidad de desarrollo de ERC estadio IV o peor después del alta hospitalaria, que la IRA era un fuerte predictor de ERC estadio IV. Por otro lado también la edad avanzada, la albúmina sérica baja y la presencia de diabetes también fueron predictores38.
En un meta-análisis de 13 estudios retrospectivos evaluó la incidencia de los pacientes con ERC y con ERCT post-IRA la cual fue de 25,8 / 100 personas / año y de 8,6 / 100 personas / año, respectivamente39.
En pacientes con un nivel basal de TFG mayor a 60 ml / min / 1,73 m2, Bucaloiu et al40. identificaron 1610 pacientes con IRA hospitalaria asociado con una recuperación renal aparentemente completa dentro de los 90 días. Estos pacientes fueron comparados con un grupo control de pacientes que no experimentaron IRA usando un score de propensión de probabilidad para valorar el desarrollarlo de IRA. Luego de una mediana de seguimiento de 3 años, la tasa de ERC incidente fue de 28,1 casos / 1.000 personas / año en los pacientes sobrevivientes a la IRA y 13,1 casos / 1.000 personas / año en pacientes sin IRA previo.
Estos hallazgos sugieren que los sobrevivientes de IRA están en riesgo de padecer una evolución renal adversa incluso si su función renal definida por sCr, parece normalizarse al alta hospitalaria.
Resulta paradójico que a pesar de que el riesgo de ERC y otros eventos adversos es extremadamente alto post episodio de IRA, el seguimiento de estos pacientes por el nefrólogo es escaso.
Es importante destacar que la incidencia de la ERC progresiva en los pacientes supervivientes a un episodio de IRA puede ser subestimada, en gran parte porque la función renal no es rutinariamente controlada en programas de seguimiento estructurados41.
Si se evalúa cuales son los diferentes factores de riesgo asociados con una evolución renal adversa luego de un episodio de IRA estos incluyen: edad avanzada, score de comorbilidad de Charlson elevado, estadio de ERC, diabetes mellitus, hipertensión arterial, insuficiencia cardiaca, hipoalbuminuria, severidad de la IRA, nivel de sCr al alta, episodios recurrentes de IRA42.
Se le debe asignar un papel especial a la hipertensión arterial post-IRA como un potencial mediador de riesgo cardiovascular el cual fue destacado por Hsu et al.42. en un estudio retrospectivo de cohorte que incluyo a 2.451 pacientes previamente normotensos que sobrevivieron a un episodio de IRA. Los pacientes sobrevivientes a un episodio de IRA eran más propensos al desarrollo de hipertensión arterial, comparado con los que no sufrieron IRA durante un periodo de seguimiento de 2 años (46,1 vs. 41,2%), con una diferencia más evidente dentro de los 180 días. En un modelo multivariable, la IRA se asoció en forma independiente con el desarrollo de HTA durante el seguimiento [Odds ratio (OR) 1,22 ; IC 95% 1,12-1,33].
Un seguimiento del estudio RENAL demostró que el 5,4% de los pacientes con IRA que requirieron diálisis de mantenimiento a largo plazo después de un episodio de IRA que requirió terapia de reemplazo renal (TRR), mientras que Schiffl y Fischer reportaron una incidencia similar del 5%. 55 En un análisis combinado Goldberg y Dennen hallaron una amplia gama de los resultados, en función de la población de pacientes, encontrando una media en el requerimiento de diálisis a largo plazo de 12,5% en los supervivientes durante un seguimiento que vario de 1 a 10 años44.
Prowle y col. demostraron un aumento potencial del 135% en los diagnósticos de ERC al ajustar confundidores de una enfermedad grave prolongada y su impacto en la concentración de creatinina sérica (ejemplo: sarcopenia, sobrecarga de volumen, etc)45.
Sobre una cohorte sobre 130.134 pacientes críticos del Swedish Intensive Care Register desde 2005 al 2011, seguimiento de 1-7 años, el riesgo relativo de ERC de novo y la ERCT después de un episodio de IRA (pacientes con ERC fueron excluidos) fueron 7 a 22 veces más altas comparado con los pacientes que no experimentaron IRA464.
La incidencia de ERC fue del 6,0% al año (IC del 95%: 5,1-7,0) y 10,5% a los 5 años (95% IC 8,5-13,0) y con ERC terminal 0,44% al año (IC del 95%: 0,18-0,24) y de 1,8% a los 5 años (IC del 95% 1.6-1.9). Esto confirma los datos de estudios previos que han demostrado una asociación entre la IRA y la ERC subsecuente, por lo que la ERC se desarrolla en el 20-40% de los sobrevivientes de la IRA47-49.
En consecuencia con el pobre seguimiento de estos pacientes, existe poca información sobre las causas de muerte entre los supervivientes a un episodio de IRA. El seguimiento de unos 258 pacientes del estudio RENAL a 3,5 años las causas más frecuentes de muerte fueron cáncer (18%), cardiopatía isquémica (13%), sepsis (12%), neumonía (10%) e insuficiencia cardíaca congestiva (8%)50.
Seguimiento de la IRA a corto y largo plazo:
Pese a la recomendación de las KDIGO Guidelines para IRA de evaluar a los pacientes 3 meses después del cuadro de IRA en función de la aparición o el empeoramiento de la ERC preexistente, el U.S. Renal Data System reportó que sólo el 13% de los pacientes que han sufrido un episodio de IRA hospitalaria acudió a una consulta nefrológica dentro de los 3 meses del alta hospitalaria51.
No obstante, hay pocos modelos de atención ambulatoria existentes dedicados a los pacientes que sobreviven a un episodio de IRA. Una consulta con el nefrólogo dentro de los 90 días de alta hospitalaria se ha asociado con una mejoría de la supervivencia durante el periodo post-IRA52.
Un programa de atención ambulatoria dedicada a los sobrevivientes de un cuadro de IRA severa (KDIGO 2 o 3)53 propone una visita inicial a los 30 días del alta, la cual es seguida por visitas con intervalos de 2-6 meses de duración hasta 1 año después de la visita inicial a la clínica.
En una cohorte de 17.000 pacientes, se observaron cinco patrones de recuperación después de un episodio inicial de IRA: 54.
Las nuevas definiciones propuestas diferencian la recuperación precoz de la recuperación tardía6.
Algunos estudios determinan la "Recuperación" después de 3-7 días para hacer la distinción entre la recuperación renal "transitoria" o "persistente" (Figura 2). El timing en el patrón de cambios de la función renal y las recaídas después de una recuperación inicial se relacionaría con un aumento de la mortalidad54-55.
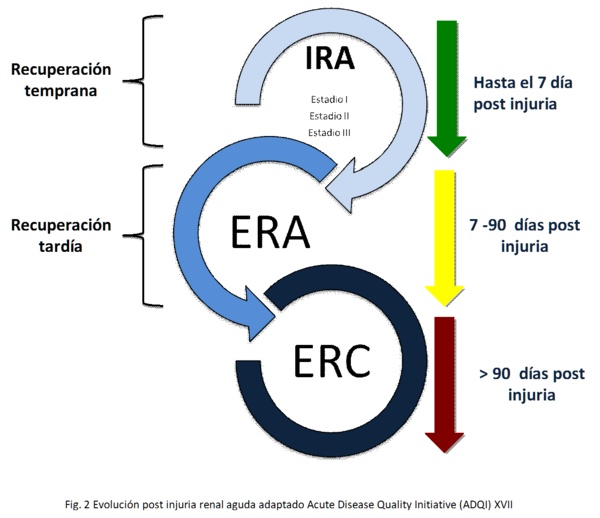
La evaluación inicial es llevada a cabo por un nefrólogo que evalúa en forma estandarizada: la presión arterial, pesquisa de microalbuminuria, rutina trimestral (que incluyen: hemoglobina, ionograma, creatinina sérica, calcio, fosforo), modificación de factores de riesgo cardiovascular, manejo de complicaciones de la ERC, medicación nefroprotectora y referencia para especialistas de acuerdo a las comorbilidades. Después de 1 año de seguimiento, se evalúa el seguimiento por nefrología o la derivación al médico clínico o de familia.
La consideración más importante en términos de seguimiento a largo plazo es que el tratamiento debe permanecer subordinado a las recomendaciones para tratar la ERC:
1. La remisión a un especialista en nefrología, con evidencia demostrada sobre una reducción de la mortalidad por todas las causas en pacientes con IRA severa que se sometieron a TRR. Además, la derivación nefrológica temprana en pacientes con ERC también demuestra un beneficio en la supervivencia. 52-53
2. Control de la hipertensión arterial a través del tratamiento con inhibidores de la enzima convertidora de angiotensina (IECAs) o antagonistas de los receptores de angiotensina II (ARA II).
3. La proteinuria moderada a severa deben ser abordadas con una terapéutica agresiva para el control de la hipertensión arterial y el uso de otros antiproteinúricos.
4. La consideración del alto riesgo de desarrollar episodios de IRA en aquellos con ERC durante la enfermedad crítica.
5. Recomendaciones generales para mantener el estado de salud cardiovascular, estilo de vida y la dieta.
Organizar el seguimiento:
En la práctica, el principal obstáculo es la identificación de los pacientes para el seguimiento. Esto puede ser problemático, ya que el alta hospitalaria puede haber muchas semanas o meses después del episodio de la IRA con el alta del equipo a menudo que no participan en el manejo activa del paciente durante su enfermedad crítica.
¿Qué pacientes requieren un seguimiento?
Seguimiento para el desarrollo de la ERC se debe considerar en todos los pacientes que desarrollaron IRA, independientemente del aparente grado de recuperación renal. Es importante destacar que, mientras sólo una pequeña proporción de supervivientes de IRA pueden desarrollar con el tiempo ERC terminal, muchos mueren especialmente de causas cardiovasculares.56. La ERC esta, en efecto fuertemente asociada con morbilidad y mortalidad de origen cardiovascular57-58. En los sobrevivientes más jóvenes, el desarrollo de hipertensión y eventos cardiovasculares acelera el riesgo de desarrollo de ERC y de progresión de la enfermedad, con lo que puede desarrollarse después de muchos años ERCT, incluso si hay una aparentemente buena recuperación inicial.
Por lo tanto, en todos los grupos de supervivientes de IRA hay un gran potencial para las intervenciones con el objetivo de mejorar los resultados a largo plazo.
Impacto de la IRA no severa a largo plazo
Habitualmente se asocia únicamente a la IRA con requerimiento de TRR con un mal pronóstico a largo plazo y no se la asocia con la ÏRA no severa sin requerimiento de TRR, cuadros predominantes en las salas generales de internación. No obstante, un estudio demostró que a pesar del menor status de gravedad los pacientes que desarrollaron IRA no severa (sin requerimiento de TRR) estos pacientes tenían un riesgo cuatro veces mayor de muerte intrahospitalaria (1,2% vs 5,1%), el cual aumentaba a casi el doble al 1 año (19,7% vs 34,2%; p <0,001). Se especula con que estos pacientes con IRA de "baja severidad" podrían estar expuestos a un mayor riesgo relativo debido a una subestimación de la gravedad del cuadro59.
Joannidis et. al.60, reportaron la contribución de la IRA a la mortalidad en especial en pacientes con una menor gravedad inicial de la enfermedad. Tales pacientes son generalmente considerados de menor riesgo para el desarrollo de IRA y tienen menos probabilidades de recibir intervenciones recomendadas para los pacientes de alto riesgo, tales como: evitar drogas nefrotóxicas innecesarias y contraste radiológico, una estrecha vigilancia sobre la creatinina sérica y la diuresis, y la evaluación de la administración de volumen
Irónicamente, aunque muchos más eventos serán vistos en pacientes de alto riesgo, el relativo impacto de la IRA en la supervivencia es mayor en los pacientes de bajo riesgo61. En los pacientes sin otros fallos orgánicos, puede ser más fácil, en virtud de su complejidad clínica inferior, prevenir que la IRA se desarrolle en primer lugar.
Esto lleva a la suposición de que los esfuerzos para reducir la IRA en pacientes críticamente enfermos podrían ser más eficaces si se aplican a los pacientes de bajo riesgo o por lo menos estos pacientes no deberían excluirse.
Incluso sin ser lo suficientemente graves como para justificar la TRR, la IRA afecta a múltiples sistemas orgánicos. Entre los mecanismos que explicarían estos hallazgos se incluyen: disfunción inmune62, sobrecarga de volumen63-66. y eventos adversos de los medicamentos (AAM)67-69.
En conclusion, el seguimiento de los pacientes con IRA constituye un pilar fundamental en los sistemas de salud dado su impacto en las complicaciones a corto - largo plazo y su impacto en términos de mortalidad en especial de origen cardiovascular.
La sCr es un parámetro imperfecto para valorar la RFR, la expectativa se centra en los nuevos marcadores de daño para poder valorar las respuestas del riñón hacia una reparación mal-adaptativa o a la reparación "ad integrum".
Es importante destacar la importancia del seguimiento clínico-nefrológico poniendo hincapié en las medidas de control de la presión arterial, factores de riesgo cardiovascular, medicación nefrotoxica y controles regulares.
REFERENCIAS
-
1. Campana M, Chawla LS, Wald R. Understanding renal recovery. Intensive Care Med. 2017 Mar 23.
2. Rewa O, Bagshaw SM. Acute kidney injury-epidemiology, outcomes and economics. Nat Rev Nephrol 2014; 10: 193-207.
3. Katz N., Ronco C. Acute kidney stress-a useful term based on evolution in the understanding of acute kidney injury. Critical Care 2016; 20: 23.
4. Kellum JA, Chawla LS. Cell-cycle arrest and acute kidney injury: the light and the dark sides. Nephrol Dial Transplant 2016; 31(1):16-22.
5. Forni L.G, Chawla L, Ronco C. Precision and improving outcomes in acute kidney injury: Personalizing the approach. J Crit Care. 2017;37:244-245.
6. Chawla LS, Bellomo R, Bihorac A, Goldstein SL, Siew ED, Bagshaw SM,et al. Acute Disease Quality Initiative Workgroup 16. Acute kidney disease and renal recovery: consensus report of the Acute Disease Quality Initiative (ADQI) 16 Workgroup. Nat Revi Nephro.2017;l 13:241-257.
7. Siew ED, Ikizler TA, Matheny ME, Shi Y, Schildcrout JS, Danciu I, et al. Estimating baseline kidney function in hospitalized patients with impaired kidney function. Clin J Am Soc Nephrol.2012; 7:712-719.
8. Ronco C, Rosner MH. Acute kidney injury and residual renal function. Crit Care. 2012;16:144.
9. Siew ED, Matheny ME. Choice of reference serum creatinine in defining acute kidney injury. Nephron. 2015;131:107-112.
10. Bernardi MH, Schmidlin D, Ristl R, Heitzinger C, Schiferer A, Neugebauer T, Wrba T, Hiesmayr M, Druml W, Lassnigg A. Serum creatinine backestimation in cardiac surgery patients: misclassification of AKI using existing formulae and a data-driven model. Clin J Am Soc Nephrol. 2016; 11:395-404.
11. Schetz M, Gunst J, De Vlieger G, Van den Berghe G. Recovery from AKI in the critically ill: potential confounders in the evaluation. Intensive Care Med. 2015; 41:1648-1657.
12. Prowle JR. Acute kidney injury: creatinine and AKI-through a glass, darkly. Nat Rev Nephrol. 2013; 9:193-195.
13. Koyner JL, Cerdá J, Goldstein SL, Jaber BL, Liu KD, Shea JA, Faubel S; Acute Kidney Injury Advisory Group of the American Society of Nephrology. The daily burden of acute kidney injury: a survey of U.S. nephrologists on World Kidney Day. Am J Kidney Dis. 2014 Sep;64(3):394-401.
14. Chawla LS, Kimmel PL. Acute kidney injury and chronic kidney disease: an integrated clinical syndrome. Kidney Int. 2012; 82(5):516-24.
15. Bedford M, Stevens PE, Wheeler TW, Farmer CK. What is the real impact of acute kidney injury?. BMC Nephrol. 2014 21;15:95.
16. Hsu RK, McCulloch CE, Dudley RA, Lo LJ, Hsu CY. Temporal changes incidence of dialysis-requiring AKI. J Am Soc Nephrol. 2013 Jan;24(1):37-42.
17. Lewington A, Cerda J, Mehta RL. Raising awareness of acute kidney injury a global perspective of a silent killer. Kidney Int. 2013; 84: 457- 67.
18. Mehta RL, Cerdá J, Burdmann EA, Tonelli M, García-García G, Jha V, et al. International Society of Nephrology's 0by25 initiative for acute kidney injury (zero preventable deaths by 2025): a human rights case for nephrology. Lancet 2015; 385 (9987): 2616-2643.
19. United Nations Department of Economic and Social Affairs Population Division. World Population Ageing: 1950-2050 [onlne], http:// www.un.org/esa/population publications/ World ageing 19502050 (2014).
20. Joseph Lunyera J, Kilonzo K, Lewington A, et. al. Acute Kidney Injury in Low-Resource Settings: Barriers to Diagnosis, Awareness, and Treatment and Strategies to Overcome These Barriers. Am J Kidney Dis 2016; 67 (6): 834-840.
21. Lewington A, Cerda J, Mehta RL. Raising awareness of acute kidney injury a global perspective of a silent killer. Kidney Int 2013; 84: 457- 67.
22. Schieppati A, Perico N, Remuzzi G. Eliminating treatable deaths due to acute kidney injury in resource-poor settings. Semin Dial. 2015;28:193-197.
23. Chawla LS, Eggers PW, Star RA, Kimmel PL Acute kidney injury and chronic kidney disease as interconnected syndromes. N Engl J Med 2014; 371:58-66.
24. Venkatachalam MA, Weinberg JM, Kriz W, Bidani AK (2015) Failed tubule recovery, AKI-CKD transition, and kidney disease progression. J Am Soc Nephrol 26:1765-1776.
25. Zhan M, Brooks C, Liu F, Sun L, Dong Z. Mitochondrial dynamics: regulatory mechanisms and emerging role in renal pathophysiology. Kidney Int. 2013; 83:568-58.
26. Brooks C, Wei Q, Cho SG, Dong Z. Regulation of mitochondrial dynamics in acute kidney injury in cell culture and rodent models. J Clin Invest. 2009; 119:1275-1285.
27. Funk JA, Schnellmann RG. Persistent disruption of mitochondrial homeostasis after acute kidney injury. Am J Physiol Renal Physiol. 2012; 302:F853-F864.
28. Loeffler I,Wolf G. Transforming growth factor-beta and the progression of renal disease. Nephrol Dial Transplant. 2014; 29 (Suppl 1):i37-i45.
29. Kinsey GR, Okusa MD. Role of leukocytes in the pathogenesis of acute kidney injury. Crit Care. 2012; 16:214.
30. Kinsey GR, Li L, Okusa MD. Inflammation in acute kidney injury. Nephron Exp Nephrol 2008; 109:e102-e107.
31. Gentle ME, Shi S, Daehn I. Epithelial cell TGFbeta signaling induces acute tubular injury and interstitial inflammation. J Am Soc Nephrol. 2013; 24:787-799.
32. Gewin L, Vadivelu S, Neelisetty S. Deleting the TGF-beta receptor attenuates acute proximal tubule injury. J Am Soc Nephrol. 2012; 23:2001-2011.
33. Billings F.T , Shaw A.D. Clinical Trial Endpoints in Acute Kidney Injury. Nephron Clin Pract. 2014; 127: 89 - 93.
34. Canaud G, Bonventre JV. Cell cycle arrest and the evolution of chronic kidney disease from acute kidney injury. Nephrol Dial Transplant 2015 30(4):575-83.
35. Kellum JA. Are Outcomes from Severe Acute Kidney Injury Really Improving?. Am J Respir Crit Care Med. 2015; 192(8): 909-917.
36. Wald R, Shariff SZ, Adhikari NK, et. al. The association between renal replacement therapy modality and long-term outcomes among critically ill adults with acute kidney injury: a retrospective cohort study. Crit Care Med. 2014; 42 (4): 868-77.
37. Pike F, Murugan R, Keener C, et. al. Biological Markers for Recovery of Kidney (BioMaRK) Study Investigators. Biomarker enhanced risk prediction for adverse outcomes in critically ill patients receiving RRT. Clin J Am Soc Nephrol. 2015; 10: 1332-1339.
38. Chawla LS, Amdur RL, Amodeo S, Kimmel PL, Palant CE. The severity of acute kidney injury predicts progression to chronic kidney disease. Kidney Int. 2011; 79:1361-1369.
39. Coca SG, Singanamala S, Parikh CR. Chronic kidney disease after acute kidney injury: a systematic review and meta-analysis. Kidney Int. 2012; 81:442-448.
40. Bucaloiu ID, Kirchner HL, Norfolk ER, Hartle JE 2nd, Perkins RM. Increased risk of death and de novo chronic kidney disease following reversible acute kidney injury. Kidney Int 2012 81:477-485.
41. Siew ED, Peterson JF, Eden SK, Hung AM, Speroff T, Ikizler TA, Matheny ME. Outpatient nephrology referral rates after acute kidney injury. J Am Soc Nephrol. 201223:305-312.
42. Silvera S.A, Wald R. Improving outcomes of acute kidney injury survivors. Curr Opin Crit Care. 2015, 21:500-505.
43. Joseph Lunyera J, Kilonzo K, Lewington A, et. al. Acute Kidney Injury in Low-Resource Settings: Barriers to Diagnosis, Awareness, and Treatment and Strategies to Overcome These Barriers. Am J Kidney Dis. 2016; 67 (6): 834-840.
44. Goldberg R, Dennen P. Long-term outcomes of acute kidney injury. Adv Chronic Kidney Dis. 2008;15(3):297 -307.
45. Prowle JR, Kolic I, Purdell-Lewis J, Taylor R, Pearse RM, Kirwan CJ. Serum creatinine changes associated with critical illness and detection of persistent renal dysfunction after AKI. Clin J Am Soc Nephrol. 2014; 9:1015-1023.
46. Rimes-Stigare C, Frumento P, Bottai M, Martensson J, Martling CR, Walther SM, Karlstrom G, Bell M. Evolution of chronic renal impairment and long-term mortality after de novo acute kidney injury in the critically ill; a Swedish multi-centre cohort study. Crit Care.2015; 19:221.
47. Amdur RL, Chawla LS, Amodeo S, Kimmel PL, Palant CE. Outcomes following diagnosis of acute renal failure in U.S. veterans: focus on acute tubular necrosis. Kidney Int. 2009; 76:1089-1097.
48. Bucaloiu ID, Kirchner HL, Norfolk ER, Hartle JE 2nd, Perkins RM. Increased risk of death and de novo chronic kidney disease following reversible acute kidney injury. Kidney Int. 2012; 81:477-485.
49. Goldstein SL, Jaber BL, Faubel S, Chawla LS, Acute Kidney Injury Advisory Group of American Society of Nephrology. AKI transition of care: a potential opportunity to detect and prevent CKD. Clin J Am Soc Nephrol. 2013; 8:476-483.
50. Gallagher M, Cass A, Bellomo R, et al. Long-term survival and dialysis dependency following acute kidney injury in intensive care: extended follow-up of a randomized controlled trial. PLoS Med. 2014; 11:e1001601.
51. United States Renal Data System: USRDS 2012 Annual Data Report: Atlas of Chronic Kidney Disease and End-Stage Renal Disease in the United States, Bethesda, MD, National Institutes of Health, National Institute of Diabetes and Digestive and Kidney Diseases, 2012.
52. Harel Z, Wald R, Bargman JM, et al. Nephrologist follow-up improves all cause mortality of severe acute kidney injury survivors. Kidney Int 2013; 83:901-908.
53. Silver SA, Harel Z, Harvey A, et al. Improving care after acute kidney injury: a prospective time series study. Nephron 2015; 131:43-5.
54. Kellum JA, Sileanu FE, Bihorac A, Hoste EA, Chawla LS. Recovery after acute kidney injury. Am J Respir Crit Care Med. 2016; doi:10.1164/ rccm.201604-0799OC.
55. Heung M, Steffick DE, Zivin K, Gillespie BW, Banerjee T, Hsu CY, Powe NR, Pavkov ME, Williams DE, Saran R, Shahinian VB, Centers for Disease Control and Prevention CKD Surveillance Team. Acute kidney injury recovery pattern and subsequent risk of CKD: an analysis of veterans health administration data. Am J Kidney Dis.2016; 67:742-752.
56. Wu VC, Wu CH, Huang TM, Wang CY, Lai CF, Shiao CC, Chang CH, Lin SL, Chen YY, Chen YM, Chu TS, Chiang WC, Wu KD, Tsai PR, Chen L, Ko WJ, NSARF Group (2014) Long-term risk of coronary events after AKI. J Am Soc Nephrol 25:595-605
57. Matsushita K, Coresh J, Sang Y, Chalmers J, Fox C, Guallar E, Jafar T, Jassal SK, Landman GW, Muntner P, Roderick P, Sairenchi T, Schottker B, Shankar A, Shlipak M, Tonelli M, Townend J, van Zuilen A, Yamagishi K, Yamashita K, Gansevoort R, Sarnak M, Warnock DG, Woodward M, Arnlov J, CKD Prognosis Consortium. Estimated glomerular filtration rate and albuminuria for prediction of cardiovascular outcomes: a collaborative meta-analysis of individual participant data. Lancet Diabetes Endocrinol. 2015; 3:514-525.
58. Levey AS, de Jong PE, Coresh J, El Nahas M, Astor BC, Matsushita K, Gansevoort RT, Kasiske BL, Eckardt KU. The definition, classification, and prognosis of chronic kidney disease: a KDIGO controversies conference report. Kidney Int. 2010; 80:17-28.
59. Murugan R, Karajala-Subramanyam V, Lee M, Yende S, Kong L, Carter M, et al. Acute kidney injury in non-severe pneumonia is associated with an increased immune response and lower survival. Kidney Int 2010;77:527-35.
60. Joannidis M, Metnitz B, Bauer P, Schusterschitz N, Moreno R, Druml W, et al. Acute kidney injury in critically ill patients classified by AKIN versus RIFLE using the SAPS 3 database. Intensive Care Med. 2009;35:1692-702.
61. Sileanu FE, Murugan R, Lucko N, Clermont G, Kane-Gill SL, Handler SM, et al. AKI in low-risk versus high-risk patients in intensive care. Clin J Am Soc Nephrol. 2015;10:187-96.
62. Mehta RL, Bouchard J, Soroko SB, Ikizler TA, Paganini EP, Chertow GM, Himmelfarb J; Program to Improve Care in Acute Renal Disease (PICARD) Study Group. Sepsis as a cause and consequence of acute kidney injury: Program to Improve Care in Acute Renal Disease. Intensive Care Med 2011;37:241-8.
63. Sutherland SM, Zappitelli M, Alexander SR, Chua AN, Brophy PD, Bunchman TE, Hackbarth R, Somers MJ, Baum M, Symons JM, Flores FX, Benfield M, Askenazi D, Chand D, Fortenberry JD, Mahan JD, McBryde K, Blowey D, Goldstein SL. Fluid overload and mortality in children receiving continuous renal replacement therapy: The Prospective Pediatric Continuous Renal Replacement Therapy Registry. Am J Kidney Dis 2010;55:316-25.
64. Bouchard J, Soroko SB, Chertow GM, Himmelfarb J, Ikizler TA, Paganini EP, Mehta RL; Program to Improve Care in Acute Renal Disease (PICARD) Study Group. Fluid accumulation, survival and recovery of kidney function in critically ill patients with acute kidney injury. Kidney Int 2009;76:422-7.
65. Boyd JH, Forbes J, Nakada T-A, Walley KR, Russell JA. Fluid resuscitation in septic shock: a positive fluid balance and elevated central venous pressure are associated with increased mortality. Crit Care Med . 2011;39:259-65.
66. Prowle JR, Echeverri JE, Ligabo EV, Ronco C, Bellomo R. Fluid balance and acute kidney injury. Nat Rev Nephrol . 2010;6:107-15.
67. Classen DC, Pestotnik SL, Evans RS, Lloyd JF, Burke JP. Adverse drug events in hospitalized patients. Excess length of stay, extra costs, and attributable mortality. JAMA 1997;277:301-6.
68. Kane-Gill SL, Kirisci L, Verrico MM, Rothschild JM. Analysis of risk factors for adverse drug events in critically ill patients. Crit Care Med 2012;40:823-8.
69. Cox ZL, McCoy AB, Matheny ME, Bhave G, Peterson NB, Siew ED, Lewis J, Danciu I, Bian A, Shintani A, Ikizler TA, Neal EB, Peterson JF. Adverse drug events during AKI and its recovery. Clin J Am Soc Nephrol 2013;8:1070-8.
CORRESPONDENCIA:
Dr. Fernando Lombi
Servicio de Nefrología,
Hospital Británico de Buenos Aires
Argentina.
Email: fernandolombi @ gmail.com
