Indice del volumen Volume index
Comité Editorial Editorial Board
Comité Científico Scientific Committee
PEQUEÑAS VESÍCULAS, GRANDES VEHÍCULOS: LOS EXOSOMAS
Patricia Saiz-Lopez1, Raquel Alcaraz2, Enrique García-Toro1
1Servicio de Anatomía Patológica. 2Unidad de Investigación.
Hospital Universitario de Burgos.
Burgos. España
saizpa @ hubu.es
Rev Electron Biomed / Electron J Biomed 2016;3:33-40
Comentario del revisor Dr. David Ontoso Picon, MD. PhD. Biología Molecular. Memorial Sloan Kettering Cancer Center, Nueva York. USA.
Comentario del revisor Prof. Carlos I. Lorda Diez, PhD. Departamento de Anatomía y Biología Celular, Facultad de Medicina, Universidad de Cantabria - IDIVAL. España.
RESUMEN
Los exosomas son pequeñas vesículas de membrana liberadas por diferentes tipos celulares. Desde su descubrimiento, han pasado de considerarse meros vehículos de liberación de deshechos celulares, a convertirse en uno de los campos más prometedores en el área de investigación biomédica, y más concretamente oncológica, ya que los diferentes tumores malignos liberan exosomas a los distintos fluidos biológicos, estando involucrados en numerosas funciones del proceso neoplásico.
Actualmente, se puede recurrir al estudio de estas vesículas mediante técnicas mínimamente invasivas para los pacientes, que nos aproximan a la obtención de un diagnóstico y pronóstico más acotado, así como al descubrimiento de nuevas terapias antitumorales.
PALABRAS CLAVE: Cáncer. Biomarcador. Biopsia líquida
SUMMARY: SMALL VESICLES, BIG VEHICLES: EXOSOMES
Exosomes are small membranous vesicles released by different cell types. Since their discovery, they have evolved from being considered simple vehicles for the liberation of cellular wastes, to become one of the most promising fields in the area of biomedical research, and more specifically in oncology, since the different malignant tumors release exosomes to all biological fluids, being involved in various functions of the neoplastic process.
At present, it is possible to study these vesicles by minimally invasive techniques in patients, which approach us to obtain a more detailed diagnosis and prognosis, as well as to the discovery of new antitumoral therapies.
KEY WORDS: Cancer. Biomarker. Liquid biopsy
INTRODUCCIÓN
Los exosomas son pequeñas vesículas de membrana de entre 30-150 nm de diámetro, liberadas mediante exocitosis por distintos tipos celulares, incluyendo las células tumorales, y presentes en numerosos fluidos biológicos1.
Fueron descritas por primera vez en 19832, y su función biológica ha sido aceptada durante años como una forma de liberación de residuos celulares3, hasta que una década más tarde se ha confirmado su labor mediadora en la comunicación célula-célula4.
De forma remarcable, se ha visto que las células tumorales liberan un mayor número de exosomas que las sanas5. Por ejemplo, en un trabajo publicado el pasado año por Matsumoto y cols.6 se describe la cuantificación de exosomas en plasma como un marcador pronóstico del carcinoma escamoso de esófago, al determinar que los pacientes de este tipo de cáncer presentaban unos niveles de exosomas superiores a los de pacientes con afectaciones no malignas.
El objeto de esta revisión es mostrar el potencial clínico de los exosomas en el diagnóstico del cáncer.
Origen, estructura y composición de los exosomas
En una célula eucariota, vesículas endocíticas de la membrana plasmática se fusionan para formar endosomas tempranos que maduran a endosomas tardíos5,7.
Más adelante, los endosomas tardíos pasan a denominarse cuerpos multivesiculares (MVB del inglés 'multivesicular bodies') ya que contienen muchas vesículas que reciben el nombre de vesículas endosómicas intraluminales ('intraluminal endosomal vesicles' ILV).
Cuando los MVB se fusionan con la membrana plasmática, liberan sus ILV al espacio extracelular en un proceso de exocitois8; es entonces cuando estas vesículas son denominadas exosomas9.
Se ha sugerido que los heparan sulfato proteoglicanos y la sinteína podrían controlar la formación de los exosomas10-11, mientras que su secreción podría regularse por la via de las Rab GTPasas12-13, además de intervenir factores como el pH del microentorno celular, de forma que con menor pH, se ha visto un incremento tanto en la liberación de exosomas como en su captación en células receptoras14.
Los exosomas tienen una estrucutra compuesta por una bicapa fosfolipídica, que, en comparación con la membrana celular, es rica en colesterol y esfingomielina15. En un principio se pensó que los exosomas eran homogéneos, mientras que hoy se sabe que su composición varía según el origen y estado celular16. Por ejemplo, exosomas de un tipo específico de tumor expresarán los marcadores específicos del mismo, como en el caso de la melanina A en los melanomas17.
Por tanto, pueden presentar en su superficie numerosas proteínas, destacando el CD63, CD81, CD82, CD53 y CD37, empleadas como marcadores de exosomas18, así como EGF o TGF-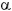 , relevantes al ser ligandos de EGFR19.
, relevantes al ser ligandos de EGFR19.
Por otra parte, su núcleo es acuoso, de forma que pueden compartimentalizar y preoteger de ser degradadas a numerosas moléculas, incluyendo proteínas, lípidos, RNA mensajeros y microRNAs20-21. Dentro de las proteínas destacan las anexinas, GTPasas, proteínas de choque térmico y proteínas de síntesis de los MVB (Alix y TSG101) entre otras.
Otra propiedad de su estrucura es que les permite distribuirse facilmente por el organismo, pudiendo incluso atravesar la barrera hematoencefálica. Por tanto, los exosomas son capaces de transportar diversos components biológicos a células receptoras muy distantes que son capaces de absorberlos, de forma que actúan en la comunicación intercelular en un amplio rango de circunstancias, tanto patológicas como fisiológicas. Aprovechando estas características de los exosomas, éstos pueden emplearse como vehículos de fármacos antitumorales; por ejemplo, se ha descubierto que el paclitaxel es 50 veces más potente encapsulado en exosomas en el tratamiento de pacientes con cáncer de pulmón22.
De esta forma, los exosomas pueden encontrarse en diversos fluidos biológicos incluyendo el suero, plasma, orina, líquido amniótico o leche materna, introduciéndose así el término biopsia líquida a la hora de estudiar los exosomas, con los beneficios de su obtención mediante métodos mínimamente invasivos para el paciente. Su aislameinto del fluído y los métodos de análisis de los exosomas son fundamentales para conocerlos en profundidad, destacando en las investigaciones actuales los sistemas de centrifugación y análisis de miRNAs, aunque hay novedosas téncinas de aislamiento en desarrollo23-24.
Función de los exosomas en el desarrollo del cáncer
Frente a los estudios iniciales sobre la liberación de exosomas como un mecanismo para eliminar las moléculas de desecho de las células25, otros estudios propusieron una comunicación funcional entre exosomas y células, destacando en la actualidad su papel en carcinogénesis.
Una vez que las células receptoras reciben los exosomas, proceso que a día de hoy se considera que no es al azar, sino dependiente de proteínas de membrana26, las moléculas transportadas son capaces de modificar las cascadas de señalización celular, pudiendo desencadenar la iniciación del proceso tumoral o metástasis, así como pudiendo hacerlas resistentes a tratamientos antitumorales27.
Melo y cols.28 describieron que los exosomas derivados de tumores pueden promover la formación de tumores mediante la regulación de la síntesis de miRNA mediante los miRNAs transferidos por los exosomas, afectando a la iniciación y la progresión del tumor.
Además, las células tumorales pueden promover la angiogénesis, favoreciendo el crecimiento tumoral. Cui y cols.29 encontraron que los exosomas derivados de células de cáncer de pulmón pueden transportar selectivamente miRNA-210 a células endoteliales y promover la formación de vasos sanguíneos tumorales.
Otro descubrimiento relevante es que el análisis en el contenido de RNA largo no codificante (lncRNA) en exosomas de muestras de pacientes de cáncer de próstata, gástrico y en carcinomas escamosos de laringe ha servido para diferenciar células cancerosas de células normales30, lo que abre paso a nuevos métodos de detección del cáncer.
De forma similar, mayores niveles de exosomas CD63+ en sangre se detectaron en pacientes con melanoma, comparados con voluntarios sanos31.
Hay que destacar que también la afinidad por metastatizar hacia un órgano determinado se ha visto relacionada con marcadores específicos de los exosomas. Patrones de expresión de integrinas 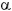 6
6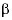 4 y
4 y 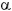 6
6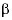 1 en células cancerígenas se han relacionado con metástasis pulmonar, mientras que otras integrinas estaban relacionadas con metástasis en hígado32. Por tanto, este descubrimeinto podría emplearse para predecir la evolución de un tumor y generar nuevas dianas terapéuticas contra el proceso metastásico.
1 en células cancerígenas se han relacionado con metástasis pulmonar, mientras que otras integrinas estaban relacionadas con metástasis en hígado32. Por tanto, este descubrimeinto podría emplearse para predecir la evolución de un tumor y generar nuevas dianas terapéuticas contra el proceso metastásico.
Por todo ello, no sólo la cuantificación sino también la caracterizción molecular de los exosomas es relevante para conocer su funcionamiento y utilidad clínica. Por ejemplo, se ha sugerido que glipican-1 podría ser utilizado para detectar el cáncer pancreático en estadio temprano28 y que los miR-21 y miR-93 podrían ser utilizados para detectar la fase temprana de carcinoma hepatocelular33-34
CONCLUSIÓN:
El potencial de los exosomas derivados de tumores para monitorizar la evolución de neoplasias malignas, así como para la detección temprana de las mismas, convierte a los exosomas en objeto de prometedoras investigaciones, no sólo mediante el estudio de la carga de exosomas en los diferentes fluidos biológicos, sino mediante la caracterización de su contenido en biomarcadores, como lo son los miRNAs.
Por otra parte, el uso clínico de microvesículas de origen biológico como vehículos para fármacos o terapia génica dirigida tomanado como referencia a los exosomas es una herramienta en desarrollo de elevado potencial.
REFERENCIAS
- 1.- Keller S, Ridinger J, Rupp AK, Janssen JW, Altevogt P. Body fluid derived exosomes as a novel template for clinical diagnostics. J Transl Med. 2011;9:86.
2.- Pan BT, Johnstone RM. Fate of the transferrin receptor during maturation of sheep reticulocytes in vitro: selective externalization of the receptor. Cell. 1983;33(3):967-978.
3.- Johnstone RM. The Jeanne Manery-Fisher Memorial Lecture 1991. Maturation of reticulocytes: formation of exosomes as a mechanism for shedding membrane proteins. Biochem Cell Biol. 1992;70(3-4):179-90.
4.- Raposo G, Nijman HW, Stoorvogel W, Liejendekker R, Harding CV, Melief CJ, Geuze HJ. B lymphocytes secrete antigen-presenting vesicles. J Exp Med. 1996;183(3):1161-1172.
5.- Jenjaroenpun P, Kremenska Y, Nair VM, Kremenskoy M, Joseph B, Kurochkin IV. Characterization of RNA in exosomes secreted by human breast cancer cell lines using next-generation sequencing. PeerJ. 2013;1:e201.
6.- Matsumoto Y, Kano M, Akutsu Y, Hanari N, Hoshino I, Murakami K, et al. Quantification of plasma exosome is a potential prognostic marker for esophageal squamous cell carcinoma. Oncol Rep. 2016;36(5):2535-2543.
7.- Raposo G1, Stoorvogel W. Extracellular vesicles: exosomes, microvesicles, and friends. J Cell Biol. 2013;200(4):373-383.
8.- Booth AM, Fang Y, Fallon JK, Yang JM, Hildreth JE, Gould SJ. Exosomes and HIV Gag bud from endosome-like domains of the T cell plasma membrane. J Cell Biol. 2006;172(6):923-935.
9.- Lee Y, El Andaloussi S, Wood MJ. Exosomes and microvesicles: extracellular vesicles for genetic information transfer and gene therapy. Hum Mol Genet. 2012;21(R1):R125-134.
10.- Baietti MF, Zhang Z, Mortier E, Melchior A, Degeest G, Geeraerts A, Ivarsson Y, Depoortere F, Coomans C, Vermeiren E, Zimmermann P, David G. Syndecan-syntenin-ALIX regulates the biogenesis of exosomes. Nat Cell Biol. 2012;14(7):677-685.
11.- Roucourt B, Meeussen S, Bao J, Zimmermann P, David G. Heparanase activates the syndecan-syntenin-ALIX exosome pathway. Cell Res. 2015;25(4):412-28.
12.- Ostrowski M, Carmo NB, Krumeich S, Fanget I, Raposo G, Savina A, et al. Rab27a and Rab27b control different steps of the exosome secretion pathway. Nat Cell Biol. 2010;12(1):19-30; sup pp 1-13.
13.- Stenmark H. Rab GTPases as coordinators of vesicle traffic. Nat Rev Mol Cell Biol. 2009;10(8):513-525
14.- Parolini I, Federici C, Raggi C, Lugini L, Palleschi S, De Milito A, Coscia C, Iessi E, Logozzi M, Molinari A, Colone M, Tatti M, Sargiacomo M, Fais S. Microenvironmental pH is a key factor for exosome traffic in tumor cells. J Biol Chem. 2009;284(49):34211-34222.
15.- Brouwers JF, Aalberts M, Jansen JW, van Niel G, Wauben MH, Stout TA, Helms JB, Stoorvogel W. Distinct lipid compositions of two types of human prostasomes. Proteomics. 2013;13(10-11):1660-1666
16.- Kalluri R. The biology and function of exosomes in cancer. J Clin Invest. 2016;126(4):1208-15.
17.- Zhang HG, Grizzle WE. Exosomes: a novel pathway of local and distant intercellular communication that facilitates the growth and metastasis of neoplastic lesions. Am J Pathol. 2014;184(1):28-41.
18.- Hemler ME. Tetraspanin proteins mediate cellular penetration, invasion, and fusion events and define a novel type of membrane microdomain. Annu Rev Cell Dev Biol. 2003;19:397-422.
19.- Subramanian A, Gupta V, Sarkar S, Maity G, Banerjee S, Ghosh A, Harris L, Christenson LK, Hung W, Bansal A, Banerjee SK. Exosomes in carcinogenesis: molecular palkis carry signals for the regulation of cancer progression and metastasis. J Cell Commun Signal. 2016;10(3):241-249.
20.- Ratajczak J1, Wysoczynski M, Hayek F, Janowska-Wieczorek A, Ratajczak MZ. Membrane-derived microvesicles: important and underappreciated mediators of cell-to-cell communication. Leukemia. 2006;20(9):1487-1495.
21.- Valadi H, Ekström K, Bossios A, Sjöstrand M, Lee JJ, Lötvall JO. Exosome-mediated transfer of mRNAs and microRNAs is a novel mechanism of genetic exchange between cells. Nat Cell Biol. 2007;9(6):654-659.
22.- Kim MS, Haney MJ, Zhao Y, Mahajan V, Deygen I, Klyachko NL, Inskoe E, Piroyan A, Sokolsky M, Okolie O, Hingtgen SD, Kabanov AV, Batrakova EV. Development of exosome-encapsulated paclitaxel to overcome MDR in cancer cells. Nanomedicine. 2016;12(3):655-664.
23.- Im H, Shao H, Weissleder R, Castro CM, Lee H. Nano-plasmonic exosome diagnostics. Expert Rev Mol Diagn. 2015;15(6):725-733
24.- Wu Z, Zeng Q, Cao K, Sun Y. Exosomes: small vesicles with big roles in hepatocellular carcinoma. Oncotarget. 2016;7(37):60687-60697.
25.- Harding CV, Heuser JE, Stahl PD. Exosomes: looking back three decades and into the future. J Cell Biol. 2013;200(4):367-371.
26.- Wang J, Sun X, Zhao J, Yang Y, Cai X, Xu J, Cao P. Exosomes: A Novel Strategy for Treatment and Prevention of Diseases. Front Pharmacol. 2017;8:300
27.- Peng P, Yan Y, Keng S. Exosomes in the ascites of ovarian cancer patients: origin and effects on anti-tumor immunity. Oncol Rep. 2011;25(3):749-762.
28.- Melo SA, Luecke LB, Kahlert C, Fernandez AF, Gammon ST, Kaye J, LeBleu VS, Mittendorf EA, Weitz J, Rahbari N, Reissfelder C, Pilarsky C, Fraga MF, Piwnica-Worms D, Kalluri R. Glypican-1 identifies cancer exosomes and detects early pancreatic cancer. Nature. 2015;523(7559):177-182.
29.- Cui H, Seubert B, Stahl E, Dietz H, Reuning U, Moreno-Leon L, Ilie M, Hofman P, Nagase H, Mari B, Krüger A. Tissue inhibitor of metalloproteinases-1 induces a pro-tumourigenic increase of miR-210 in lung adenocarcinoma cells and their exosomes. Oncogene. 2015;34(28):3640-3650
30.- Silva A, Bullock M, Calin G.. The Clinical Relevance of Long Non-Coding RNAs in Cancer. Cancers (Basel). 2015;7(4):2169-2182
31.- Logozzi M, De Milito A, Lugini L, Borghi M, Calabrò L, Spada M, et al. High levels of exosomes expressing CD63 and caveolin-1 in plasma of melanoma patients. PLoS One. 2009;4(4):e5219.
32.- Hoshino A, Costa-Silva B, Shen TL, Rodrigues G, Hashimoto A, Tesic Mark M, et al. Tumour exosome integrins determine organotropic metastasis. Nature. 2015;527(7578):329-335.
33.- Sohn W, Kim J, Kang SH, Yang SR, Cho JY, Cho HC, Shim SG, Paik YH. Serum exosomal microRNAs as novel biomarkers for hepatocellular carcinoma. Exp Mol Med. 2015; 47:e184
34.- Wang H, Hou L, Li A, Duan Y, Gao H, Song X.. Expression of serum exosomal microRNA-21 in human hepatocellular carcinoma. Biomed Res Int. 2014;2014:864894.
CORRESPONDENCIA:
Dra. Patricia Saiz-Lopez
Servicio de Anatomía Patológica.
Hospital Universitario de Burgos.
Islas Baleares 3
09006, Burgos. España
Mail: saizpa @ hubu.es
Comentario del revisor Dr. David Ontoso Picon, MD. PhD. Biología Molecular. Memorial Sloan Kettering Cancer Center, Nueva York. USA.
Los autores elaboran una acertada introducción sobre la complejidad de los exosomas como mensajeros intercelulares, tanto en situaciones fisiológicas, como tumorales. Para a continuación remarcar el tremendo potencial clínico que el empleo de exosomas supone tanto en diagnóstico, como en la elaboración de tratamientos farmacológicos punteros que superan las limitaciones tradicionales.
Comentario del revisor Prof. Carlos I. Lorda Diez, PhD. Departamento de Anatomía y Biología Celular, Facultad de Medicina, Universidad de Cantabria - IDIVAL. España.
La revisión presentada por los autores incide en la importancia del análisis de exosomas en Biomedicina, ya que su contenido puede ofrecer mucha información en condiciones fisiopatológicas.
Actualmente, la comunidad científica presta cada vez una mayor atención a estos elementos, tanto para estudiar sus funciones como para entender las formas en las que se pueden utilizar en diagnósticos y tratamientos.
