Indice del volumen
Volume index
Comité Editorial
Editorial Board
Comité Científico
Scientific Committee
- MARCADORES HISTOLÓGICOS
Actualmente parece claro que el tamaño, dentro de este subgrupo de enfermas sin afectación axilar, va a determinar una mejor o peor supervivencia según los resultados del Instituto Nacional del Cáncer de Bhetesda (EE UU). También los grados histológicos y nucleares del tumor van a ser otro factor pronóstico que nos indique las enfermas de mayor o menor riesgo de recidivar, siendo muy útiles cualquiera de los dos sistemas empleados, el de Scarff-Bloom-Richardson más utilizado en Europa y el de Fisher de la NASBP, aunque estas determinaciones son muy subjetivas y poco reproducibles2,35,48,88. - RECEPTORES DE HORMONAS ESTEROIDEAS
El estado de los receptores de hormonas esteroideas ha sido uno de los factores más estudiados como índice pronóstico en pacientes con axila negativa, así Knight constató que la ausencia de receptores de estrógenos (RE) estaba asociada a una rápida recurrencia de enfermedad, siendo un factor pronóstico independiente de otras variables histológicas. No obstante en estudios posteriores con un gran número de pacientes y largos periodos de seguimiento, se admite que el beneficio del RE positivo es sólo en cortos periodos de tiempo, 2-3 años, llegándose a un mismo índice de supervivencia al cabo de los 10 años. Otros estudios encuentran que el beneficio del RE positivo está reducido a ciertos subgrupos de pacientes, así Thorpe89, en estas pacientes sin ganglios axilares invadidos, no obtiene un intervalo libre de enfermedad significativamente superior de RE positivas respecto a las RE negativas, pero clasificándolas por su estatus menopáusico encuentra que RE positiva es un índice de buen pronóstico en pacientes premenopáusicas, no existiendo significación en peri o postmenopáusicas. Sin embargo, en pacientes con ganglios axilares invadidos, RE negativo era un significativo marcador de alto riesgo en pacientes postmenopáusicas.En otro amplio estudio McGuire90, observa que pacientes en estadio I, el tamaño del tumor y RE eran los dos índices pronósticos más importantes respecto al intervalo libre de enfermedad y supervivencia total. Mientras que pacientes en estadio II la presencia de receptores de progesterona (RP) era un mejor índice pronóstico que RE para predecir el intervalo libre de enfermedad.
Actualmente se empiezan a distinguir subgrupos de pacientes dentro de RE positivo/RP positivo, que explican su peor pronóstico, las cuales se caracterizan por no expresar la proteína pS2 y ser tumores receptores de andrógenos negativos.
En definitiva en este momento existe una gran controversia sobre la precisa contribución de los receptores de hormonas esteroideas como factor pronóstico en cáncer de mama, una posible explicación de los diferentes resultados obtenidos, puede ser el pequeño número de pacientes empleados en algunos estudios, los diferentes tiempos de seguimiento de estos pacientes y sobre todo las diferentes metodologías utilizadas para cuantificar estos receptores. La técnica de cuantificación basada en radioligandos de estradiol y progesterona ha sido sustituida por un inmunoensayo (bioquímico e histoquímico) que ha dado lugar a minimizar y uniformizar la variabilidad que existía en este ensayo, así los datos preliminares indican que RE determinados por inmunoensayos pueden tener un valor pronóstico significativo de supervivencia después de 5 años de seguimiento, mientras que los datos obtenidos por la técnica de radioligandos no lo son.
- ESTUDIO DE DNA
Últimamente, han aparecido otros factores que parecen tener utilidad para determinar los diferentes subgrupos de riesgo, algunos de ellos ya conocidos de tiempo atrás y que nos indican la actividad mitótica celular, como es el índice de marcado (labeling Index), pero que gracias a las nuevas técnicas resulta más fácil su medición, como es la determinación de DNA celular y la fracción de células que se encuentran en la fase de síntesis, gracias a procedimientos como la citometría de flujo. Los tumores con DNA aneuploides tienen peor pronóstico en relación a los tumores euploides, estos datos permiten sugerir que las neoformaciones diploides o aneuploides reflejan diferencias en el grado de estabilidad genómica, siendo ésta mayor en los aneuploides, lo cual puede llevar a una generación rápida de nuevos fenotipos, prerrequisito para una rápida progresión del tumor85-87,90. - PROTEASAS
Hay evidencias no directas de cánceres inducidos en animales que sugieren que ciertas proteasas están involucradas en la invasión cancerosa y metástasis, actuando como mitógenos y degradando la matriz extracelular. Las proteasas implicadas en estos procesos incluyen activadores del plasminógeno, catepsina y colagenasa IV. Existen evidencias que sugieren que altas concentraciones de estas proteasas se correlacionan igualmente en tumores mamarios humanos con un peor pronóstico de las enfermas43,67,91.El activador del plasminógeno es una proteasa que puede existir en dos formas conocidas como tipo tisular y tipo urokinasa. Mientras que los niveles elevados de la primera forma se correlacionan con un buen pronóstico, las concentraciones elevadas del tipo-urokinasa son un marcador de agresividad del carcinoma mamario con un corto intervalo libre de enfermedad.
De todas estas proteasas destaca la proteína de 52 kd, a la que aluden Rochefort y cols92, en células tumorales mamarias estrógeno dependientes y que se ha identificado como catepsina D lisosomal. Se sintetiza como un precursor de 52 kd para pasar a la forma 48 kd y posteriormente escindirse en dos moléculas de 14 y 34 kd. Su acción mitógena se ejerce merced a la presencia de receptores manosa 6-fosfato, existiendo una correlación con la proliferación de conductos mamarios, parece ser capaz de facilitar la digestión de la membrana basal, tejido conectivo y matriz extracelular y por tanto facilitar la intravasación de células tumorales en el torrente sanguíneo. La mayor capacidad intrínseca de ciertos tumores de mama para secretarla dará a estos una mayor posibilidad de producir metástasis por vía hemática y por lo tanto un peor pronóstico. Tandon93 demuestra que en pacientes sin adenopatías ganglionares positivas es un factor pronóstico dependiente de la supervivencia global e intervalo libre de enfermedad, estando directamente correlacionados altos niveles de catepsina D con tumores aneuploides, mientras que no encuentra correlación con RE, RP, tamaño del tumor o edad de la paciente.
Por lo tanto, aunque tenemos numerosos factores que pueden indicarnos la menor o mayor agresividad de los cánceres sin afectación axilar, ninguno parece de suficiente importancia para decidir la indicación de tratamiento sistémico, y se deben valorar en conjunto y sólo cuando la probabilidad de recidiva sea alta estas enfermas se beneficiaran del tratamiento y asumiremos los efectos colaterales de los tratamientos.
Estamos sólo al comienzo para poder clasificar diferentes subgrupos de riesgo en enfermas con CM para tratar a los grupos de peor pronóstico de una forma más intensiva y proteger a las enfermas de buen pronóstico de las toxicidades agudas y sobre todo tardías de las terapéuticas sistémicas. Hay que ver en ensayos clínicos más amplios la utilidad de estos marcadores e investigar nuevos factores que nos den más información sobre el pronóstico del tumor maligno que causa más muertes en la mujer.
- RECEPTOR DEL FACTOR DE CRECIMIENTO EPIDÉRMICO
Además, otro marcador que puede ser empleado como índice pronóstico es el receptor del factor de crecimiento epidérmico (EGFR) el cual media la acción de los factores de crecimiento (EGF) y factor transformador del crecimiento (TGF), estando localizado en la membrana celular9,10,41,94, 95. La concentración de EGFR guarda una relación inversa con los receptores de estrógenos y directa con el grado histológico en pacientes con ganglios axilares positivos mientras que cuando estos no están invadidos la correlación es inversa con los receptores de progesterona, siendo un indicador de recidiva precoz. Igualmente el estatus del EGFR es un criterio válido para subdividir a los tumores RE negativo, independientemente del factor axilar, con un mayor intervalo libre de enfermedad y supervivencia cuando resulta negativo. - ONCOGENES
La importancia de ciertos oncogenes en la conducta tumoral está siendo resaltada últimamente, destacando la correlación existente entre la amplificación del oncogén Her-2/neu, de la familia de los c-erb, con un mayor índice de recidivas y menor tiempo de supervivencia, considerando que es un índice pronóstico independiente y equivalente al número de adenopatías axilares positivas. Igualmente la detección de productos oncogénicos circulantes ha podido realizarse en los últimos años merced a su caracterización bioquímica y al empleo de anticuerpos monoclonales, Mayes91 observó la utilidad de la proteína 185 codificada por el oncogén neu y definida por los monoclonales TA 1 y NB 3, para la detección de recidivas locales y metástasis hepáticas de carcinoma mamario.Otros oncogenes también pueden ser usados como marcadores pronósticos, Algunos autores92 muestran que la amplificación del oncogén ras, se correlaciona con una alta probabilidad de sufrir enfermedad recurrente rápida. La agresividad de tumores de mama se asocia con la amplificación de los oncogenes int-2 y c-myc.
- MARCADOR HER2/NEU
Los marcadores biológicos utilizados con fines pronósticos o predictivos son de gran importancia y utilidad. El grado histológico, el tamaño tumoral y la positividad de receptores de estrógenos, son marcadores pronósticos utilizados universalmente, que condicionan el tipo de tratamiento empleado. Sin embargo, es de gran utilidad el desarrollo de marcadores moleculares que identifiquen la mejor o peor respuesta de los tumores a los posibles tratamientos quimioterápicos, hormonales con radioterapia, así como la predicción de aparición de recaídas. Entre este grupo de marcadores, se encuentra el c-erbB-2 o Her2/neu88-90.El gen Her2/neu codifica para una proteína de peso molecular 185 KDa, denominada p185, relacionada con las funciones de crecimiento que se expresa en las células epiteliales tumorales. Tiene tres dominios, uno citoplasmático con reactividad tirosinquinasa, que codifica una proteína o dominio transmembrana, y un dominio extracelular. Este último es el que interacciona con los factores de crecimiento y otros dominios extracelulares de la familia HER-1, HER-3 y HER-493-99
En células normales, se expresan dos copias del gen Her2/neu, mientras que en las células tumorales se produce una amplificación del gen, con aumento del número de copias, aumento en la transcripción del RNA mensajero y aumento en la codificación de proteínas.
La sobreexpresión del Her2/neu se asocia con cánceres de mama de crecimiento más rápido, más agresivos y con mayor probabilidad de recaídas postratamiento96-101.
FACTORES PRONOSTICOS DEL CANCER DE MAMA Y ONCOGEN HER2/NEU
A. San Miguel, I. Gonzalez Blanco*, R. García Iglesias, N. Alonso, A.B. Rodríguez Bujez*, E.M. Martin Medrano*, F.J. Martín Gil.
Servicio de Análisis Clínicos y *Obstetricia y Ginecología.
Hospital Universitario Rio Hortega. Valladolid. España
asanmiguel @ hurh.sacyl.es
Rev Electron Biomed / Electron J Biomed 2006;2:72-88.
Comentario del revisor Prof. Francisco Abad Santos MD. PhD. Servicio de Farmacología Clínica. Hospital la Princesa. Departamento de Farmacología y Terapéutica de la Facultad de Medicina. Universidad Autónoma de Madrid. España
Comentario del revisor María Jesús Coma del Corral MD. PhD. Unidad de Investigación. Hospital General Yagüe. Burgos. España
ABSTRACT: PRONOSTIC FACTORS OF BREAST CANCER AND HER2/NEU
The breast cancer constitutes the main cause of death by cancer in women of our country. In spite of the efforts directed in campaigns of precocious detection, the incidence continues increasing in a 1% approximately per year and the rate of mortality stay constant. Therefore it is of great importance to consolidate efforts directed towards the development and use of therapeutic and diagnostic methods. The development of neoplasia is directly related to successive genetic mutations in which cellular oncogenes are involved.
It is known that in case of breast cancer the Her2/neu oncogene (Human epidermal growth receptor-2 factor) is amplified and/or overexpressed in approximately a 30% of the cases. The knowledge of a positive result for Her2/neu overexpression has an important value in prognosis as it is associated to a greater aggressiveness of the disease. Also, this gene can be an answer marker to certain treatments like trastuzumab.
Keywords:Breast cancer, Her2/neu, c-erbB-2, Human Epidermal Growth Factor Receptor-2.
RESUMEN:
El cáncer de mama (CM) constituye la principal causa de muerte por cáncer en mujeres de nuestro país. A pesar de los esfuerzos dirigidos hacia las campañas de detección precoz, la incidencia sigue aumentando aproximadamente en un 1% por año y la tasa de mortalidad sigue manteniéndose constante.
Es por ello de gran importancia aunar esfuerzos dirigidos al desarrollo y utilización de métodos diagnósticos y terapéuticos. El desarrollo de una neoplasia está directamente relacionado con mutaciones genéticas sucesivas en las que están involucrados oncogenes celulares.
En el caso del cáncer de mama se sabe que el encogen Her2/neu (Human epidermal growth factor receptor-2) está amplificado y/o sobreexpresado en aproximadamente un 30% de los casos. El conocimiento de la positividad del mismo tiene un importante valor pronóstico asociándose a una mayor agresividad de la enfermedad. Así mismo dicho gen puede ser un marcador predictivo de respuesta a determinados tratamientos como el trastuzumab.
Palabras clave: Cáncer de mama, her2/neu, c-erbB-2.
INTRODUCCIÓN
El cáncer de mama constituye la principal causa de muerte por cáncer en las mujeres de nuestro país. A pesar de los esfuerzos dirigidos hacia las campañas de detección precoz, la incidencia sigue aumentando aproximadamente en un 1% por año1-9. Por ello de gran importancia aunar esfuerzos dirigidos al desarrollo y utilización de métodos diagnósticos y terapéuticos10-16.
El oncogén Her-2/neu (Human epidermal growth factor receptor-2) codifica una proteína con un peso molecular de 185.000 daltons. Este oncogen pertenece a la familia de receptores celulares de superficie con actividad intracelular tirosin-kinasa y está estructuralmente relacionado con el Factor de Crecimiento Epidérmico (erbB-1).
La oncoproteína HER-2/neu está compuesta por un dominio citoplasmático, un dominio transmembranoso y un dominio extracelular. Desde mediados de los años 80, el papel del oncogén HER-2/neu y su proteína ha adquirido importancia en el desarrollo de metástasis en el cáncer de mama.
El dominio extracelular es un glicoproteína, usualmente llamada p105, con un peso molecular entre 97 y 115 kilodalton, que está elevado en mujeres con cáncer de mama metastásico. Además, numerosos informes muestran que la proteína de HER-2/neu es un test diferente de los tradicionales marcadores tumorales como el Ca15.3. El marcador tradicional mide la presencia de proteínas de alto peso molecular e indica crecimiento o decrecimiento de la carga tumoral. No hay evidencia que estas glicoproteínas participen en la conversión de células normales en cancerosas. La oncoproteína HER-2/neu se deriva de un oncogen conocido que está biológicamente relacionado con la conversión de células normales en tumorales.
El desarrollo de una neoplasia está directamente relacionado con mutaciones genéticas sucesivas en las que están involucrados oncogenes celulares17-25. En el caso del cáncer de mama se sabe que el encogen Her2/neu está amplificado y/o sobreexpresado en aproximadamente un 30% de los casos. El conocimiento de la positividad del mismo tiene un importante valor pronóstico asociándose a una mayor agresividad de la enfermedad. Así mismo dicho gen puede ser un marcador predictivo de respuesta a determinados tratamientos como el trastuzumab (Herceptin®)26-39.
GENERALIDADES DEL CANCER DE MAMA
El desarrollo de un CM, se produce durante un periodo preclínico largo que incluso puede ser superior a 10 años. Lo primero que se produce es un periodo preneoplásico o hiperplasia atípica. Dicha hiperplasia puede progresar a un estado neoplásico o carcinoma "in situ", el cual en algunos casos puede dar lugar a un carcinoma invasivo que tiene capacidad de extenderse a los nódulos linfáticos y a otras partes del cuerpo35-39.
Clasificación TNM del Cáncer de Mama
Con el creciente empleo de la inmunohistoquímica (IHQ), y los progresos en las técnicas de biología molecular40-49, los anatomopatólogos son capaces de detectar depósitos tumorales muy pequeños, cuya importancia no está clara. En el actual sistema de clasificación, estas lesiones pequeñas o cúmulos de células tumorales serían clasificadas como micrometástasis, con independencia de su tamaño. En la nueva estadificación, se establece una distinción entre micrometástasis y células tumorales aisladas. La micrometástasis en el ganglio axilar van a ser definidas ahora como lesiones metastásicas con un tamaño > de 0,2 mm de diámetro pero < 2 de mm de diámetro, mientras que el concepto de células tumorales aisladas se define como el depósito de células tumorales de < ó = de 0,2 mm de. Los pacientes con células tumorales aisladas serán clasificados como con ganglios negativos. Sin embargo, el nuevo sistema permite diferenciar los pacientes con ganglios negativos con células tumorales aisladas de los que no las tienen, como se describe más adelante en esta revisión. Este sistema especifica también cómo se detectan estas lesiones microscópicas. La tinción con hematoxilina y eosina (H y E) sigue siendo el patrón de referencia para la detección de metástasis ganglionares axilares. El nuevo sistema permite una anotación respecto a si las micrometástasis (o las células tumorales aisladas) han sido detectadas con IHQ o con técnicas moleculares (RT-PCR).
Las consecuencias para el pronóstico de las mujeres con los ganglios positivos en la cadena mamaria interna dependen de la situación de otros ganglios regionales, así como del tamaño de los ganglios. En el nuevo sistema de estadificación, las metástasis de los ganglios de la cadena mamaria se han reclasificado según el método de detección y la extensión de la afectación ganglionar axilar.
El Comité conjunto Norteamericano sobre el Cáncer (AJCC) formó en el año 2002 una comisión de expertos en CM para recomendar modificaciones en la Clasificación TNM, para el desarrollo sobre diagnóstico y tratamiento del CM50. Este nuevo sistema de clasificación en estadios, contempla un nuevo estadio, IIIC, y tendrá un impacto considerable sobre las recomendaciones terapéuticas. Las metástasis de ganglios supraclaviculares se han reclasificado como N3 en lugar de M1. Esta modificación se ha hecho porque hay pruebas de que el tratamiento enérgico de los pacientes con metástasis ganglionares supraclaviculares puede mejorar la supervivencia, eliminando el temor a que la clasificación de la metástasis ganglionar supraclavicular como metástasis a distancia pueda dar lugar a un tratamiento insuficiente. Finalmente, se ha añadido a la nueva clasificación un nuevo estadio IIIC, que incluirá tumores de cualquier tamaño (T) y con cualquier situación ganglionar (incluyendo pN3a, pN3b, y pN3c).
Se señalan como factores de riesgo la existencia de antecedentes familiares con CM, este factor de riesgo adquiere aún mayor relevancia en el caso de hijas de madres que desarrollaran el cáncer antes de la menopausia, si se trata de una neoplasia bilateral en la madre, o si el carcinoma mamario lo desarrollaron la madre y alguna hermana51-69.
Otros factores de riesgo descritos son la menarquia precoz, o el tratarse de mujeres nuligestas, nulíparas o primigestas a edades mayores de 30 años. La exposición repetida del epitelio maduro a radiaciones ionizantes para tratamientos o estudios diagnósticos, aumenta la probabilidad de desarrollo de carcinoma mamario70-75.
En las principales medidas preventivas, se incluyen el cumplimiento de dietas en que no haya elevado consumo de carnes rojas y grasas animales. Asimismo, dietas en que se regula el control de fritos, salsas y lácteos. Es importante llevar un control de peso corporal. Las numerosas campañas de detección precoz y revisiones anuales a partir de los 40 años, incluso en ausencia de síntomas, son fundamentales para posibilitar un diagnóstico temprano de la enfermedad. El mayor riesgo de desarrollar cáncer de mama lo presentan las mujeres mayores de 50 años, siendo las de máximo riesgo las de edades superiores a 75 años44-48, 76-87.
MARCADORES PRONOSTICOS EN CANCER DE MAMA
Los principales marcadores pronósticos que se evalúan actualmente son:
METODOLOGIA ANALITICA PARA LA DETERMINACION DEL HER-2/neu
La presencia de un mayor número de copias del gen en las células tumorales conlleva por tanto a un aumento del RNA mensajero y niveles más elevados de la proteína que codifica. Existen métodos analíticos que tratan de medir la expresión del DNA y de la proteína p185 en muestras de tejido tumoral, y como complemento a los mismos, existen métodos que cuantifican el dominio extracelular del gen en suero100-105.
Los métodos actuales utilizados para la determinación de HER-2/neu son la hibridación in situ por fluorescencia (FISH) y métodos de tinción inmunohistoquímicos (IHQ). La tabla 1, muestra un resumen comparativo entre las diferentes técnicas.
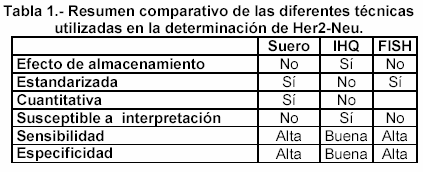
El método en suero, al ser cuantitativo, es una herramienta de monitorización de los cambios de HER-2/neu a lo largo del tiempo. Diversos estudios se han realizado para determinar la concordancia entre métodos séricos y FISH y IHQ. Harris y cols.106 encontraron un 88% de concordancia entre FISH y suero, mientras que Molina y cols.107 encontraron un 81% entre IHQ y suero. El valor clínico de la oncoproteína HER-2/neu ha tomado relevancia en los últimos años desde la introducción de terapias con anticuerpos monoclonales, como trastuzumab (Herceptin), que bloquea el efecto de la proteína. Determinar los valores de partida de HER-2/neu y monitorizar su evolución en el curso de la enfermedad metastásica puede ayudar al manejo del tratamiento y determinar si es apropiado aumentar la intensidad de la terapia o utilizar alguna otra alternativa.
Entre los primeros realizados en muestras de tumor, existen dos tipos de ensayos aprobados por la FDA, el método inmunohistoquímico (IHQ) y el método de hibridación in situ fluorescente (FISH), como ya se ha comentado. Ambas técnicas, permiten preservar la morfología del tumor y por tanto conocer la localización de la activación del gen.
El método inmunohistoquímico mide la sobreexpresión de la proteína utilizando anticuerpos específicos contra los receptores Her2/neu. El análisis de los resultados se realiza de forma semicuantitativa, expresándolos en una escala de 0 a 3+. 0 y 1+ se consideran negativos a efectos de tratamiento clínico. 2+ y 3+ se consideran positivos, sin embargo en 2+ se considera apropiada la confirmación por el método FISH. La técnica de IHQ es una técnica precisa, de fácil realización en los laboratorios de anatomía patológica y no es cara. La mayor dificultad la presenta en el sistema de clasificación2,35,39,43,48.
El método FISH mide la amplificación del gen, indicando el numero de copias presentes. Si dicho número de copias es mayor de 2, el resultado se considera positivo. La técnica FISH es más difícil de realizar y más costosa que la IHQ. Sin embargo la cuantificación es más precisa y relativamente sencilla de realizar104-109.
Las dos técnicas presentan limitaciones in situ debido sobre todo a su variabilidad. Por otra parte, al tratarse de métodos que miden el Her2/neu en tejido tumoral, no serían válidos para el seguimiento de la enfermedad una vez extirpado el tumor primario110-119.
Una vez extirpado el tumor la determinación de Her2/neu tiene una gran utilidad clínica complementaria. La determinación del dominio extracelular del Her2/neu se realiza mediante inmunoensayos tipo ELISA ó de quimioluminiscencia directa. Se trata de métodos sensibles y específicos que miden cuantitativamente el Her2/neu en suero. La FDA aprobó esta determinación sérica para la monitorización de pacientes con cáncer de mama metastático. Niveles séricos en disminución se relacionan con una regresión de la enfermedad y adecuada respuesta al tratamiento. Niveles séricos en aumento son indicativos de no adecuada respuesta al tratamiento o progresión de la enfermedad110-117.
El ensayo ADVIA Centaur HER-2/neu es un inmunoensayo tipo sándwich que utiliza la tecnología de quimioluminiscencia directa. El reactivo está compuesto por un anticuerpo monoclonal de ratón, TA1 marcado con ester de acridinio. El reactivo conjugado de fluoresceina está compuesto por un anticuerpo monoclonal de ratón, NB3 marcado con fluoresceína. Estos dos anticuerpos monoclonales son específicos para epitopos únicos del dominio extracelular de HER-2/neu. La fase sólida está compuesta por un anticuerpo monoclonal de captura de ratón, unido covalentemente a partículas magnéticas. La muestra se incuba con reactivo conjugado de fluoresceína y reactivo Lite simultáneamente 5,5 minutos. Después de esta incubación, se añade la fase sólida y se incuba 2,75 minutos, Finalmente, el inmunocomplejo formado se lava con agua antes del inicio de la reacción quimioluminiscente.
Las determinaciones de niveles séricos no reemplazan a los métodos FISH o IHQ, sino, que en la actualidad son complementarios. Sin embargo, se trata de técnicas que presentan la ventaja de no ser invasivas, y de permitir obtener resultados de la evolución en tiempo real. La monitorización de niveles séricos es por ello de gran utilidad en el seguimiento de la enfermedad y en la evaluación de su pronóstico118-124.
También conocemos después de largos años de seguimiento, que las enfermas con mejor pronóstico, es decir aquellas que tras la cirugía no se objetiva enfermedad ganglionar en el estudio histológico de la axila, trascurridos 10-15 años, un 30% de estas enfermas "favorables" van a recidivar y en último término morir a causa de su CM. Esto ha incitado a diferentes grupos a tratar sistemáticamente también a estas enfermas para intentar mejorar las tasas de curaciones, aunque actualmente existen opiniones encontradas y se están buscando nuevos factores pronósticos en estas enfermas para tratar sólo a aquellas que se puedan beneficiar del tratamiento sistémico.
CONCLUSIONES
El carcinoma de mama es el tumor más frecuente en la mujer de los países occidentales, oscilando su incidencia entre 50-80 casos cada 100.000 mujeres, y representando casi la tercera parte del cáncer femenino. Si a esto añadimos la alta tasa de mortalidad y la escasa variación de la supervivencia en las enfermas que lo padecen durante los últimos años, está más que justificado el problema social que ésta enfermedad representa en la actualidad.
Una vez establecido el diagnóstico de carcinoma mamario y extirpado el tumor, es fundamental establecer el pronóstico de la enfermedad, puesto que de ello va a depender la terapia sistémica a utilizar. Tradicionalmente los principales factores pronósticos han sido variables histológicas, siendo conocido sobradamente que el papel pronóstico más importante es el tamaño tumoral y su relación directa con la infiltración, o no, de los ganglios axilares e incluso el mayor o menor número de ellos afectados. También sabemos que después de muchos años de seguimiento, las enfermas con mejor pronóstico, es decir aquellas que tras la cirugía no se objetiva enfermedad ganglionar en el estudio histológico de la axila, trascurridos 10-15 años, un 30% de estas enfermas "favorables" van a recidivar.
Por lo tanto, la monitorización de niveles séricos de Her-2neu, no reemplaza a los métodos FISH o IHQ, sino que son complementarios. Y además, se trata de técnicas que presentan la ventaja de no ser invasivas, y de permitir obtener resultados de la evolución en tiempo real, por lo que es de gran utilidad en el seguimiento de la enfermedad y en la evaluación del pronóstico de las pacientes.
REFERENCIAS
-
1. Hanna W, Kahn HJ, Trudeau M. Evaluation of HER-2/neu (erbB-2) status in breast cancer: from bench to bedside. Mod Pathol. 1999; 12: 827-34.
2. Thomson TA, Hayes MM, Spinelli JJ, Hilland E, Sawrenko C, Phillips D, Dupuis B, Parker RL. HER-2/neu in breast cancer: interobserver variability and performance of immunohistochemistry with 4 antibodies compared with fluorescent in situ hybridization. Mod Pathol. 2001;14: 1079-1086.
3. Baselga J. Herceptin alone or in combination with chemotherapy in the treatment of HER2-positive metastatic breast cancer: pivotal trials. Oncology 2001; 61 Suppl 2: 14-21
4. Hanna WM, Kahn HJ, Pienkowska M, Blondal J, Seth A, Marks A. Defining a test for HER-2/neu evaluation in breast cancer in the diagnostic setting. Mod Pathol. 2001; 14: 677-85.
5. Ridolfi RL, Jamehdor MR, Arber JM. HER-2/neu testing in breast carcinoma: a combined immunohistochemical and fluorescence in situ hybridization approach. Mod Pathol. 2000; 13: 866-873.
6. Xu R, Perle MA, Inghirami G, Chan W, Delgado Y, Feiner H. Amplification of Her-2/neu Gene in Her-2/neu-Overexpressing and -Nonexpressing Breast Carcinomas and Their Synchronous Benign, Premalignant, and Metastatic Lesions Detected by FISH in Archival Material. Mod Pathol. 2002; 15: 116-24.
7. Yung MCH, Lau YK. Basic science of HER-2/neu: a review. Semin Oncol 1999; 26: 51-59
8. Slamon DJ, Clark GM, Wong SG et al. Human breast cancer: Correlation of relapse and survival with amplification of the HER-2 neu oncogene. Science 1987; 235:177-182
9. Yamamoto T, Ikawa S, Akiyama T et al. Similarity of protein coded by the c-human erb B-2 gene to epidermal growth factor receptor. Nature 1986; 319: 230-234
10. Bargmann CI, Hung MC, Weinberg RA. The neu oncogene encodes an epidermal growth factor receptor-related protein. Nature 1986; 319: 226-230
11. Slamon DJ, ClarK GM, Wong SG, Levin WJ, Ullrich A, McGuire WL. Human breast cancer: correlation of relapse and survival with amplification of the HER-2 oncogene. Science 1987; 235: 177-181.
12. Jacobs TW, Gown AM, Yaziji H, Barnes MJ, Schnitt SJ. Comparison of fluorescence in situ hybridization and immunohistochemistry form the evaluation of HER-2/neu in breast cancer. J Clin Oncol 1999; 17: 1974-1982.
13. Kaptain S, Tan LK, Chen B. Her-2/neu and breast cancer. Diagn Mol Pathol 2001; 10: 139-152.
25. Borg A, Baldetorp B, Ferno M, Killander D, Olsson H, Ryden, Sigurdsson H. ERBB2 amplification is associated with tamoxifen resistance in steroid-receptor-positive breast cancer. Cancer Lett 1994; 81: 137-144.
14. College of American Pathologists Consensus Statement 1999. Prognostic factors in breast cancer. Arch Pathol Lab Med July 2000, July Vol 124:966-978
15.Tavasoli FA. General considerations. In: Tavbasoli FA (ed). Pathology of rhe breast, Norwalk, Applenton & Lange 1992, 2: 25-62.
16. Andersen J, Thorpe SM, King WJ, Rose C; Christensen I, Rasmussen BB, Poulsen HS. The prognostic value of immunohistochemical estrogen receptor analysis in paraffin-embedded and frozen sections versus that of steroid-binding assays . Eur J Cancer 1990; 26: 442-449.
17. Devi KR, Kuruvila S, Musa MM. Pathological prognostic factors in breast carcinoma. Saudi Med J 2000; 21: 372-375.
18. Thomas A.Thomson, Malcolm M. Hayes, John J. Spinelli, Ernie Hilland, et al. HER-2/neu in breast cancer: interobserver variability and performance of immunohistochemistry with 4 antibodies compared with fluorescent in situ hybridization. Mod Pathol 2001; 14: 1079-1086.
19. Tubbs RR, Pettay JD, Roche PC, Stoler MH, Jenkins RB, Grogan TM. Discrepancies in laboratory testing of eligibility for Trastuzumab therapy: apparent immunohistochemical false-positives do not get the message. J Clin Oncol 2001; 19: 2714-2721.
20. Ridolfi RL, Jamehdor MR, Arber JM. HER-2/neu testing in breast carcinoma: a combined immunohistochemical and fluorescence in situ hybridization approach. Mod Pathol 2000; 13: 866-873.
21. Dowsett M, Cooke T, Ellis I, Gullick WJ, Gusterson B, Mallon E, et al. Assessment of HER2 status in breast cancer: why, when and how? Eur J Cancer 2000; 36:170-176.
22. Hanna W, Kahn HJ, Trudeau M. Evaluation of HER-2/neu (c-erbB-2) status in breast cancer: from bench to besides. Mod Pathol 1999; 12: 827-34.
23. Vogel CL, Cobleigh MA, Tripathy D, Gutheil JC, Harris LN, Fehrenbacher L, et al. Efficacy and safety of trastuzumab as a single agent in first-line treatment of HER2-overexpressing metastatic breast cancer. J Clin Oncol 2002; 20: 719-726.
24. Cobleigh MA, Vogel CL, Tripathy D, Robert NJ, Scholl S, Fehrenbacher L, et al. Multinational study of the efficacy and safety of humanized anti-HER2 monoclonal antibody in women who have HER2-overexpressing metastatic breast cancer that has progressed after chemotherapy for metastatic disease. J Clin Oncol 1999. 17: 639-48.
25. Lal P, Salazar PA, Ladanyi M, Chen B. Impact of Polysomy 17 on HER-2/neu immunohistochemistry in breast carcinomas without HER-2/neu gene amplification. Mol Diagn 2003. 5: 155-159.
26. Bilous M, Dowsett M, Hanna W, Isola J, Lebeau A, Moreno A, et al. Current perspectives on HER-2 testing: A review of National Testing Guidelines. Mod Pathol 2003. 16: 173-182.
27. Pinto AE, Andre S, Pereira T, Nobrega S, Soares J. C-erB-2 oncoprotein overesxpression identifies a subgroup of strogen receptor positive (ER +) breast cancer patients with poor prognosis. Ann Oncol 2001; 12(4): 525-533.
28. González-Vela MC, Garijo MF, Fernández F, Val-Bernal JF. MIB1 proliferation index in breast infiltrating carcinoma comparison with other proliferative markers and assotiation with new biological prognostic factors. Histol Histopathol 2001; 16: 399-406.
29. Taylor CR, Cote RJ. Immunomicroscopy: A diagnostic tool for the surgical pathologist. Phildelphia, WB Saunders Company, 2nd ed. 1994.
30. Smith I, Dowsett M, on behalf of the IMPACT, Royal Marsden Hospital, United Kingdom. In Comparison of anastrazole vs tamoxifen alone and in combination as neoadjuvant treatment of estrogen receptor positive ( ER+ ) operable breast cancer in postmenopausal women: the IMPACT trial. In Lippman ME (ed.) 82. 26th Annual San Antonio Breast Cancer Symposium S6, 2003, (Abstr. 1).
31. Hilf R, Feldstein ML, Savlov ED, Gibson SL, Seneca B. The lack of relationship between estrogen receptor status and response to to chemotherapy. Cancer 1980, 46: 2797-2800.
32. Slamon D, Clark GM, Wong SG, Levin WJ, Ullrich A, McGuire WL. Human breast cancer: Correlation of relapse and survival with amplification of the HER-2/neu oncogene. Science 1987, 235: 177-182.
33. Sutterlin MW, Haller A, Gassel AM, Peters K, Caffier H, Dietl J. The correlation on c-erbB-2 oncoprotein and stablished prognostic factors in human breast cancer. Anticancer Res 2000 Nov; 20 (6D): 5083-5088.
34. Wittliff JL. Steroid hormone receptors in breast cancer. Cancer 1984, 53: 630-643.
35. Pauletti G, Dandekar S, Rong H, Ramos L, Peng H, Seshadri R, Slamon DJ. Assesment of methods for tissue based detection of the Her-2/neu alteration in human breast cancer: a direct comparison of fluorescence in situ hybridization and immunohistochemistry. J Clin Oncol 2000, 18: 3651-3664.
36. Bracko M, Us-Krasovec M, Cufer T, Lamovec J, Zidar A, Goehde W. Prognostic significance of DNA ploidy determined by high-resolution flow cytometry in breast carcinoma. Anal Quant Cytol Histol 2001; 23: 56-66.
37. Jones BA, Kasi SV, Howe C, Lachman M, et al. "Las diferencias entre Afro-Americanas y blancas en el carcinoma de la mama." Cancer, September 15, 2004; 101:1293-1301.
38. Maass N, Hojo T, Rosel F, Ikeda T, Jonat W, Nagasaki K. Down regulation of the tumor suppressor gene maspin in breast carcinoma is associated with a higher risk of distant metastasis. Clin Biochem 2001 Jun; 34(4): 303-307.
39.Ceccarelli C, Santini D, Chieco P, Lanciotti C, Taffurelli MG, Marrano D. Quantitative p21 (walf-1) / p53 immunohistochemical analysis defines groups of primary invasive breast carcinomas with different prognostic indicators. Int J Cancer 2001; 95(2): 128-134.
40. Rochefor H, Augereau P, Capony F. et al. The 52 K cathepisin-D of breast cancer: Structure, regulation, función and clinical value. In Breast Cancer: Cellular and Molecular Biology (Lippman, M, Dickson R. eds). Bos-ton: Kluwer Acad, 1988: 207-21.
41. Sainsbury J, Farndon J, Needham G. et al.: Epidemial growth-factor receptor status as predictor of early recurrence of death from breast cancer. Lancet, 1987; 1:1398-402.
42. Rodríguez L, Vega B. Reproducibilidad de la sobreexpresion de her-2/neu con el sistema hercep en carcinoma mamario infiltrante. Ginecol Obstet Mex, 2002; 70: 111-113.
43. Korkolis D, Ardavanis A, Yotis J, Kyroudi A, Gorgolis V, Kittas C. HER-2/neu overexpression in breast cancer: an immunohistochemical study including correlations with clinicopathologic parameters, p53 oncoprotein and cathepsin D. Anticancer Res 2001; 21: 2207-2212.
44. Thorpe S, Rose C, Rasmussen B, Mouridsen W, Bayer T, Keiding N. On behalf of the Danish Breast Cancer Cooperative Group: Pronostic value of steroid hormone receptors: multivariante analysis of systemically untreated patients with node negative primary breast cancer. Cancer Res 1988; 47: 6126-33.
45. Duffy M, O'Grady P, Devane Y D. et al. Tissue-type plasminogen activator, a new prognostic marker in breast cancer. Cancer Res., 1988, 48: 1348-9.
46. Trock BJ, Leonessa F, Clarke R. Multidrug resistance in breast cancer: a meta-analysis of MDR1/gp170 expression and its possible functional significance. J.Natl. Cancer Inst. 1997; 89: 917-931.
47.Ghellal A, Li C, Hayes M, Byrne G, Bundred N, Kumar S. Prognostic significance of TGF beta 1 and TGF beta 3 in human breast carcinoma. Anticancer Res 2000; 6B: 4413-4418.
48.Xu Y, Kimura N, Yoshida R, Lin H, Yoshinaga K. Immunohistochemical study of Muc1, Muc2 and human gastric mucin in breast carcinoma: Relationship with prognostic factors. Oncol Rep 2001; 8: 1177-1182.
49. Kim HK, Park IA, Heo DS, Choe KJ, Bang YJ, Kim NK. Cyclin overexpression as an independent risk factor of visceral relapse in breast cancer. Eur J Surg Oncol 2001; 27: 464-471.
50. Singletary SE, Allred C, Ashley P, et al. Revision of the American Joint Committee on cancer staging system for breast cancer. J Clin Oncol 2002; 20: 3628-3636
51. Zuang Z, Merino MJ, Chuaqui R, Liotta L, Emmert-Buck MR. Identical allelic loss on Chromosome 11q13 in microdissected in situ and invasive human breast cancer. Cancer Res. 1995, 55: 467-471.
52. Laforga JB, Aranda FI. Angiogenic Index: A new method for assessing microvascularity in breast carcinoma with possible prognostic implications. Breast J 2000; 6: 103-107.
53.Kymionis GD, Dimitrakakis CE, Konstadoulakis MM, et al. Can expression of apoptosis genes, bcl-2 and bax, predict survival and responsiveness to chemotherapy in node negative breast cancer patients?. J Surg Res 2001; 99(2): 161-168.
54.Villar E, Redondo M, Rodrigo I, García J, Avila E, Matilla A. Bcl-2 Expression and apoptosis in primary and metastatic breast carcinomas. Tumour Biol 2001; 22: 137-145.
55.Suzuki M, Oshida M, Nagashima T, Hashimoto H, Yagata H, Nakajima N. Quantitative morphometric analysis of fine needle aspirates of breast carcinoma. Breast Cancer 2001; 8: 138-145.
56. Cobleigh MA, Vogel CL, Tripathy D, et al. Multinational study of the efficacy and safety of humanized anti-HER2 monoclonal antibody in women who have HER2-overexpressing metastatic breast cancer that has progressed after chemotherapy for metastatic disease. J. Clinical Oncol 1999; 17: 2639-2648.
57. Ciocca DR, Vargas-Roig LM. Heat shock proteins and drug resistance in breast cancer. In: Samuel D. Bernal (ed.), Drug Resistance in Oncology, pg. 167-190, Marcel Dekker, Inc. New York. 1997.
58. Lehnert M. Clinical multidrug resistance in cancer: a multifactorial problem. Eur. J. Cancer 1996; 32 A: 912-920.
59. Vargas-Roig LM, Fanelli MA, López LA, Gago FE, Tello O, Aznar JC, Ciocca DR. Heat shock proteins and cell proliferation in human breast cancer biopsy samples. Cancer Det. & Prev 1997; 21: 441-451.
60. Cárter C, Allen C, Henson D, et al. Relation of tumor size, lymph node status, and survival in 24.740 breast cancer cases. Can-cer 1989; 63: 181-187.
61. Welch WJ. Mammalian stress response: cell physiology, structure/function of stress proteins, and implications for medicine and disease. Physiol. Rev. 1992; 72: 1063-1081.
62. Vargas-Roig LM, Gago FE, Tello O, Martin de Civetta MT, Ciocca DR. c-erbB-2 (HER-2/neu) protein and drug resistance in breast cancer patients treated with induction chemotherapy. Int.J.Cancer (Pred. Oncol.), 1999; 84: 129-134.
63. McGuire W. Prognostic factors in primary breast cancer (Review). Cancer Surveys 1986; 5: 527-36.
64. Foekens J, Rio M, Seguin P, et al. Prediction of relapse and survival in breast cancer patients by pS2 protein status. Cancer Res. 1990; 50: 3832-3837.
65. Clair T, Miller W, Cho-Chung Y. Prog-nostic significance of the expression of a ras protein with a molecular weight of 21.000 by human breast cancer. Cancer Res., 1987; 47: 5290-5293.
66. Mayes D, Carney W, Tondini C. et al. Elevated circulating c-neu oncogene product in patients with breast cancer. Proceedings ASCO 1989 (Abstrct 11).
67. Tandon A, Clark G, Chammes G. et al. Cathepsin D and prognosis in breast cancer. N. Engl. J. Med., 1990, 322: 297-302.
68. Slamon DJ, Godolphin W, Jones LA, et al: Studies of the HEr-2/neu protooncogene in human breast and ovarian cancer. Science 1998; 244: 707-712
69. Sjogren S, Inganas M, Lindgren A et al: Prognostic and predictive value of c-erbB -2 overexpression in primary breast cancer, alone and in combination with other prognostic markers. J Clin Oncol 1998; 16: 462-469.
70. Burstein HJ, Marcm PK, Lambert-Falls R, et al: Multicenter phase II study of trastuzumab and vinorelbine as first- line therapy for HER2 overexpressing metastatic breast cancer (HER2+ MBC). Proc Am Soc Clin Oncol 2002; 21: 53a, (Abstr. 211).
71. Jahanzeb M, Mortimer J, Yunus J, et al: Weekly herceptin with navelbine in chemonaive patients with HER2 positive metastatic breast cancer: A phase II multicenter trial. Breast Cancer Res Treat 2001; 69: 284, (Abstr.429).
72. Burstein HJ, Kuter I, Campos SM, et al: Clinical activity of trastuzumab and vinorelbine in women with HER2-overexpressing metastatic breast cancer. J Clin Oncol 2001; 219: 2722-2730.
73. Slamon DJ, Leyland-Jones B, Shak Y, et al. Use of chemotherapy plus a monoclonal antibody against HER2 for metastatic breast cancer that overexpress HER2. N Eng J Med 2001; 344: 783-792.
74. Paik S, Bryant J, Park C et al: erbB-2 and response to doxorubicin in patients with axillary lymph node-positive, hormone receptor-negative breast cancer. J Natl Cancer Inst 1998; 90: 1361-1370.
75. Donegan WL. Factores de pronóstico relacionados con el tumor del cáncer de mama. CA Cancer Journal Clinicians 1997; 47:28-51.
76. Joslyn SA, West MM. "Diferencias raciales en la supervivencia del cáncer de mama. Cancer 2000; 88:114-123.
77. Elmore JG, Moceri VM, Carter D, Larson EB. Características del tumor de mama en mujeres blancas y negras. Cancer 1998; 83: 2509-2515.
78. Elledge RM, Clark GM, Chamness GC, Osborne CK. Factores biológicos del tumor y pronóstico del cáncer de mama entre las mujeres blancas, Hispanas, y negras en los Estados Unidos. Journal National Cancer Institute. 1994; 86: 705-712.
79. Yamasaki H, Mesnil M, Omori Y, et al. Intercellular communication and carcinogenesis. Mutation Research 1995; 333: 181-188.
80. Devesa SS, Blot WJ, Stone BJ et al. Recent cancer trends in the United States. J. Natl Cancer Inst. 87: 175-182.
81. Yung MCH, Lau YK. Basic science of HER-2/neu: a review. Semin Oncol 1999 26:51-59.
82. Aisenberg AC, Finkelstein DM, Doppke KP et al. High risk of breast carcinoma after irradiation of young women with Hodgkin's disease. Cancer 1997; 79: 1203-1210.
83. Benz C.C, Brandt B.H. and Zanker, K.S.. Gene diagnostics provide new insights into breast cancer prognosis and therapy. Gene 1995; 159: 3-7.
84. Devilee P, Cornelisse CJ. Somatic genetic changes in human breast cancer. Biochimica et Biophysica Acta. 1994; 1198: 113-130.
85. Berg JW, Hutter RVP. Breast Cancer. Cancer 1995; 75: 257-269.
86. Garcia I, Dietrich PY, Aapro M et al. Genetic alterations of c-myc, c-erbB-2, and c-Ha-ras protooncogenes and clinical associations in human breast carcinomas. Cancer Res 1989; 49, 6675-6679.
87. Weinstat-Saslow D, Merino MJ, Manrow RE et al. Overexpression of cyclin D mRNA distinguishes invasive and in situ breast carcinomas from non-malignant lesions. Nature Medicine 1995; 1: 1257-1260.
88. Cárter C, Allen C, Henson D et al. Relation of tumor size, lymph node status, and survival in 24.740 breast cancer cases. Can-cer, 1989, 63: 181-7.
89. Thorpe S, Rose C, Rasmussen B, Mouridsen W, Bayer T, Keiding N. On behalf of the Danish Breast Cancer Cooperative Group: Pronostic value of steroid hormone receptors: multivariante analysis of systemically untreated patients with node negative primary breast cancer. Cancer Res. 1988; 47: 6126-33.
90. McGuire W. Prognostic factors in primary breast cancer (Review). Cancer Surveys 1986; 5: 527-36.
91. Mayes D, Carney W, Tondini C et al.: Elevated circulating c-neu oncogene product in patients with breast cancer. Proceedings ASCO 1989 (Abstr 11).
92. Rochefor H, Augereau P, Capony F. et al. The 52 K cathepisin-D of breast cancer: Structure, regulation, función and clinical va-lue. In: Breast Cancer: Cellular and Molecular Biology (Lippman, M., Dickson, R., eds). Bos-ton: Kluwer Acad, 1988: 207-221.
93. Tandon A, Clark G, Chammes G et al. Cathepsin D and prognosis in breast cancer. N. Engl. J. Med., 1990, 322: 297-302.
94. Clair T, Miller W, Cho-Chung Y. Prog-nostic significance of the expression of a ras protein with a molecular weight of 21.000 by human breast cancer. Cancer Res., 1987; 47: 5290-3.
95. Sainsbury J, Farndon J, Needham G et al. Epidemial growth-factor receptor status as predictor of early recurrence of death from breast cancer. Lancet 1987; 1:1398-402.
96. King CR, Kraus MH, Aaronson SA. Amplification of a novel v-erbB-related gene in a human mammary carcinoma. Science 1995; 229, 974-976.
97. Brandt-Rauf PW. The c-erbB transmembrane growth factor receptors as serum biomarkers in human cancer studies. Mutation Res. 1995 ; 333, 203-208.
98. Berger MS, Locher GW, Saurer S et al. Correlation of c-erbB-2 gene amplification and protein expression in human breast carcinoma with nodal status and nuclear grading. Cancer Res. 1998; 48: 1238-1243.
99. Fontana X, Ferrari P, Namer M et al. C-erbB2 gene amplification and serum level of CerbB2 oncoprotein at primary breast cancer diagnosis. Anticancer Research 1994; 14: 2099-2104.
100. Li FP. Hereditary cancer susceptibility. Cancer, 1996; 78: 553-557.
101. Plowman GD, Culouscou JM, Whitney GS et al. Ligand-specific activation of HER4/ p180 erbB4, a fourth member of the epidermal growth factor receptor family. Proc. Natl. Acad. Sci. USA 1993; 90: 1746-1750.
102. Kraus MH, Issing W, Miki T et al. Isolation and characterization of ERBB3, a third member of the ERBB/ epidermal growth factor receptor family: Evidence for overexpression in a subset of human mammary tumors Proc. Natl. Acad. Sci. USA 1989; 86: 9193-9197.
103. Fukushige S, Matsubara K, Yoshida M et al. Localization of a novel v-erbB-related gene, c-erbB, on human chromosome 17 and its amplification in a gastric cancer cell line. Molecular and Cellular Biology 1986; 6, 955-958.
104. Pukkala E, Auvinen A, Wahlberg G. Incidence of cancer among Finnish airline cabin attendants, 1967-92. BMJ 1995; 311, 649-651.
105. Onda M, Matsuda S, Higaki S et al. ErbB-2 expression is correlated with poor prognosis for patients with osteosarcoma. Cancer 1996; 77: 71-78.
106. Harris LN, Liotcheva V, Broadwater G, et al. Comparison of methods of measuring HER-2 in metastatic breast cancer patients treated with high-dose chemotherapy. J Clin Oncol. 2001;19(6): 1698-706.
107. Molina R, Filella X, Zanon G, Pahisa J, Alicarte J, Munoz M, Farrus B, Ballesta AM. Prospective evaluation of tumor markers (c-erbB-2 oncoprotein, CEA and CA 15.3) in patients with locoregional breast cancer. Anticancer Res. 2003; 23:1043-1050.
108. Boice JD, Harvey EB, Blettner M et al. Cancer of the contralateral breast after radiotherapy for breast cancer. N Engl J Med 1992; 326: 781-785.
109. Lonn U, Lonn S, Nilsson B et al. Prognostic significance of c-erbB-2 amplification in fineneedle biopsies of breast cancer patients not operated at diagnosis. Breast Cancer Res and Treatment, 1996; 39: 213-220.
110. Holmes WE, Sliwkowski MX, Akita RW et al. Identification of Heregulin, a specific activator of p185 erbB-2 . Science 1992; 256: 1205-1210.
111. Boice JR, Preston D, Davis FG et al. Frequent chest x-ray fluoroscopy and breast cancer incidence among tuberculosis patients in Massachusetts. Radiat Res , 125, 214-222, 1991.
112. Deshane J, Siegal GP, Alvarez RD et al Targeted tumor killing via an intracellular antibody against erbB-2. Journal of Clinical Investigation 1995; 96, 2980-2989.
113. Tsai CM, Chang KT, Wu LH et al. Correlations between intrinsic chemoresistance and HER-2/ neu gene expression, p53 gene mutations, and cell proliferation characteristics in nonsmall cell lung cancer lines. Cancer Res, 1996; 56, 1, 206-209.
114. Hartmann LC, Ingle JN, Lester E et al. Prognostic value of c-erbB-2 overexpression in axillary lymph node positive breast cancer. Cancer 1994; 74: 2956-2963.
115. Berns EM, Foekens JA, van Staveren IL et al. Oncogene amplification and prognosis in breast cancer: relationship with systemic treatment. Gene 1995; 159: 11-18.
116. Tokunaga M, Land CE, Yammoto T et al. Incidence of female breast cancer among atomic bomb survivors, Hiroshima and Nagasaki, 1950-1980. Radiat. Res, 112, 243-272, 1987.
117. Hynes NE, Stern DF. The biology of erbB-2/neu/HER-2 and its role in cancer. Biochem. Biophis. Acta 1994; 1198: 165-184.
118. Muss HB, Thor AD, Berry DA et al. C-erbB-2 expression and response to adjuvant therapy in women with node-positive early breast cancer. N. Engl. J. Med. 1994; 330: 1260-1266.
119. Muss H, Thor A, Kute T. ErbB-2 (c-erbB-2, Her-2/neu) and S-phase fraction predict response to adjuvant chemotherapy in patients with node-positive breast cancer:cancer and acute leukemia group B (CALGB) Trial 8869. Proc 29 th Ann Meeting of the Am. Soc. Clin. Oncol 1993; 12: 72-88.
120. Miller AB, Howe GR, Sherman GJ et al. Mortality from breast cancer after irradiation during fluoroscopic examinations in patients being treated for tuberculosis. N. Engl. J. Med 1989; 321: 1285-1289.
121. King CR, Kasprzyk PG, Fischer PH et al. Preclinical testing of an anti-erbB-2 recombinant toxin. Breast Cancer Research and Treatment. 1996; 38, 19-25.
122. Tan M, Yao J, Yu D. Overexpression of the c-erbB-2 gene enhanced intrinsic metastasis potential in human breast cancer cells without increasing their transformation abilities. Cancer Research 1997; 57: 1199-1205.
123. Stal O, Sullivan S, Wingren S et al. c-erbB-2 expression and benefit from adjuvant chemotherapy and radiotherapy of breast cancer. European Journal of Cancer 1995; 31A 13-14, 2185,2190.
124. Wels W, Moritz D, Schmidt M et al. Biotechnological and gene therapeutic strategies in cancer treatment. Gene 1995; 159, 73-80.
El oncogen Her2 es uno de estos factores pronósticos, pero presenta la ventaja de que además ayuda a decidir el tratamiento. Dado que cada cáncer de mama es diferente deberemos administrar un tratamiento distinto a cada paciente y necesitamos este tipo de marcadores que nos ayuden a individualizar el tratamiento. Este es el objetivo de la farmacogenética, una disciplina científica reciente orientada al estudio de los aspectos genéticos relacionados con la variabilidad en la respuesta a los medicamentos en individuos o poblaciones, que pretende administrar el fármaco más eficaz, con el menor riesgo de efectos adversos y desde el primer momento, lo que podemos conocer como medicina individulizada.
La individualización del tratamiento será uno de los principales cambios de la práctica de la medicina en los próximos 5-10 años. De hecho, el trastuzumab (Herceptin®), un anticuerpo humanizado contra el receptor Her2, es una de las primeras aplicaciones farmacogenómicas aprobadas para uso clínico. Hasta ahora estaba autorizado para el tratamiento del cáncer de mama avanzado que sobreexpresa Her2, y recientemente ha sido también autorizado para las pacientes con cáncer de mama precoz que sobreexpresan este receptor, lo que supone alrededor del 20 al 30% de los casos
La investigación en la práctica clínica se basa cada vez más en un intercambio ágil y eficaz de la información que pueden proporcionar a las unidades clínicas los departamentos de Análisis Clínicos y de Patología, pues la cooperación de clínicos, bioquímicos y patólogos resulta indispensable para la eficacia de las nuevas dianas terapeúticas que van siendo proporcionadas por la farmacogenética.
Recibido: 3 de mayo de 2006. Recibido revisado 26 de junio de 2006.
Comentario del revisor Prof. Francisco Abad Santos MD. PhD. Servicio de Farmacología Clínica. Hospital la Princesa. Departamento de Farmacología y Terapéutica de la Facultad de Medicina. Universidad Autónoma de Madrid. España
Muchas mujeres padecen cáncer de mama, pero la evolución no es igual en todos los casos. En este artículo se revisan los factores pronósticos que ayudan a predecir que casos son más graves, y precisamente en éstos es en los que tendremos que intensificar el tratamiento.
Comentario del revisor María Jesús Coma del Corral MD. PhD. Unidad de Investigación. Hospital General Yagüe. Burgos. España
Un enfoque actual sobre el tratamiento del cáncer de mama como el que se describe en este trabajo de revisión, ilustra nuevos paradigmas de tratamientos antineoplásicos. Cada vez más los pacientes recibirán tratamientos oncológicos específicos para las peculiaridades citoquímicas del tumor, una vez comprobada su eficacia práctica, de manera semejante a como se administra hoy en día la antiboterapia.
Correspondence:
Dr. Angel San Miguel Hernández
Servicio de Análisis Clínicos. Hospital Universitario Rio Hortega.
C/ Rondilla de Santa Teresa nº 9. 47010. Valladolid
asanmiguel @ hurh.sacyl.es
Publicado, 26 de Agosto de 2006.
