Indice del volumen Volume index
Comité Editorial Editorial Board
Comité Científico Scientific Committee
INMUNOTOLERANCIA EN TUMORES GASTROINTESTINALES:
HLA-G E INDOLAMINA 2,3-DIOXIGENASA
Ana Sofía López González, *Carlos García-Girón, Mónica Cavia Sáiz,
*Ana López-Muñoz, *María García-González, María Jesús Coma del Corral,
**Pilar Muñiz Rodríguez
Unidad de Investigación y *Unidad de Oncología Médica. Hospital General Yagüe.
**Área de Bioquímica y Biología Molecular. Departamento de Biotecnología y Ciencia de los Alimentos. Universidad de Burgos.
Burgos. España
Rev Electron Biomed / Electron J Biomed 2007;3:59-65
Comentario del revisor Dr. Valentín del Villar Sordo. Jefe del Servicio de Medciina Interna del Hospital General de Soria. Catedrático de Medicina de la Universidad de Valladolid. Soria. España
Comentario del revisor Dra. Beatriz Cuevas Ruiz. Servicio de Hematología y Hemoterapia. Hospital General Yagüe. Burgos. España
Comentario del revisor Dra. Aitziber Echeverría Balda. Inmunóloga. Biología Celular y Molecular. Centro de Transfusión Sanguínea de Navarra. España
ABSTRACT:
The expression of immunosuppressive molecules influences in the prognosis, metastasis appearance and cytostatic treatment response. Among these molecules, HLA-G and indoleamine 2,3-dioxygenase (IDO) are sobreexpressed in cancer, such as in gastrointestinal tumours, and they could contribute to its development. Their expression by tumor cells or by immune system cells facilitates that tumour cells scape from immune attack and could induce immunotolerance in other body sites, and also influence in treatment effectiveness. The knowledge of tolerogenic capacity of tumours helps not only in the understanding of cancer growth but also in developing new therapeutic approaches.
Key words: HLA-G, indoleamine 2,3-dioxygenase, tolerance, immunosuppressive.
RESUMEN:
La expresión de moléculas inmunosupresoras influye en el pronóstico, en la aparición de metástasis y en la respuesta al tratamiento con citostáticos. Entre éstas, se encuentran el HLA-G y la indolamina 2,3-dioxigenasa (IDO), que están sobreexpresadas en el cáncer, como en los tumores gastrointestinales, y contribuyen a su desarrollo. Su expresión por el propio tumor o por las células del sistema inmune facilita que las células tumorales escapen del ataque inmune y puedan inducir inmunotolerancia en otras zonas del cuerpo, o incluso influir en la eficacia del tratamiento. El entendimiento de la capacidad tolerogénica del tumor ayuda no sólo a comprender el cáncer sino también a desarrollar nuevos enfoques terapéuticos.
Palabras clave: HLA-G, indolamina 2,3-dioxigenasa, tolerancia, inmunosupresión.
INTRODUCCIÓN
Los tumores gastrointestinales constituyen el tipo de cáncer con mayor incidencia y tasa de mortalidad en todo el mundo. Tanto factores genéticos como medioambientales contribuyen al incremento en la morbilidad y mortalidad por estos tumores. El ataque del sistema inmune contra los tumores gastrointestinales se ha demostrado por la presencia de células T específicas de antígenos tumorales y de linfocitos infiltrantes en el tumor. Sin embargo, este ataque no se correlaciona con una respuesta antitumoral clínica. El escape al ataque inmune parece deberse a la inducción de fenómenos de tolerancia. No obstante, la tolerancia a tumores no es simplemente causada por una inmunosupresión global, ya que los tumores gastrointestinales no se desarrollan frecuentemente en pacientes inmunodeficientes, lo que sugiere que el tumor por sí mismo puede presentar propiedades inmunomoduladoras o tener la capacidad de escape inmune1.
En la actualidad se han identificado varios mecanismos que podrían ser usados por las células tumorales para escapar del ataque inmune. Entre ellos está la pérdida del complejo mayor de histocompatibilidad (MHC) de clase I (en un 20% de las neoplasias colorrectales)2, la expresión ectópica del MHC-I no clásico HLA-G, de indolamina-2,3-dioxigenasa (IDO), de moléculas de apoptosis, como el ligando de FAS, o de citocinas inmunosupresoras, como TGF-ß e IL-10. En los tumores gastrointestinales, se ha descrito mediante estudios clínicos e histológicos que el sistema inmune del huésped interacciona con el tumor. De hecho, las células dendríticas infiltrantes de tumor, las células asesinas naturales, las células T CD8+, los macrófagos y los eosinófilos se correlacionan directamente con el pronóstico en neoplasias colorrectales3.
HLA-G: ESTRUCTURA, EXPRESIÓN Y FUNCIÓN
El HLA-G es una molécula no clásica del complejo mayor de histocompatibilidad HLA de clase I que existe como cuatro isoformas unidas a membrana (HLA-G1, -G2, -G3 y -G4) y tres isoformas solubles (HLA-G5, -G6 y -G7), que son generadas por una eliminación alternativa de intrones de un único trascrito primario4 (Figura 1). El HLA-G se caracteriza por un bajo polimorfismo genómico de 15 alelos. El HLA-G1 es la isoforma que se ha estudiado más ampliamente. El HLA-G1 tiene una estructura similar a la de las moléculas clásicas de HLA de clase I, está constituida por una cadena pesada que contiene 3 dominios globulares extracelulares (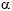 1,
1, 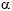 2 y
2 y 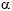 3) unidos de forma no covalente con una molécula de ß-2 microglobulina y un nonapéptido. El dominio
3) unidos de forma no covalente con una molécula de ß-2 microglobulina y un nonapéptido. El dominio 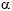 1 es común a todas las isoformas. Sin embargo, el HLA-G1 difiere de las moléculas clásicas de HLA de clase I por su lento transporte a la superficie celular y el lento recambio en la misma, debido a la cola intracitoplasmática truncada del HLA-G15.
1 es común a todas las isoformas. Sin embargo, el HLA-G1 difiere de las moléculas clásicas de HLA de clase I por su lento transporte a la superficie celular y el lento recambio en la misma, debido a la cola intracitoplasmática truncada del HLA-G15.
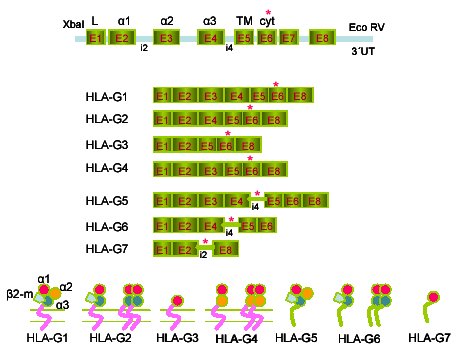
Figura 1: Diagrama esquemático de las isoformas transcritas de HLA-G unidas a membrane (G1-G4) e isoformas solubles (G5-G7). E1: secuencia líder; E2, E3 y E4: dominios externos
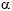 1,
1, 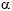 2 y
2 y 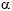 3; E5: dominio transmembran;
3; E5: dominio transmembran; E6: dominio citoplasmático; E8: 3´ región no transcrita; i2: intrón 2; i4: intrón 4; *: codón stop.
A diferencia de las moléculas clásicas de HLA-I, la expresión del HLA-G está normalmente restringida a tejidos inmunoprivilegiados como las células epiteliales del timo, la cornea , la membrana amniótica y citotrofoblastos extravillosos, donde ha sido asociada con la tolerancia materno-fetal. Los monocitos obtenidos de sangre periférica pueden expresar HLA-G in vitro al ser activados con IFN-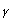 e IL-10.
e IL-10.
El HLA-G es una molécula relacionada con la tolerancia inmunológica, que ejerce su acción inhibidora interaccionando con tres receptores específicos en las células linfoides y mieloides: ILT2, ILT4 y KIR2DL4. El HLA-G presenta propiedades inhibidoras frente a las células efectoras más importantes del sistema inmune, impidiendo las reacciones inmunes a distintos niveles. Se ha demostrado que tanto las formas unidas a membrana como las isoformas solubles pueden inhibir la citotoxicidad de las células asesinas naturales (NK), la proliferación alogénica de las células T CD4+, la citotoxicidad específica de antígeno de las células T CD8+ y dirigen el balance de citocinas hacia un predominio de las células tipo Th2 6.
HLA-G EN TUMORES
En condiciones patológicas, el HLA-G puede expresarse por células tumorales7 y contribuir al desarrollo del tumor8. La presencia de HLA-G en células tumorales puede constituir una vía de escape al sistema inmune, como se ha visto en carcinomas de pulmón, linfomas cutáneos, tumores cerebrales, y melanoma entre otros. En cáncer colorrectal, existe controversia en cuanto a la expresión de HLA-G. Unos autores han demostrado su expresión en regiones de colon sano adyacente a lesiones cancerosas, así como en las propias células tumorales9; mientras que otros autores no han detectado dicha expresión10. En cáncer gástrico, se ha detectado la expresión de HLA-G aunque no se ha encontrado relación directa con la agresividad del tumor. Por otra parte, cabe destacar que el tratamiento con interferón en la inmunoterapia del cáncer puede tener efectos adversos ya que induce la expresión de HLA-G en el tumor7.
Las células tumorales podrían escapar al ataque inmune mediante varios mecanismos relacionados con el HLA-G, como el aumento de la expresión en superficie de HLA-G, la producción de HLA-G soluble ejerciendo una acción inmunosupresora a distancia11; o bien podrían inducir la expresión de HLA-G en las células presentadoras capaces así de inducir inmunosupresión en cualquier zona del cuerpo. Por ejemplo, en tumores de pulmón se ha encontrado la presencia de células dendríticas en sangre periférica, que expresan HLA-G12.
INDOLAMINA 2,3-DIOXIGENASA: METABOLISMO DEL TRIPTÓFANO, EXPRESIÓN Y FUNCIÓN
El triptófano es el aminoácido esencial más infrecuente y puede ser metabolizado por dos enzimas, la indolamina 2,3-dioxigenasa (IDO; EC 1.13.11.42) y la triptófano 2,3-dioxigenasa (TDO; EC 1.13.11.11). La proteína IDO es una enzima inducible que cataliza la degradación oxidativa del triptófano al romper la unión del doble enlace en posición 2,3 en el anillo indólico, y da lugar a L-formil-quinurenina, que es rápidamente metabolizada a quinurenina. Esta última posteriormente se metaboliza a ácido 3-hidroxi-antranílico, y finalmente a ácido quinolílico. Los pasos finales de la vía de degradación de la quinurenina dependen de los tipos celulares. La enzima IDO es limitante en esta ruta de degradación del triptófano13. La otra enzima que cataboliza el triptófano es la triptófano 2,3-dioxigenasa (TDO), aunque se localiza principalmente en el hígado. Esta enzima parece ser constitutiva y ni se induce ni se regula por señales procedentes del sistema inmune, a diferencia de la IDO14.
La IDO puede expresarse en macrófagos, monocitos y células dendríticas tras la activación con diversas citocinas, fundamentalmente el IFN-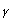 15. Otros tipos celulares, como fibroblastos, células endoteliales y algunas líneas celulares de tumores, también expresan IDO tras la exposición al IFN-
15. Otros tipos celulares, como fibroblastos, células endoteliales y algunas líneas celulares de tumores, también expresan IDO tras la exposición al IFN-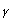 16. El IFN-
16. El IFN-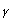 es el inductor más importante de la IDO17. Otros compuestos como el LPS, las citocinas inflamatorias, IL-1 y el TNF-
es el inductor más importante de la IDO17. Otros compuestos como el LPS, las citocinas inflamatorias, IL-1 y el TNF-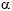 1, actúan sinérgicamente con el IFN-
1, actúan sinérgicamente con el IFN-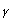 para inducir la expresión de la IDO in vitro. Recientemente, se ha descrito que la interacción entre las moléculas coestimuladoras B7-1/B7-2 (CD80/CD86) en células presentadoras de antígeno y la molécula CTLA-4 en células T constituye otra vía de inducción de la IDO 18. Esta interacción no sólo es necesaria para inducir la expresión de la IDO, sino para que ésta sea funcionalmente activa15.
para inducir la expresión de la IDO in vitro. Recientemente, se ha descrito que la interacción entre las moléculas coestimuladoras B7-1/B7-2 (CD80/CD86) en células presentadoras de antígeno y la molécula CTLA-4 en células T constituye otra vía de inducción de la IDO 18. Esta interacción no sólo es necesaria para inducir la expresión de la IDO, sino para que ésta sea funcionalmente activa15.
La activación de la IDO ha sido considerada inicialmente como parte de la defensa inmune innata contra virus, parásitos y bacterias13. Al catabolizar la degradación del triptófano, limita el crecimiento de estos patógenos retirando este aminoácido esencial del medio.
Distintos experimentos en modelos murinos han demostrado que esta enzima tiene un importante papel como agente tolerogénico, tanto en la tolerancia materno-fetal16 como en el escape inmune de células tumorales. La IDO puede suprimir la proliferación de las células T al limitar la disponibilidad de triptófano14. Sin embargo, el mecanismo por el cual la IDO ejerce sus funciones inmunoreguladoras no parece limitarse a una simple retirada de nutriente, ya que los metabolitos procedentes de la degradación del triptófano también tienen un papel en la regulación del sistema inmune18 y pueden ser tóxicos para los linfocitos T19.
IDO EN TUMORES
Las células tumorales pueden evadir la inmunidad anti-tumoral a través de la función inmunosupresora de la IDO. Por una parte, la IDO producida por las células tumorales puede inducir inmunosupresión en el tumor al suprimir la función y la proliferación de las células T dentro del tumor o mediante la limitación de la supervivencia de células T infiltrantes mediante metabolitos tóxicos del triptófano (Figura 2).
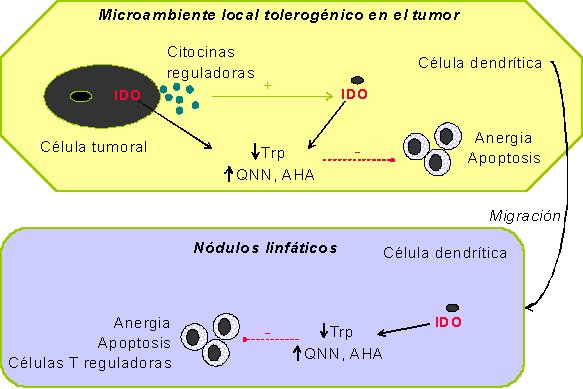
Figura 2: Esquema del efecto de la IDO en tumores y en nódulos linfáticos que drenan tumores.
Las línas verdes continuas significan activación y las líneas rosas punteadas significan inhibición.
Por otra parte, las células dendríticas del huésped que expresan IDO pueden presentar antígenos tumorales y migrar a nódulos linfáticos que drenan el tumor para presentar el antígeno a células T nativas20. De esta forma, pueden inducir apoptosis o anergia en las células T, o bien pueden derivar a alguna de estas células a células T reguladoras o supresoras 14 (Figura 2). En células dendríticas infiltrantes de tumores colorrectales, la IDO participa en la inmunidad tumoral local21.
Se ha descrito la existencia de una subpoblación de células dendríticas plasmacitoides que expresan IDO y pueden producir inmunosupresión en los nódulos linfáticos de ratones que drenan tumores. Estas células plasmacitoides pueden suprimir la respuesta de las células T hacia antígenos presentados por ellas o por células presentadoras de antígenos que no sean inmunosupresoras15. La enzima IDO expresada por las células plasmacitoides en los nódulos linfáticos que drenan el tumor puede crear un microambiente donde se suprime de forma local la respuesta de las células T antitumorales.
RELACION ENTRE IDO Y HLA-G
El HLA-G y la IDO presentan propiedades comunes con respecto a la expresión, función y regulación. De hecho, en humanos la expresión de IDO y HLA-G se ha demostrado en placenta, en órganos trasplantados, y pueden ser expresadas ectópicamente por tumores22. En estas situaciones, tanto la IDO como el HLA-G tienen funciones comunes, ya que ambas contribuyen al mantenimiento de la tolerancia materno-fetal, a la aceptación del trasplante, así como al escape tumoral6, 14.
Como se ha descrito anteriormente, la enzima IDO inhibe la proliferación de las células T. Así mismo, diversos estudios demuestran que el HLA-G presenta esta misma acción por mecanismos diferentes23. El HLA-G5 soluble inhibe la proliferación de células T CD4+ alogénicas. Además, el HLA-G soluble inhibe la proliferación de células T alogénicas inducidas por células dendríticas humanas sin afectar a su diferenciación y maduración. Las células presentadoras de antígeno que expresan HLA-G1 también son capaces de inhibir a las células T CD4+. Recientemente, se ha demostrado que el HLA-G derivado de monocitos puede actuar como un potente inhibidor de la activación de células T CD4+ autólogas y puede estar implicado en el control de la activación de células T autoreactivas. Además, estas moléculas inmunosupresoras pueden contribuir a la inducción de tolerancia en los órganos donde migran las células tumorales y contribuir así a la aparición de metástasis y comprometer la eficacia de ciertos citostáticos. Las estrategias de tratamiento tumoral se basan en muchas ocasiones en el disparo de la respuesta inmunológica, y así favorecer la actuación de los agentes quimioterapéuticos. De hecho, estudios recientes demuestran que alguno de los tratamientos empleados en el cáncer colorrectal pueden estar implicados en la neutralización de los efectos inmunosupresores del tumor24.
Ambos mecanismos de supresión no actúan de forma independiente, sino que están relacionados entre ellos, y probablemente con otros factores de supresión y activación. De hecho, tanto la IDO como el HLA-G pueden ser estimulados por las mismas moléculas, como el interferón25 y los metabolitos de la IDO pueden afectar a la expresión de HLA-G26, 27. Otro factor implicado es el estado redox celular. De hecho, la IDO puede ser regulada por el óxido nítrico y así se puede interferir en la tolerancia inducida por IDO. Una producción mantenida del mismo disminuye el nivel de IDO en líneas celulares de carcinoma de pulmón y carcinoma uroepitelial humano. Cabe destacar el papel antioxidante de la IDO al usar como substrato al anión superóxido (Taniguchi y cols 1979) o el de su metabolito 3-hidroxi-antranílico.
CONCLUSIONES
Como hemos visto anteriormente, tanto las células tumorales como las células presentadoras de antígeno pueden expresar HLA-G e IDO, de forma natural o tras la estimulación con citocinas, de forma que pueden conducir a una inmunosupresión. Por esta razón, la capacidad tolerogénica del tumor debe ser tenida en cuenta en los tratamientos antitumorales. En este sentido, la IDO y el HLA-G pueden ser objetivo de las nuevas armas terapéuticas a fin de estimular la respuesta de las células T en la inmunoterapia del cáncer.
Por otra parte, la presencia de HLA-G e IDO en sangre periférica procedentes de las propias células tumorales, o bien de las células presentadoras, puede constituir un novedoso marcador tumoral y contribuir al estudio del pronóstico, de la aparición de metástasis y de la eficacia de los diferentes tratamientos antitumorales. De hecho, recientemente se está estudiando el papel del HLA-G como marcador de la susceptibilidad a la quimioterapia en cáncer de ovario avanzado 28.
Las células tumorales gastrointestinales tienen una gran plasticidad y pueden emplear diferentes armas inmunosupresoras para escapar del ataque inmune. El conocimiento de los mecanismos por los que las células tumorales evaden al sistema inmune puede proporcionar en un futuro una nueva aproximación terapéutica para el tratamiento de los pacientes oncológicos.
REFERENCIAS
-
1. Todryk SM, Chong H, Vile RG, Pandha H, Lemoine NR. Can immunotherapy by gene transfer tip the balance against colorectal cancer?. Gut 1998;43:445-449
2. Browning M, Petronzelli F, Bicknell D, et al. Mechanism of loss of HLA class I expression on colorectal tumor cells. Tissue Antigens 1996;47:364-371
3. Mosolits S, Ullenhag G, Mellstedt H. Therapeutic vaccination in patients with gastrointestinal malignancies. A review of immunological and clinical results. Annals of oncology 2005;16: 847-862.
4. Moreau P, Carosella E, Teyssier M, et al. Soluble HLA-G Molecule An Alternatively Spliced HLA-G mRNA Form Candidate to Encode It in Peripheral Blood Mononuclear Cells and Human Trophoblasts. Human Immunol 1995;43: 231-6.
5. LeMaoult J, Le Discorde M, Rouas-Freiss N, et al. Biology and functions of human leukocyte antigen-G in health and sickness. Tissue Antigens 2003;62: 273-84
6. Carosella ED, Moreau P, Le Maoult J, Le Discorde M, Dausset J, Rouas-Freiss N. HLA-G molecules: from maternal-fetal tolerance to tissue acceptance. Adv Immunol 2003;81:199-252.
7. Rouas-Freiss N, Moreau P, Ferrone S, Carosella ED. HLA-G proteins in cancer: Do they provide tumor cells with an escape mechanism. Cancer Res 2005;65:10139-44.
8. Aractingi S, Kanitakis J, Euvrard S, et al. Selective expresión on HLA-G in malignant and premalignant skin specimens in kidney transplant recipients. Int J Cancer 2003;106:232-5
9. Hansel DE, Rahman A, Wilentz RE, et al. HLA-G upregulation in pre-malignant lesions of the gastrointestinal tract. Int J Gastrointes Cancer 2005;35:15-23
10. Leelawat K, Engprasert S, Pongchai-rerk U, et al. NO expresión of human leukocyte antigen G (HLA-G) in colorrectal cancer cells. J Med Assoc Thai 2004; 87:816-8
11. Rebmann V, Regel J, Stolke D, Grosse-Wilde H. Secretion of sHLA-G molecules in malignancies. Seminars Cancer Biol 2003;13: 371-7.
12. Pangault C, Le Friec G, Caulet-Maugendre S, Lena H, Amiot L, Guilloux V, Onno M, Fauchet R. Lung macrophages and dendritic cells express HLA-G molecules in pulmonary diseases. Human Immunology 2002;63: 83-90.
13. Mellor AL, Munn DH. Tryptophan catabolism and T-cell tolerance: immunosuppression by starvation?. Immunology Today 1999;20: 469-73.
14. Mellor AL, Munn DH. Tryptophan Catabolism and Regulation of Adaptive Immunity. J Immunol 2003;170: 5809-13.
15. Munn DH, Sharma MD, Mellor AL. Ligation of B7-1/B7-2 by Human CD4+ T Cells Triggers Indoleamine 2,3-Dioxygenase Activity in Dendritic Cells. J Immunol 2004;172: 4100-10.
16. Munn DH, Shafizadeh E, Attwood JT, Bondarev I, Pashine A, Mellor AL. Inhibition of T Cell Proliferation by Macrophage Tryptophan Catabolism. J Exp Med 1999;189: 1363-72.
17. Edelstein M, Ozaki Y, Duch D. Synergistic effects of phorbol ester and INF-gamma on the induction of indoleamine 2,3-dioxygenase in THP-1 monocytic leukemia cells. J Immunol 1989;143: 2969-73.
18. Grohmann U, Fallarino F, Puccetti P. Tolerance, DCs and tryptophan: much ado about IDO. Trends in Immunology 2003;24: 242-8.
19. Bauer TM, Jiga LP, Chuang JJ, Randazzo M, Opelz G, and Terness P. Studying the immunosuppressive role of indoleamine 2,3-dioxygenase: tryptophan metabolites suppress rat allogeneic T-cell responses in vitro and in vivo. Transplant Int 2005;18: 95-100.
20. Munn DH. Indoleamine 2,3-dioxygenase, tumor-induced tolerance and counter-regulation. Curr Opin Immunol 2006;18:220-5
21. Dadabayev AR, Sandel MH, Menon AG, et al. Dendritic cells in colorrectal cancer correlate with other tumor-infiltrating immune cells. Cancer Immunol Immunother 2004;53:978-86
22. Rouas-Freiss N, Moreau P, Menier C, Carosella ED. HLA-G in cancer: a way to turn off the immune system. Semin Cancer Biol 2003;13: 325-36.
23. Le Rond S, Gonzalez A, Gonzalez ASL, Carosella ED, Rouas-Freiss N. Indoleamine 2,3 dioxygenase and human leucocyte antigen-G inhibit the T-cell alloproliferative response through two independent pathways. Immunology 2005;116: 297-307.
24. Melichar B, Touskova M, Vesely P. Effect of irinotecan on the phenotype of peripheral blood leukocyte populations in patients with metastatic colorrectal cancer. Hepatogastroenterology 2002;49:967-70
25. Wagner SN, Rebmann V, Willers CP, Grosse-Wilde H, and Goos M, Expression analysis of classic and non-classic HLA molecules before interferon alfa-2b treatment of melanoma. The Lancet 2000;356:220-221.
26. López AS, Alegre E, LeMaoult J, Carosella E, Gonzalez A. Regulatory role of tryptophan degradation pathway in HLA-G expression by human monocyte-derived dendritic cells. Mol Immunol 2006;43: 2151-60
27. Gonzalez-Hernandez A, LeMaoult J, Lopez A, Alegre E, Caumartin J, Le Rond S, Daouya M, Moreau P, Carosella ED. Linking Two Immuno-Suppressive Molecules: Indoleamine 2,3 Deoxygenate Can Modify HLA-G Cell-Surface Expression. Biol Reprod 2005;73:571-578.
28. Davidson B, Elstrand MB, McMaster MT, et al. HLA-G expresión in effusions is a posible marker of tumor susceptiblility to chemotherapy in ovarian carcinoma. Gynecol Oncol 2005;96:42-7.
Se trata de un interesante trabajo de revisión sobre la capacidad que tienen los tumores gastrointestinales de tolerancia ante las reacciones inmunes. Se enumeran los variados mecanismos que podrían explicar este hecho; centrándose la revisión en la molécula no clásica HLA-G del MHC-I y la Indolamina-2-3-dioxigenasa (IDO) y la relación entre ambas. Se señala que tanto HLA-G como IDO pueden ser diana de nuevas armas terapéuticas y pueden constituir un marcador tumoral y ayudar en la eficacia terapéutica y el pronóstico.
Comentario del revisor Dr. Valentín del Villar Sordo. Jefe del Servicio de Medciina Interna del Hospital General de Soria. Catedrático de Medicina de la Universidad de Valladolid. Soria. España
Recibido 22 de Julio de 2007.
Publicado 13 de Octubre de 2007
