Indice del volumen Volume index
Comité Editorial Editorial Board
Comité Científico Scientific Committee
HÍGADO GRASO NO ALCOHÓLICO EN RATAS MACHOS DE UNA LÍNEA CON DIABETES GENÉTICA
Stella Maris Daniele PhD.1 Juan Carlos Picena PhD.2
Silvana Marisa Montenegro PhD.2,3
María Cristina Tarrés PhD. 2,3
Stella Maris Martínez PhD.2,3
1Facultad de Ciencias Bioquímicas
2 Facultad de Ciencias Médicas
3 Consejo de Investigaciones. Universidad Nacional de Rosario.
Rosario, Argentina
Rev Electron Biomed / Electron J Biomed 2007;3:29-39
Comentario del revisor Dr. Valentín del Villar Sordo. Jefe del Servicio de Medciina Interna del Hospital General de Soria. Catedrático de Medicina de la Universidad de Valladolid. Soria. España
Comentario del revisor José Luis Hernánez Cáceres.Center for Cybernetics Applications to Medicine (CECAM). Havana, Cuba.
ABSTRACT:
Non-alcoholic fatty liver is a common disease closely related to the increasing prevalence of obesity and type 2 diabetes in the general population. The eSS rats display a non obese type 2 diabetic syndrome with an insulin resistant state characterized by hyperglycaemia, hypertriglyceridemia and hyperinsulinemia. In 12 month-old eSS males glycaemia, fructosamine, triglyceridemia and reactive species to oxygen were evaluated, and the hepatic histology was studied. Increased basal glycaemia and fructosamine values correlate directly with those of lipid peroxidation and inversely with antioxidant values. Diffuse steatosis was detected. Cytoplasmatic PAS positive granularity decreased towards the center of the lobule. Binucleated hepatocytes were observed, as well as regular mobilization of Kupffer cells. The pattern of lipidic deposits in eSS rat's hepatocytes was similar to the one observed in biopsies of type 2 diabetic patients. As eSS displays a diabetic syndrome without obesity, these findings suggest the capacity of increased levels of oxidative stress to induce hepatic steatosis.
Key words: Rats, biologic models, hepatic steatosis, diabetes, oxidative stress
RESUMEN:
El hígado graso no alcohólico (HGNA) es una entidad de prevalencia creciente en todo el mundo vinculada a la obesidad y a la diabetes tipo 2. Las ratas eSS presentan un síndrome diabético tipo 2 espontáneo, sin obesidad, con un estado de resistencia a la insulina caracterizado por hiperglucemia, hipertrigliceridemia e hiperinsulinemia. En machos eSS de 12 meses fueron evaluadas glucemia, fructosamina (FH2), trigliceridemia y especies reactivas al oxígeno, así como la histología hepática. Se verificó aumento de la glucemia basal y de la FH2 cuyos valores correlacionan directamente con los de los indicadores de peroxidación lipídica e inversamente con antioxidantes totales. Se observó esteatosis y granularidad citoplasmática PAS positiva en los hepatocitos. Asimismo, se detectaron imágenes de binucleación hepatocelular y regular movilización de células de Kupffer. El patrón de los depósitos lipídicos y de la granularidad citoplasmática en los hepatocitos es análogo al observado en biopsias de pacientes diabéticos tipo 2. De esta manera, eSS presenta un síndrome diabético sin obesidad lo cual sugiere la capacidad del estrés oxidativo resultante de inducir esteatosis hepática.
Palabras clave: ratas, modelos biológicos, esteatosis hepática, diabetes, estrés oxidativo
INTRODUCCIÓN
El hígado graso no alcohólico (HGNA) incluye un amplio espectro de lesiones hepáticas que van desde la esteatosis, pasando por la esteatohepatitis hasta la fibrosis y, eventualmente, la cirrosis1.
La esteatosis hepática no alcohólica, caracterizada por la acumulación de lípidos visibles en el citoplasma de los hepatocitos de pacientes sin antecedentes de consumo de alcohol, fue considerada largo tiempo una entidad de curso benigno2. Actualmente se admite que la esteatosis aumenta la vulnerabilidad del hepatocito frente a otras agresiones3, pudiendo ser el primer paso de un proceso de daño hepático en que se agreguen lesiones inflamatorias de mayor gravedad4.
La obesidad, la diabetes tipo 2 y la hiperlipemia son causas primarias del HGNA5. Se estima que el 75% de los pacientes diabéticos tipo 2 presenta en mayor o menor grado alguna de las etapas de HGNA. Su etiopatogenia está vinculada con la resistencia a la insulina, el estrés oxidativo así como a factores genéticos y ambientales no bien conocidos6. Se lo ha vinculado a procesos adaptativos de supervivencia de poblaciones humanas y animales en ambientes muy fríos y con escasa disponibilidad alimenticia7.
Las ratas eSS desarrollan espontáneamente una diabetes tipo 2, sin obesidad, más marcada en los machos. Hasta el año se produce el aumento de la glucemia junto a niveles crecientes de insulina circulante lo que indica resistencia a la insulina8-9. Durante el segundo año, se comprueba la disminución progresiva de las concentraciones de insulina y el agravamiento del síndrome8-9. Las alteraciones del metabolismo lípido son precoces y se ha comprobado niveles aumentados de triglicéridos plasmáticos en machos de 5 meses de edad, aun euglicémicos10.
El presente estudio demuestra la presencia de lesiones características del HGNA en machos eSS de un año de edad, atribuibles a su dismetabolopatía y al consecuente estrés oxidativo.
MATERIAL Y MÉTODOS
Se utilizaron machos eSS y controles Wistar (W) eumetabólicos de 12 meses de edad. Los machos eSS provenían del bioterio de la Cátedra de Biología de la Facultad de Ciencias Médicas de la UNR. Los machos W pertenecían al bioterio de la Facultad de Ciencias Bioquímicas-UNR. Las condiciones de cría incluyen regulación de la temperatura (24ºC) y de los ciclos luz-oscuridad así como el recambio de aire. En todos los casos los individuos permanecieron alojados desde los 21 días de edad, en jaulas colectivas suspendidas y sin lecho. Los animales recibieron agua y alimento balanceado ad libitum. Este último en forma de pellets secos (Cargill rata-ratónR, Cargill Co., Buenos Aires) que cada 100 g contienen: proteínas 25.1%, grasa 3.5%, glúcidos (almidón) 43%, fibra 6%, minerales 8%, vitaminas 1.9% y humedad 12.5%. La densidad calórica fue de 304 Kcal/100 g.
El protocolo de investigación fue examinado y considerado aceptable desde el punto de vista ético por la Comisión de Bioética de la Facultad de Ciencias Médicas-UNR.
1. Exámenes de laboratorio:
Se emplearon 12 machos eSS y 10 W para la determinaron la glucemia basal (G0), la fructosamina (FH2) y los triglicéridos plasmáticos (Tg). Asimismo, se determinaron las especies óxido reactivas con ácido tiobarbitúrico (TBARS) que es un marcador de la peroxidación lipídica basado en la reacción del malondialdehido (MDA) con el ácido tiobarbitúrico (TBA). Los factores implicados en la protección antioxidante fueron evaluados mediante la determinación del estado de los antioxidantes totales (TAS), el ácido úrico (Ur) y la superóxido dismutasa (SOD).
Después de un ayuno de 10 horas, se pesó a los animales, se los anestesió y se obtuvieron las muestras de sangre por punción cardíaca. Las muestras fueron divididas en dos fracciones, una de las cuales recogida sobre EDTA (1mg/ml) y dividida a su vez en dos porciones. Una de las alícuotas fue centrifugada durante 10 minutos a 1500 G, separado el plasma del paquete globular y conservado a -20 ºC hasta la determinación de TBARS dentro de las 72 h, mientras que la otra porción fue destinada a determinar SOD y el contenido de hemoglobina, determinaciones realizadas después de la extracción. La segunda fracción de sangre entera fue centrifugada durante 10 minutos a 1500 g, luego fue separado el suero y en una parte de éste se cuantificaron glucemia y FH2, mientras que otra porción se conservó a -20 ºC hasta la determinación de TAS, dentro de los 14 días siguientes.
Previa determinación del contenido de hemoglobina, se midió la SOD utilizando el Kit Ransod de los laboratorios Randox Ltd. (Cat. Nº SD125). Se centrifugaron alícuotas de sangre, se lisaron los hematíes. El lisado se utilizó para la medida de la SOD.
En la determinación de TBARS, el procedimiento analítico empleado fue adaptado de los métodos desarrollados por Hendriks y Assman11 y por Richard y col.12. 50 ml de plasma (o la solución standard de trabajo de MDA) se colocaron en un tubo de vidrio de 10 ml conteniendo 1 ml de agua destilada a los que se les adicionó 1ml de solución conteniendo 29 µmol/L de TBA, en ácido acético (pH entre 2.4 a 2.6). Las muestras fueron colocadas en un baño de agua durante 1 h a 95-100 ºC. El producto coloreado fue extraído por agitación con n-butanol. Se separó la capa de n-butanol por centrifugación a 1500 G durante 10 minutos y se midió la absorbancia a 532 nm). Se analizó el TAS utilizando un Kit de Laboratorios Randox Ltd. (Cat. Nº NX2332). Respecto de eSS, se completó el procedimiento en 8 muestras.
Para la determinación de FH2, se midió la absorbancia en la reacción reducción del azul de nitrotetrazolium. Los niveles de glucosa sérica y de triglicéridos se determinaron en autoanalizador Hitachi 912.
En eSS, fueron calculadas las correlaciones entre TBARS y G0; TBARS y FH2; TAS y G0; TAS y FH2; TBARS y TAS y entre TAS y SOD. Asimismo, se estimó la correlación entre Tg y TAS, TBARS y SOD, respectivamente.
2. Estudio anatomopatológico:
En 6 machos eSS y 6 W, se registró la biomasa, se los sacrificó e inmediatamente se extrajo el hígado y se lo pesó. Parte del órgano fue fijado en parafina para realizar cortes histológicos y teñirlos con H-E y PAS. Otra parte fue sometida a la técnica de cortes por congelación y tinción especial (Oil Red o Rojo O) para visualizar lípidos. Posteriormente se realizó el estudio con microscopía óptica.
3. Métodos estadísticos:
Los resultados se expresan como media ± ES y se analizaron mediante la prueba t de Student. Las correlaciones bivariadas entre TBARS, G0, FH2, TAS y SOD se calcularon mediante el coeficiente r de Pearson. Se asumió un nivel de significación de p<0.05.
Los animales fueron tratados respetando las normas éticas que rigen el empleo de animales de investigación.
RESULTADOS
G0, FH2 y Tg fueron significativamente superiores en eSS mientras que los valores de la biomasa no difirieron. En las ratas diabéticas se verificaron niveles más altos del marcador de lipoperoxidación TBARS y una disminución significativa del estado de los antioxidantes totales TAS respecto de los animales controles. En cuanto a la actividad SOD y la concentración de Ur, no hubo diferencias significativas entre líneas (Tabla1).
|
Línea |
Peso (g) |
G0 (mg/dl) |
Tg (mg/dl) |
FH 2 |
TBARS (umol/l) |
TAS (mmol/l) |
Ur (mg/dl) |
SOD U/g Hb |
|
eSS (n=12) |
424 ± 11 |
148 ± 7.7 |
167 ± 7.4 |
193 ± 16.4 |
11 ± 1.8 |
0.48* ± 0.027 |
1.38 ± 0.5 |
2060 ± 100 |
|
Wistar (n=10) |
413 ± 33 |
99 ± 7.3 |
53 ± 4.1 |
101 ± 18.7 |
3.4 ± 0.62 |
0.88 ± 0.047 |
1.22 ± 0.4 |
2111 ± 83 |
|
P |
>0.05 |
<0.001 |
<0.001 |
<0.001 |
<0.001 |
<0.001 |
>0.05 |
>0.05 |
Los valores se expresan como media ± ES *: Los valores corresponden a 8 animales
Se verificaron correlaciones significativas entre los niveles de TBARS y G0 (r: 0.909), así como entre TBARS y FH2 (r: 0.911). También se comprobaron correlaciones negativas y significativas entre G0 y TAS (r: -0.9), FH2 y TAS (r: -0.921) y TBARS y TAS (r: -0.943) (Figuras 1, 2, 3, 4 y 5). No hubo correlaciones significativas entre TBARS y TAS ni entre TBARS y SOD. Tampoco se verificó correlación entre Tg con ninguna de las variables consideradas.
En los animales autopsiados se comprobó que el peso del hígado fue superior en eSS respecto de W (eSS: 25.07±5.63 g vs. 16.42±1.28 g; P < 0.001) pese a tener biomasas similares (eSS: 420±6.33 g vs. W: 435±38 g; p>0.05).
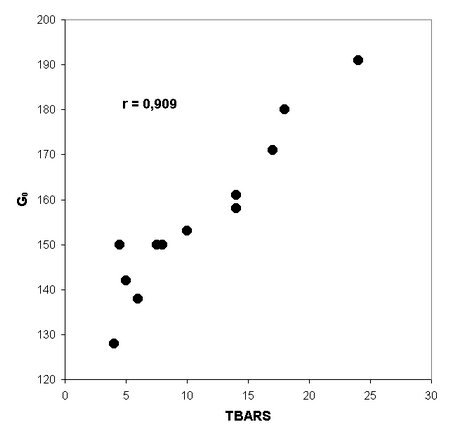
Fig. 1: Correlación entre los valores de sustancias ácido reactivas con ácido tiobarbitúrico en suero (TBARS) medidos en µmol/L, y los de la glucemia basal (G0) dosada en mg/dl, en 12 ratas machos diabéticas de línea eSS, de 12 meses de edad (r = 0.909; p<0.001).
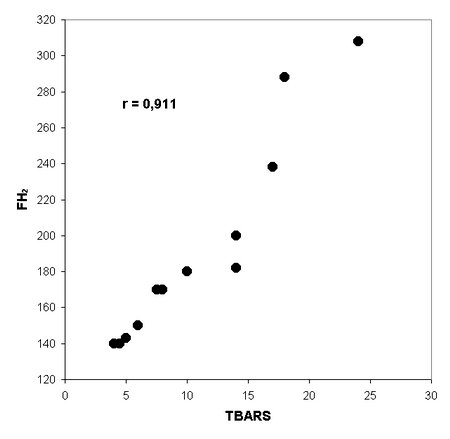
Fig. 2: Correlación entre los valores de sustancias ácido reactivas con ácido tiobarbitúrico en suero (TBARS) medidos en µmol/L, y los de la fructosamina glucosilada (FH2) en 12 ratas machos diabéticas de línea eSS, de 12 meses de edad (r=0.911; p<0.001).
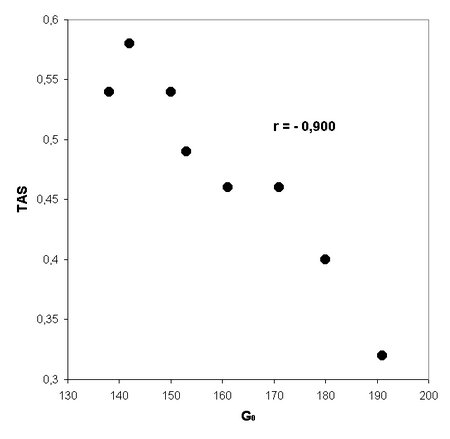
Fig. 3: Correlación entre los valores de la fructosamina (FH2) y los de antioxidantes totales (TAS) medido en µmol/L en 8 ratas machos diabéticas de línea eSS, de 12 meses de edad (r=-0.900; p<0.01).
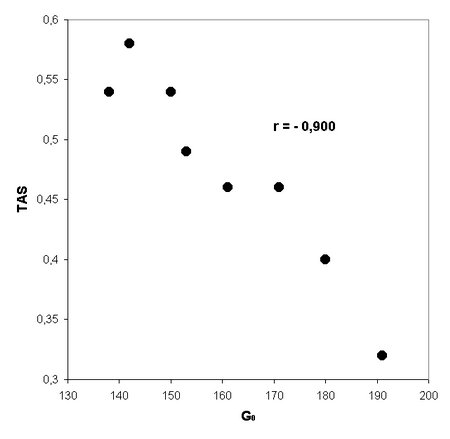
Fig. 4: Correlación entre los valores de la glucemia basal (G0) dosada en mg/dl, y los de antioxidantes totales (TAS) medido en µmol/L en 8 ratas machos diabéticas de línea eSS, de 12 meses (r=-0.900; p<0.01).

Fig. 5: Correlación entre los valores de la fructosamina (FH2) y los de antioxidantes totales (TAS) medido en umol/L µmol/L en 8 ratas machos diabéticas de línea eSS, de 12 meses de edad (r=-0.921; p<0.01).
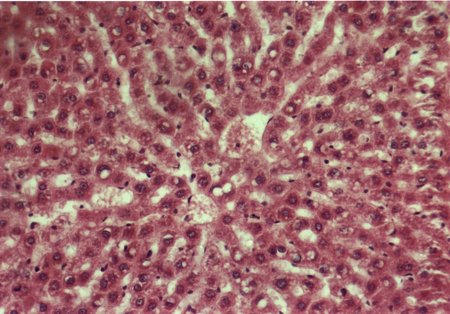
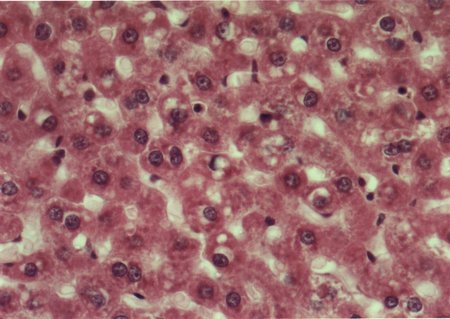
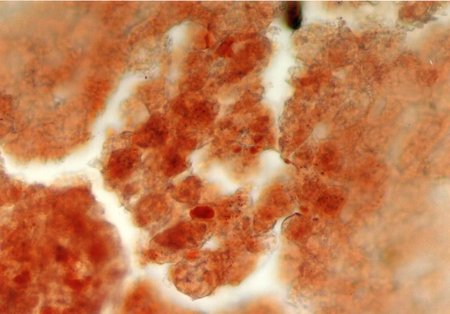
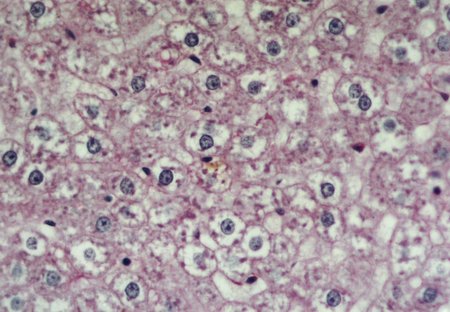
Al estudiar la histología hepática, se observó que en eSS las estructuras lobulillar, trabecular y portal no presentaron alteraciones. Los animales diabéticos exhibieron esteatosis caracterizada por vacuolas de distintos tamaños más abundantes en la zona centro y mediolobulillar (figs 6 y 7), que se colorean con Oil Red (fig 8), así como granularidad citoplasmática de los hepatocitos (fig 9). Se observa la presencia de balonización, binucleación hepatocelular, así como incremento de las células de Kupffer (fig 10). Con la tinción de PAS se aprecia una positividad difusa, característica de los depósitos de glucógeno, que disminuyen hacia el centro del lobulillo (fig 9). En algunas zonas existían focos de colestasis (fig 11). No se detectó signos de inflamación lobulillar ni portal, ni de fibrosis.
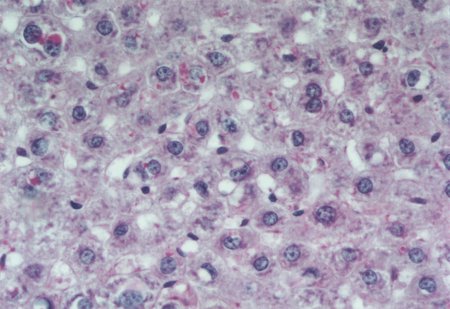
Fig. 9: Granularidad y vacuolización del
citoplasma hepatocelular. Depósitos PAS positivos. PAS-400X
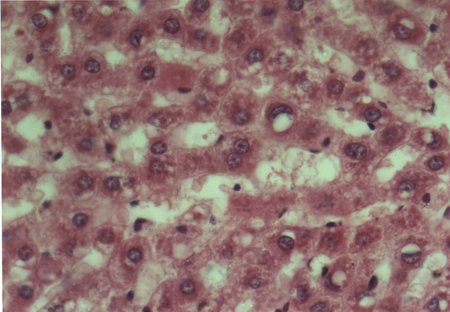
Fig. 10: Vacuolas de distintos tamaños y balonización.
Hepatocito binucleado en el centro. Células de Kupffer prominentes. HE-400X
En los testigos Wistar la estructura de los lobulillos, la disposición de las trabéculas, la conformación de los espacios portales y las características citoplasmáticas no presentaron alteraciones.
DISCUSIÓN
La presencia de esteatosis y balonamiento hepatocelular, así como la movilización de células de Kupffer en el hígado de las ratas eSS, sugiere un hígado graso no alcohólico. Cabe mencionar que la Asociación Americana para el Estudio de las Enfermedades del Hígado definió como criterios para el diagnóstico de la EHNA en humanos la presencia de esteatosis en combinación con hepatocitos balonizados, así como de infiltrado inflamatorio mixto acompañado, en ocasiones, de fibrosis13. Como este último criterio no se observó en los animales eSS, se estaría ante la etapa inicial de su esteatohepatitis.
El primer paso de la enfermedad hepática no alcohólica, la esteatosis aparentemente es causada por la resistencia periférica a la insulina que incrementa el transporte de ácidos grasos al hígado y la síntesis intrahepática de triglicéridos14. A su vez, esto promueve mayor acumulación de triglicéridos a través de la inhibición de la oxidación mitocondrial de los ácidos grasos15. Tales fenómenos intervendrían en la aparición de esteatosis en la rata eSS, ya que la línea diabética presenta niveles crecientes de insulina circulante hasta el año edad junto a glucemias cada vez más elevadas lo que indica resistencia a la insulina8-9.
Es interesante señalar que eSS no presenta obesidad, uno de los factores de riesgo claramente asociados al HGNA. Sin embargo, si bien la esteatosis está presente en el 70% de los pacientes diabéticos obesos, también lo está en el 35% de los pacientes con peso normal14. El hígado graso no parece ser un rasgo uniforme del síndrome metabólico y parecería existir una gran variación individual en su desarrollo7.
En eSS la hiperglucemia se asocia con altos niveles de lipoperoxidación así como la disminución de las defensas antioxidantes. Los valores elevados de FH2 indican que la hiperglucemia es sostenida en el tiempo y, por lo tanto, capaz de inducir productos finales de glicosilación avanzada. Se sabe que los mismos están involucrados en la generación de especies reactivas derivadas del oxígeno altamente tóxicas para las células15. El desequilibrio glucémico crónico de eSS induciría el incremento de radicales libres capaces de atacar los dobles enlaces de los ácidos grasos poliinsaturados, induciendo lipoperoxidación y un mayor daño celular oxidativo. Estos resultados coinciden con los hallazgos en la diabetes humana tipo 216. De este modo, si bien la resistencia a la insulina sería el factor clave en el inicio de la acumulación grasa en el hígado, una vez que la esteatosis se establece, el estrés oxidativo es un factor fundamental que promueve mayor daño hepatocelular y la evolución de las lesiones14, 17-18.
La movilización de células de Kupffer observada en eSS indicaría la existencia de un proceso inflamatorio hepatocelular. Se sabe que su activación conduce a la liberación de citoquinas pro-inflamatorias, tales como el factor de necrosis tumoral alfa, vinculadas a la evolución de la esteatosis a la esteatohepatitis14, 19-20. Asimismo, como el hallazgo de binucleación hepatocelular es un indicio de regeneración, parecerían coexistir en forma simultánea lesiones alterativas celulares e intentos compensatorios que se oponen a ellas.
En conclusión, los machos de la línea diabética eSS presentan al año lesiones hepáticas propias del hígado graso no alcohólico. La resistencia a la insulina como fenómeno inicial y su combinación con el estrés oxidativo debido a la persistencia de elevadas glucemias, serían factores determinantes de su patogénesis. No se descarta la existencia de lesiones hepáticas en machos eSS más jóvenes ya que se sabe que la resistencia a la insulina está presente desde los primeros meses de vida8-9.
REFERENCIAS
1. Adams LA, Angulo P, Lindor KD. Non-alcoholic fatty liver disease. CMAJ 2005; 172: 899-05.
2. Teli MR, James O, Burt A, Bennett MK, Day CP. The natural history of nonalcoholic fatty liver: a follow-up study. Hepatology 1995; 22:1714-19
3. Day CP. Pathogenesis of steatohepatitis. Best Pract Res Clinical Gastroenterol 2002; 16: 663-78.
4. Farell GC. Non alcoholic steatohepatitis: What is it, and why is it important in the Asian-Pacific region? J Gastroenterol Hepatol 2003; 18: 124-38.
5. Adams LA, Angulo P. Treatment of non-alcoholic fatty liver disease. Postgrad Med J 2006; 82: 315-22.
6. Hoque M, Sanyal AL. The metabolic abnormalities associated with non-alcoholic fatty liver disease. Best Pract Res Clin Gastroenterol 2002; 16: 709-31.
7. Caldwell SH, Ikura Y, Iezzoni JC, Liu Z. Has natural selection in human populations produced two types of metabolic syndrome (with and without fatty liver)? J Gastroenterol Hepatol 2007; 22 (Suppl 1):S11-9.
8. Martínez SM, Tarrés MC, Montenegro SM, Revelant G, Figueroa N, Alonso D, Laudanno OM, D´Ottavio A. Intermittent dietary restriction in eSS diabetic rats. Effects on metabolic control and skin morphology. Acta diabetol lat 1990; 27: 329-36.
9. Martínez SM, Tarrés MC, Picena JC, Montenegro SM, Gagliardino JJ, Gómez-Dumm, CLA, D'Ottavio AE, Naves A, Rabasa SL. eSS rat, an animal model for the study of spontaneous non-insulin-dependent diabetes. In: Lessons from animal diabetes IV; E Shafrir ed. Smith Gordon, London 1993, pp 75-90.
10. Gomez Dumm INT., Montenegro S, Tarres MC, Martinez SM, Igal RA. Early Lipid Alterations in Spontaneously Diabetic Rats. Acta Physiol Pharmacol Ther Latinoam 1998; 48: 228-34.
11. Hendriks T, Assmann RFTA. On the fluorometric assay of circulating lipoperoxides. Clin Chem Acta 1988; 174: 263-70.
12. Richard MJ, Portal B, Meo J, Coudray C, Hadjian A, Favier A. Malondialdrhyde kit evaluated for determining plasma and lipoprotein fractions that react with thiobarbituric acid. Clin Chem 1992; 38: 704-9.
13. Neuschwander-Tetri BA, Caldwell S. Nonalcoholic steatohepatitis: summary of an AASLD single Tepic Conference. Hepatol 2003, 37: 1202-19.
14. Medina J, Fernandez-Salazar LI, Garcia-Buey L, Moreno-Otero R. Approach to the pathogenesis and treatment of nonalcoholic steatohepatitis. Diab Care 2004; 27:2057-66.
15. Browning JD, Horton JD. Molecular mediators of hepatis steatosis and liver injury. J Clin Invest 2004; 114: 147-152.
16. Aguirre F, Martin I, Grinspon D, Ruiz M, Hager A, De Paoli T, Ihlo J, Farach HA, Poole CP. Oxidative damage, plasma antioxidant capacity, and glucemic control in elderly NIDDM patients. Free Radic Biol Med 1998; 24:580-85.
17. Gökkusu C, Palanduz S, Ademoglu E, Tamer S. Oxidant and antioxidant systems in NIDDM patients: influence of vitamin E supplementation. Endocr Res 2001; 27:377-86.
18. Leclercq IA. Pathogenesis of steatohepatitis: insights from the study of animal models. Acta Gastroenterol Belg 2007; 70:25-31.
19. Wigg AJ, Roberts-Thomsom IC, Dymock RB, McCarthy PJ, Grose RH, Cummins AG. The role of intestinal bacterial overgrowth, intestinal permeability, endotoxemia, and tumor necrosis factor alfa in the pathogenesis of non-alcoholic steatohepatitis. Gut 2001; 48: 206-211.
20. Leclercq IA, Da Silva Morais A, Schroyen B, Van Hul N, Geerts A. Insulin resistance in hepatocytes and sinusoidal liver cells: mechanisms and consequences. J Hepatol 2007; 47: 142-56.
Correspondencia:
Prof Dra Stella Maris Martínez
Facultad de Ciencias Médicas- UNR
Santa Fe 3100
2000 Rosario, Argentina
Correo electrónico: stellamartinez @ telnet.com.ar
Recibido 17 de Octubre de 2007. Recibido revisado 27 de Diciembre.
Publicado 31 de Diciembre de 2007