Indice del volumen Volume index
Comité Editorial Editorial Board
Comité Científico Scientific Committee
DAÑO VELLOSO HIPOXICO EXTENSO EN VELLOSIDAD PLACENTARIA INFECTADA POR PLASMODIUM VIVAX.
Olivar C. Castejon S1, 2, Ángela J. López G 3, Joyce Y. Urdaneta1, 2,
Luís M. Pérez Ybarra3, Oliver C. Castejón M.1
1 Centro de Investigación y Análisis Docente Asistencial del Núcleo Aragua (CIADANA). Maracay.
2Laboratorio de Microscopía Electrónica. 3Escuela de Bioanálisis.
Facultad de Ciencias de la Salud. Universidad de Carabobo - Núcleo Aragua
Venezuela.
olivar.ciadanauc @ gmail.com
Rev Electron Biomed / Electron J Biomed 2011;1:45-54.
RESUMEN:
Objetivo: El propósito de este estudio de caso fue el determinar el daño velloso hipóxico extenso en una población de vellosidades obtenida de una placenta infectada por Plasmodium vivax y tratada con cloroquina cuantificando el daño en relación a otra población normal no infectada.
Métodos: Un protocolo de observación se aplicó a la placenta infectada conteniendo las variables que definen el daño como la presencia de nódulos sincitiales, hipovascularidad vellosa y vellosidades fibróticas o avasculares cuyos porcentajes en la placenta estudio y control fueron medidos estadísticamente para estimar las diferencias significativas. Diez láminas teñidas con hematoxilina y eosina por cada placenta fueron empleadas determinándose el porcentaje de cada variable en 100 vellosidades en ambas placentas.
Resultados: La placenta con P.vivax presentó entre un 29 y 58 % de nódulos sincitiales mientras que el control 3 y 24%. La fibrosis estromal entre 12 y 49%;la control entre 1 y 7%. La hipovascularidad entre 49 y 84%; la control entre 7 y 18%. Trombosis intervellosa, oclusión de la luz de vasos troncales,infartos y corangiosis se observaron en la infectada y no en el control.
Conclusiones: Estos resultados sugieren un daño velloso hipóxico extenso en las vellosidades infectadas mientras que las del control permanecen normóxicas. Dicho daño pudiera impedir el suministro de gases y nutrientes que estimularía a nivel fetal la restricción del crecimiento intrauterino con la subsiguiente pérdida de peso fetal.
PALABRAS CLAVE: Daño velloso hipóxico. Placenta. P.vivax.
SUMMARY: EXTENSIVE HIPOXIC VILLOUS DAMAGE IN PLACENTAL VILLI INFECTED BY PLASMODIUM VIVAX. CASE REPORT.
Objective: The aim of this case report was to determine extensive hipoxic villous damage in a population of placental villi obtained from a placenta infected by Plasmodium vivax and treated with chloroquine quantifying the damage with relationship to another normal population no infected.
Methods: A protocol of observation was applied to the infected placenta which contained the variables that define the damage as syncytial knots, villous hypovascularity and villous fibrosis whose percentage in the placenta studied and control were tested statistically to evaluate significative differences. Ten slides were stained with hematoxilin and eosine by placenta and the percentage by each variable was determined in 100 terminal villi.
Results: Placenta with P.vivax presented percentages between 29 y 58% of syncytial knots; the control was of 3 y 24%.Stromal fibrosis between 12 y 49%; the control 1y 7%.The hypovascularity was of 49 y 84%; the control of 7 y 18%. Intervillous thrombosis, occlusion of the lumen of troncal villi, infarcts and chorangiosis were observed in the infected placenta but no in the control.
Conclusions: These findings suggest an extensive hipoxic villous damage in villi infected by P.vivax while those of control are normoxic. This damage could prevent the supply of nutrients and gases which stimulate at level fetal the intrauterine growth restriction with abnormal low weight at birth.
KEY WORDS: Hipoxic villous damage. Placenta. P.vivax.
INTRODUCCIÓN
La malaria durante el embarazo puede tener consecuencias devastadoras en el desarrollo fetal. No obstante el rutinario diagnostico y tratamiento oportuno en la etapa prenatal justifica el tratamiento con cloroquina en áreas endémicas para evitar la malaria congénita.
El daño velloso hipoxico extenso ha sido descrito y diagnosticado cuando una o más de las siguientes lesiones estuvo presente en más del 30% de la vellosidad terminal: nódulos sincitiales aumentados, proliferación de células x citotrofoblásticas, hipovascularidad vellosa, fibrosis vellosa y engrosamiento de la membrana basal trofoblástica de la vellosidad en regiones de cotiledones centrales, normales1. Este ha sido determinado en desordenes hipertensivos asociados a restricciones del crecimiento intrauterino (RCIU)2.
Se conoce que de todos los casos de malaria estudiados en las dos décadas desde 1988 hasta el 2007 acá en Venezuela, aproximadamente, el 80% de casos fueron atribuidos a P.vivax4. La incidencia de malaria en mujeres embarazadas en una región endémica minera venezolana fue del 87% para P.vivax. Infección aparecida en un 41.5% durante el segundo trimestre en un estudio donde se registró un caso de malaria placentaria en 449 mujeres embarazadas5.
Globalmente, a nivel mundial, hubo un estimado de 92.9 millones de embarazadas ocurrido en áreas endémicas por P.vivax en el año 20076 y la exposición anual de al menos 50 millones de embarazadas a los efectos de la infección7 es una situación de alto riesgo que pudiera tener consecuencias aniquiladoras para el desarrollo fetal. La patogénesis de la malaria placentaria apenas está parcialmente entendida.
Los rasgos histopatológicos más resaltantes que han sido encontrados en la placenta infectada por P.vivax según trabajo previamente realizado 3 son los siguientes: infartos, nódulos sincitiales, pérdida de la organización del estroma de la vellosidad, edema, dilatación o expansión capilar, eritrocitos nucleados, cambios degenerativos en la pared de los vasos de vellosidades troncales, trofoblasto muy delgado, degenerado o necrótico, deposición de fibrinoide, calcificación distrófica afectando la estructura de la vellosidad en general y el patrón morfológico de ramificación anormal de vellosidades globulosas.
Estos cambios notados en el análisis de una placenta, infectada en el tercer trimestre, con extremada vasodilatación indicando una probable reacción isquémica o hipóxica y confirmada por la presencia de eritrocitos nucleados, nos llevó a considerar la cuantificación del daño hipóxico el cual pudiera ser responsable, en parte, del bajo peso del recién nacido 3.
Nos proponemos determinar cuantitativamente este daño en una población de vellosidades afectadas por Plasmodium vivax de una placenta de paciente de 25 años, primigesta, que infectaba por primera vez, procedente de una zona endémica de malaria conocida como "El Paují", Edo. Bolívar y quien recibió a las 8 semanas antes del parto tratamiento con cloroquina por presentar crisis palúdica3.
El objetivo de este estudio fue determinar si hay daño hipóxico extenso en una población de vellosidades presentes en una placenta infectada por P.vivax tratada con cloroquina cuantificando el daño en relación a otra población normal no infectada.
CASO CLÍNICO
Paciente de 25 años, primigesta,de la zona endémica del Paují, Santa Elena de Uairén, Icaburú, Edo. Bolivar, a las 37s de embarazo, quien se infectó por primera vez, durante el tercer trimestre, con diagnóstico fehaciente positivo de infección por P.vivax mediante examen de gota gruesa y extendido de sangre periférica materna por experto malariólogo. Este técnico especializado de la unidad de malariología del Ministerio de la Salud y Desarrollo Social recibió la placenta en el Edo. Aragua y la envió al Laboratorio de Microscopía Electrónica del CIADANA para su estudio.
A las ocho semanas antes del parto la paciente recibió tratamiento con cloroquina por presentar crisis palúdica que comenzó con escalofríos seguidos de fiebre, sudoración y fiebre intermitente e irregular. La paciente se trató con dosis habitual de 10 tabletas en la fase terapéutica radical y se continuó con la dosis supresiva de 2 tabletas semanales durante 4 semanas, recibiendo un total de 18 tabletas. El historial clínico no informa de otro evento clínico ocurrido durante el embarazo. No se midieron niveles de parasitemia. La placenta pesó 480 gr y su espesor fue de 27 mm.
El neonato pesó 2200 gr. No se conocieron las características de madurez y bienestar fetal al nacer. El diagnóstico de P.vivax en gota gruesa y extendido resultó negativo para el recién nacido masculino de bajo peso cuya madre se retiró de la zona endémica aparentemente sana. El estudio histológico fue realizado con conocimiento de los resultados del examen parasitológico de sangre periférica materna. Por razones obvias no se conocieron valores de parasitemia placentaria durante el embarazo.
Otra población tomada de placenta de embarazada a término normal, de la misma zona endémica, sin infección malárica ni tratamiento con cloroquina se utilizó para comparar como control a las 37 semanas de embarazo. En ambas embarazadas un consentimiento informado fue presentado para cumplir con la declaración de Helsinki sobre los aspectos bioéticos de la investigación y el comité de ética de nuestra institución.
Se tomaron diez biopsias del tejido para preparar diez bloques de parafina, de la zona materna de la placenta correspondientes a cuatro regiones marginales, cuatro regiones intermedias y dos regiones centrales. Lo mismo se hizo para el control tomado a la misma edad gestacional sin complicaciones clínicas. De cada biopsia se realizó una lámina con la técnica de H&E. Un protocolo de observaciones fue planificado con tres de los criterios utilizados para el diagnóstico de daño velloso hipóxico extenso a saber: nódulos sincitiales, hipovascularidad y fibrosis estromal. El protocolo se aplicó a la placenta infectada y a la placenta normal.
La hipovascularidad fue considerada tomando en cuenta el número de vasos observados en un corte transversal visto en las láminas histológicas. Si el corte, en vellosidades terminales, presentaba de 0 a 3 vasos se consideraba hipovascular; de 4 a 6 hipervascular. Esta variable se observó con el objetivo de 40x; las otras dos variables se observaron con el objetivo de 10x. En la primera lámina, por ejemplo, se observaron diez campos, contándose el número de nódulos que aparecían por campo en cada vellosidad hasta contabilizar 100 vellosidades para obtener un porcentaje; luego se determinó en 100 vellosidades terminales las que poseían de 0 a 3 vasos por corte y se anotó el porcentaje. Lo mismo para la variable fibrosis estromal. El mismo protocolo se aplicó a la placenta normal. En 3000 vellosidades terminales infectadas y 3000 normales se determinó el daño velloso hipóxico extenso. La prueba paramétrica para diferencia de grupos de "t student" fue aplicada a los porcentajes obtenidos en las tres variables tanto del grupo estudio como del control. Según los datos de la estadística descriptiva se calcularon los promedios de las diez mediciones realizadas, la desviación standart, el error standart y la probabilidad para detectar si las diferencias entre las tres variables observadas en los porcentajes eran realmente significativas entre los dos grupos de vellosidades.
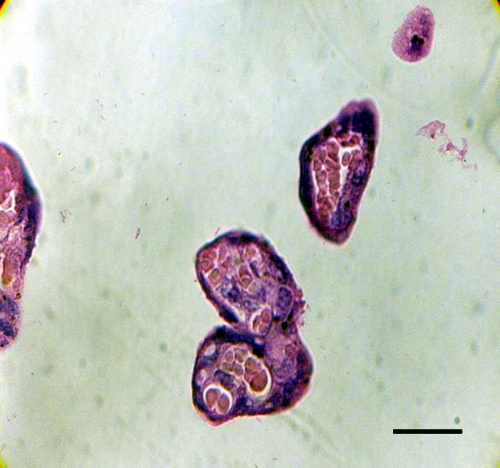
El porcentaje de nódulos sincitiales (Fig.1) en la placenta con P.vivax tuvo una variabilidad entre un 29% y 58%; en cambio en la placenta control estuvo entre 3% y 24% según vemos en el cuadro 1.
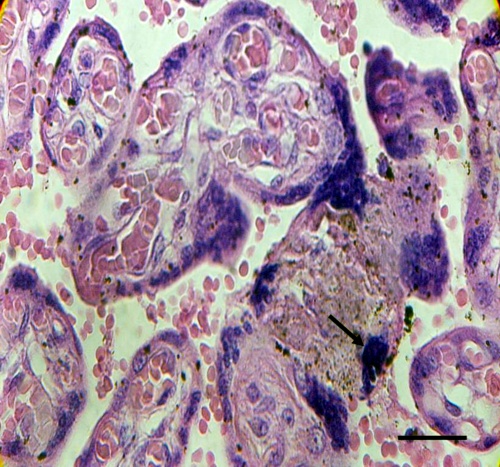
Fig.1. Un incrementado número de nódulos sincitiales (Flecha) son observados en la microfotografía de luz teñida con H&E. Barra: 35µm
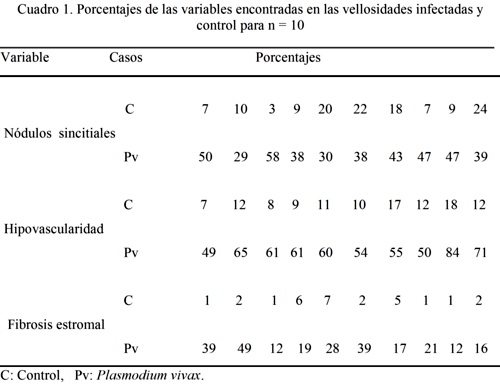
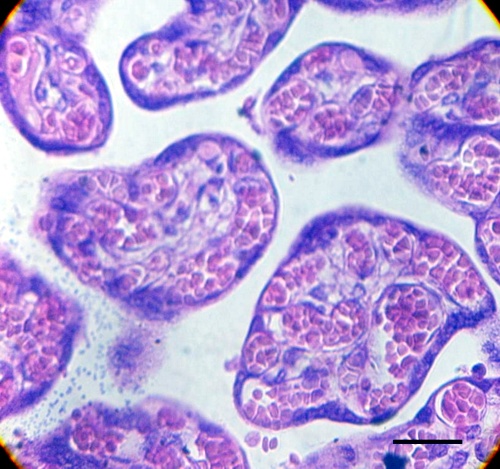
La fibrosis estromal (Fig.2) en la placenta estudiada entre un porcentaje del 12% y un 49%; en la placenta control entre el 1% y 7%. La hipovascularidad (Fig.3) de la placenta infectada estuvo entre el 49% y un 84%; la correspondiente al control entre 7% y 18%. Los valores encontrados en las tres variables, indicadoras de hipoxia en la vellosidad placentaria, fluctúan en mayor proporción en la placenta infectada cuando se compara con los valores de la normal. La prueba de t student aplicada a estos resultados puede verse en el cuadro 2 de estadísticos descriptivos para las tres variables. Los valores de P indicaron diferencias altamente significativas.
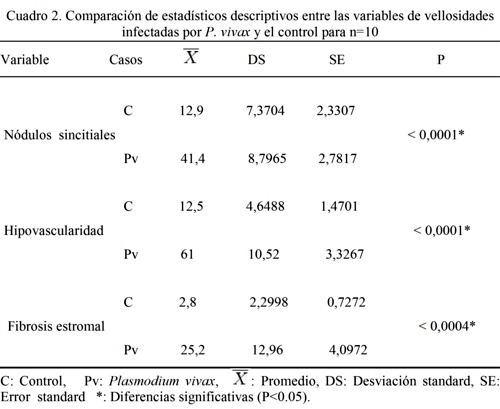
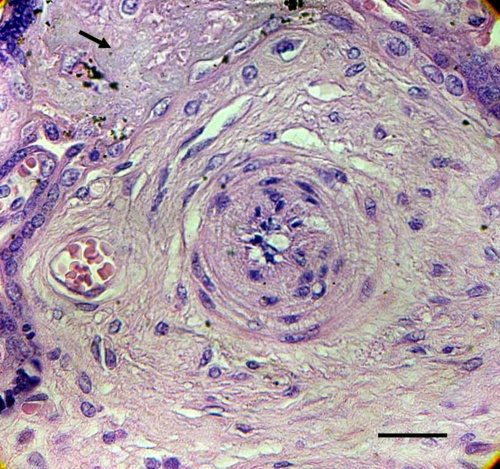
Fig.2. La región superior izquierda muestra zona fibrótica (Flecha) de vellosidad asociada a otra troncal que muestra cambios degenerativos de la íntima y la media de un vaso de vellosidad troncal cuya luz está ocluida. Barra: 35µm
Cuando las láminas eran observadas también se notó trombosis intervellosa (Fig.4), oclusión de la luz de los vasos de vellosidades troncales (Fig.2), infartos placentarios (Fig.5) y corangiosis (Fig.6), en la placenta infectada por P.vivax. Los controles no mostraron estas características.
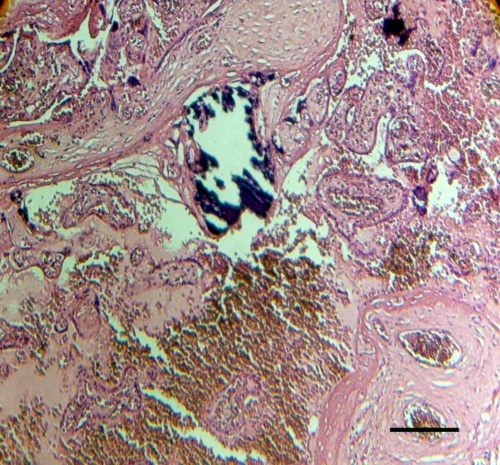
Fig.4. Trombosis intervellosa se observa entre zonas de vellosidades degeneradas. Regiones de calcificación también están presentes. Barra: 144µm
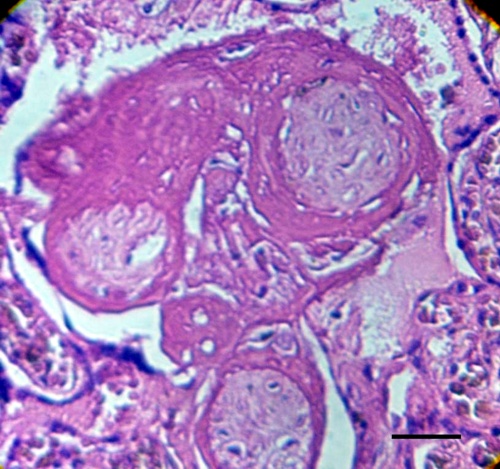
Fig.5. Vellosidades fibróticas rodeadas por deposición de sustancia fibrinoide en una región de infarto placentario. Barra: 48µm
DISCUSIÓN
De acuerdo con Kingdom and Kaufmann8 el tipo de hipoxia que está ocurriendo en la unidad feto-placentaria de este caso de placenta infectada por P.vivax es la hipoxia post placentaria ya que la placenta manifiesta rasgos de mala perfusión placentaria debido a la obstrucción de vasos feto placentarios; la hipovascularidad encontrada es reflejo de que hay una reducción en la expresión de factores de crecimiento endotelio vascular manifestada por una angiogénesis reducida. Los capilares vellosos están pobremente desarrollados y la absorción de gases y nutrientes está disminuida creando en el espacio intervelloso una concentración elevada de oxígeno, situación conocida como "hyperoxia" que no favorece la angiogénesis. El daño hipóxico medido mantiene al feto en una condición de hipoxia mientras que la madre está normóxica. Esta situación, donde elevados niveles de oxígeno intraplacentario que impiden el normal crecimiento de la vellosidad es causa de severa RCIU1.
El alto porcentaje de nódulos sincitiales, fibrosis estromal e hipovascularidad vellosa encontrada en la placenta infectada es indicativo de que las vellosidades van hacia una necrosis tisular que disminuye su número y la situación antes mencionada se agrava. La presencia de nódulos expresa el camino del sincitio hacia la apoptosis y la hipovascularidad la falta de vasos fetales para absorber nutrientes con la subsecuente formación de una vellosidad fibrótica asociada a deposición de fibrinoide 1.
Durante mucho tiempo se consideró la infección por P.vivax como benigna en razón de que los eritrocitos infectados no secuestraban en el espacio intervelloso debido a fallas de adherencia a diferencia de lo que ocurría con P.falciparum; ahora es causa de malaria severa y fatal en regiones endémicas9. El aumentado número de severas manifestaciones de infecciones por P.vivax similares a las observadas por P. falciparum sugieren que hay mecanismos de adhesión que ambos comparten y que la fuerza de la interacción con los vasos sanguíneos es similar pero inferior en P.vivax capaz de adherirse también a células endoteliales de pulmón, cerebro y placentarias10. La severidad resulta de la adhesión y secuestración en la vasculatura así como de la liberación de moléculas bioactivas junto con la respuesta inflamatoria del huésped mediante la producción de citocinas y quimiocinas11.
La oclusión de la luz en los vasos de vellosidades troncales nos revela mala perfusión sanguínea en las vellosidades terminales lo que determina la vía hacia la apoptosis del trofoblasto y en consecuencia la vellosidad pierde la estructura para la absorción de gases y nutrientes3, 10. La trombosis intervellosa probablemente haya sido originada por obstrucción de los vasos utero-placentarios por eritrocitos secuestrados en ellos reduciéndose el flujo hacia el espacio intervelloso. Esto contribuye con la formación de infartos3 incrementándose la hipoxia ante la cual la placenta en un mecanismo fisiológico de compensar la escasez de oxígeno, en algunas regiones, reacciona mediante un proceso de hipercapilarización del estroma de la vellosidad o corangiosis como la aquí demostrada.
Los efectos del paludismo por P.vivax durante el embarazo se conocían muy poco en referencia al proceso patogénico de la infección y la correspondiente respuesta inmune12-13. Hoy en día se describen como anemia materna y bajo peso al nacer los principales efectos aunque los abortos, nacidos muertos o prematuros no son frecuentes cuando se comparan con los efectos de P. falciparum14. El decrecimiento del peso del recién nacido suele ser mayor en multigravidas12. Cualquier mujer embarazada menor de 20 años, primigesta, primoinfectada puede estar en riesgo de aborto, amenaza de aborto o de nacimiento prematuro en regiones donde el P.vivax tiene un 78.69% de episodios o ataques de malaria en la población15. Recientemente se reportó la presencia de hemorragia retinal16. Los efectos del paludismo durante el embarazo son ahora bien documentados.
En zonas de baja transmisión de malaria los cambios placentarios como aumentado número de células inflamatorias, deposición de fibrina, prominencia de células citotrofoblásticas y nódulos sincitiales fueron significativamente mayor en mujeres infectadas con P. falciparum comparadas con mujeres infectadas con P.vivax17. Siendo los cambios menores con P.vivax no se explica el porqué existe también una similar reducción de peso en el nacimiento lo que ha llevado a la afirmación de que el daño patológico persistente en la placenta, como el aquí demostrado, no es el factor más determinante en la reducción del peso. Infecciones con ambas especies de plasmodios (infecciones mixtas) no resultaron en cambios placentarios diferentes de aquellos producidos por P. falciparum solo. Así se afirma que el efecto sobre la reducción de peso en el recién nacido no puede resultar de la presencia física de cambios placentarios irreversibles sino más bien de un insulto inmunológico agudo17.
En el caso acá estudiado el crecimiento placentario está restringido por la presencia de trombos seriados en la vasculatura de la placa corial3 y la obstrucción de vasos en las vellosidades troncales provocada posiblemente por la presencia de eritrocitos infectados con tendencia a la agregación o por la adherencia por largo tiempo en la vasculatura placentaria permaneciendo allí secuestrados14. La literatura, en general, señala que trombosis de vasos troncales es indicativa de insuficiencia placentaria grave que contribuye con disminucón del peso al nacer.
La hipoxemia así originada restringe el crecimiento fetal y ha sido correlacionada con la falta de flujo en la arteria umbilical: un indicador de restricción del crecimiento intrauterino. Cuando esto ocurre hay pérdida de aminoácidos esenciales desde el feto hacia la placenta lo que explicaría la pérdida de peso en estos casos18.
Estudios de biología molecular realizados con factores de crecimiento que afectan el desarrollo de los vasos de la vellosidad y factores que inducen hipoxia en ella no han aclarado el papel de la hipoxia en la placenta malárica que pudiera explicar la RCIU fetal19. Nuestro estudio exhibe la evidencia de que la hipoxia juega un papel en la placenta malárica que pudiera estar asociada,entre otros factores, a la disminución del peso del recién nacido. En efecto, la presencia de lesiones hipóxico-isquémicas caracterizadas en la literatura por incrementada presencia de citotrofoblastos y eritrocitos nucleados en los vasos estromales de las vellosidades; así como el incrementado número de nódulos sincitiales considerados como una adaptación fisiológica a la hipoxia20-21 aquí observados los cuales se localizan en regiones donde el espacio intervelloso esta disminuido u ocluido; más la presencia de vellosidades avasculares o fibróticas han indicado un ambiente propio de bajas tensiones de oxigeno que pronosticarían bajo peso al nacer.
Si la cloroquina ha resultado ser inocua e inalterable22-23 en el embarazo, estos cambios serían producto de la acción inicial de la infección por P.vivax en el espacio intevelloso donde eritrocitos infectados, probablemente, provocaron una infiltración inflamatoria intervellosa mononuclear masiva, con la subsiguiente producción de interleucinas que pueden también estar asociadas con el bajo peso al nacer. Una alteración del equilibrio de citocinas y quimiocinas como descrita para P.falciparum estaría dañando la placenta según los nuevos avances de la biología molecular24. Por otro lado, utilizando un método nuevo de clasificación histológica mediante secciones congeladas, fijadas e incluidas en parafina se ha tratado de asociar la inflamación y la cantidad de pigmento malárico depositado en el espacio intervelloso con el peso al nacer en placentas afectadas por P.falciparum25.
CONCLUSIONES
El daño velloso hipóxico extenso encontrado en la estructura de las vellosidades placentarias infectadas por P.vivax es mayor que el presentado en las vellosidades de la placenta normal lo cual posiblement estaría impidiendo el suministro de gases y nutrientes que asociado a otros factores desconocidos estimularía a nivel fetal la subsiguiente pérdida de peso fetal.
REFERENCIAS
1.- Benirschke K, Kaufmann P. Pathology of the human placenta. 4th edition- New York: Springer-Verlag; 2000.
2.- Ferrari E, Bulfamante G, Mezzopane R, Barbera A, Ghidini A, Pardi G. Uterine doppler velocimetry and placental hipoxic-ischemic lesion in pregnancies with fetal intrauterine growth restriction. Placenta 1999; 20:389-394.
3.- Castejon S O C, Molinaro VMP, de Zamora MG. La vellosidad placentaria en el caso de primigesta infectada por Plasmodium vivax y tratada con cloroquina. Gac Med Caracas 2001; 109:345-351.
4.- Metzger WG, Giron AM, Vivas MS, González J, Charrasco AJ, Mordmuller BG et al. A rapid malaria appraisal in the Venezuelan Amazon. Malar J 2009;8:291
5.- Gómez E, López E, Ache A. Malaria and pregnancy. San Isidro Parish, Municipality Sifontes, State of Bolivar, Venezuela 2005-2006. Invest Clin 2009; 50:455-464.
6.- Dellicour S, Tatem AJ, Guerra CA, Snow RW, t Kuile FO. Quantifyng the number of pregnancies at risk of malaria in 2007: A demographic study. Plos Med 2010; 7: e 1000221.
7.- Brabin BJ, Romagosa C, Abdelgalil S, Menendez C, Verhoeff FA, McGready R et al. The sick placenta -the role of malaria. Placenta 2004; 25:359-378.
8.- Kingdom JCP, Kaufmann P. Oxygen and placental villous development: origen of fetal hypoxia. Placenta 1997; 18:613-621.
9.- Anstey NM, Russell B, Yeo TW, Price RN. The pathophysiology of vivax malaria. Trends Parasitol 2009; 25:220-227.
10.- Carvalho BO, López SC, Nogueira PA, Orlando PP, Bargieri DY, Blanco YC et al. On the cytoadhesion of plasmodium vivax-infected erythrocytes. J Infect Dis 2010; 202:638-647.
11.- Mackintosch CL, Beeson JG, Marsh K. Clinical features and pathogenesis of severe malaria. Trends Parasitol 2004; 20:597-603.
12.- Nosten F, McGready R, Simpson JA, Thwai KL, Balkan S, Cho T et al. Effects of plasmodium vivax malaria in pregnancy. Lancet 1999; 354:546-549.
13.- Beeson JG, Duffy PE. The immunology and pathogenesis of malaria during pregnancy. Curr Top Microbiol Immunol 2005; 297:187-227.
14.- Rodríguez MAJ, Sanchez E, Vargas M, Piccolo C, Colina R, Arria M et al. Pregnancy outcomes associated with Plasmodium vivax malaria in northeastern Venezuela. Am J Trop Med Hyg 2006; 74:755-757.
15.- Chagas EC, do Nascimento CT, de Santana Filho FS, Botto Menezes CH, Martinez Espinosa FE. Impact of malaria during pregnancy in the Amazon region. Rev Panam Salud Pública 2009; 26:203-208.
16.- Lee JH, Chin HS, Cheng MH, Moon YS. Retinal hemorrhage in Plasmodium vivax malaria. Am J Trop Med Hyg 2010; 82:219-222.
17.- McGready R, Davison BB,Stepniewskak K, Cho T, Shee H, Brockman A et al. The effects of Plasmodium vivax infections on placental histopathology in an area of low malaria transmisión. Am J Trop Med Hyg 2004; 70:398-407.
18.- Robinson JS, Owens J. Placenta y crecimiento intrauterino retardado. En: Redman CWG, Sargent IL, Starkey PM (eds).La placenta humana. Barcelona: Masón SA, 1995.p.445-460.
19.- Boeuf P, Tan A, Romagosa C, Radford J, Mwapasa V, Molyneux ME et al. Placental hypoxia during placental malaria. J Infect Dis 2008; 197: 757-766.
20.- Heazell AEB, Moll SJ, Jones CJP, Baker PN, Crocker IP. Formation of syncytial knots is increased by hyperoxia, hypoxia and reactive oxygen species. Placenta 2007; 28:S33-S40.
21.- Crocker IP, Janner OM, Myers JE, Bulmer JN, Walraven G, Baker PN. Syncytiotrophoblast degradation and the pathophysiology of the malaria infected placenta. Placenta 2004; 25: 273-282.
22.- Taylor WR, White NJ. Antimalarial drug toxicity: A review. Drug Saf 2004; 27:25-61.
23.- McGready R, Thwai KL, Cho T, Samuel, Looreesuwan S, White NJ, et al. The effects of quinine and chloroquine antimalarial treatments in the first trimester of pregnancy. Trans R Soc Trop Med Hyg 2002; 96:180-184.
24.- Mens PF, Bojtor EC, Schallig HD.Molecular interactions in the placenta during malaria infection.Eur J Obstet Gynecol Reprod Biol 2010;152:126-132.
25.- Muehlenbachs A, Fried M, McGready R, Harrington WE, Mutabinwa TK, Nosten F et al. A novel histological grading scheme for placental malaria applied in areas of high and low malaria transmission. J Infect Dis 2010;202:1608-1616
AGRADECIMIENTO: al Dr. Edinson Vivas por la placenta obtenida en el Ambulatorio AR-1 de El Paují, Sta. Elena de Uairén; al Asistente de Enfermería Douglas Scott por facilitar información médica; al Inspector de Malariología Alex Briceño por el diagnóstico específico del P.vivax y personal técnico del Servicio de Diagnóstico de la sección de Malariología del Ministerio de Salud y Desarrollo Social, Maracay, Edo. Aragua. A la coordinación administrativa por el fondo fijo institucional de la Facultad de Ciencias de la Salud para el CIADANA.
CORRESPONDENCIA:
Prof. Olivar C Castejón.
Profesor Titular en Biología Celular.
Director del CIADANA. Laboratorio de Microscopía Electrónica.
Facultad de Ciencias de la Salud. Universidad de Carabobo - Núcleo Aragua.
Centro de Investigación y Análisis Docente Asistencial del Núcleo Aragua (CIADANA). Maracay, Edo. Aragua, Venezuela. Apdo. 4944.
E-mail: olivar.ciadanauc @ gmail.com
Recibido, 29 de marzo de 2011. Recibido revisado, 28 de abril de 2011
Publicado, 30 de abril de 2011