Indice del volumen Volume index
Comité Editorial Editorial Board
Comité Científico Scientific Committee
NIVELES DE INDOLAMINA-2.3-DIOXIGENASA EN INDIVIDUOS SANOS ADULTOS.
Pilar Muñiz PhD1,2, Mónica Cavia PhD1, Silvia Ruiz-Crespo BS1, Celia Guerrero BS1, Marta Herreros PhD, María Jesús Coma MD PhD.1
1Unidad de Investigación del Hospital General Yagüe. Complejo Asistencial Universitario de Burgos.
2Departamento de Bioquímica y Biología Molecular. Universidad de Burgos.
Burgos. España
cavia @ hgy.es
Rev Electron Biomed / Electron J Biomed 2011;1:14-18.
Comentario del revisor Silvia Albillos García PhD. Investigadora postdoctoral Instituto de Biotecnología de León (INBIOTEC). León. España
Comentario del revisor Victoria Valls Bellés PhD. Investigadora del Departamento de Pediatría, Ginecología y Obstreticia de la Universidad de Valencia. Valencia. España.
RESUMEN:
Objetivo: Estudio de los niveles de Indolamina-2.3-dioxigenasa (IDO) plasmáticos en una población de donantes de Burgos y compararlos con los obtenidos por otros autores
Población y métodos: La actividad IDO se expresa en niveles de quinurenina medido mediante la técnica de HPLC-visible. Han participado de modo voluntario 69 donantes de sangre, todos ellos firmaron el consentimiento después de ser informados tanto de forma oral como escrita sobre el estudio que se iba a realizar.
Resultados: Los resultados obtenidos muestran una gran homogeneidad en los resultados obtenidos por los diferentes grupos investigadores.
PALABRAS CLAVE: Kinureína. Indolamina-2,3-dioxigenasa. Donantes. Plasma.
SUMMARY: LEVELS OF INDOLEAMINE-2.3-DIOXYGENASE IN HEALTHY ADULTS.
Objective: The aim of this study was to evaluate Indolamine-2,to compare these result to those obtained by others authors.
Methods: IDO activity is expressed as kynurenine measured by HPLC-visible. In this study we included 69 blood donors, and all gave their signed informed consent.
Results: There was a great homogeneity in the results obtained by different research groups.
KEYWORDS: Kynurenine. Indolamine 2,3-dioxigenase. Donors. Plasmatic.
INTRODUCCIÓN
El triptófano es degradado en el hígado mediante la triptofano 2,3-dioxigenasa o en otros órganos por la Indolamina 2,3-dioxigenasa (IDO), expresada en varios tipos célulares, como células dendríticas, macrófagos, monocitos y células T del sistema inmune. También se ha observado que la IDO está sobreexpresada en una alta variedad de tumores humanos y algunos estudios lo correlacionan con la progresión de la enfermedad y a una reducción en la supervivencia.
La IDO está regulada por varios estímulos inflamatorios, y tiene un conocido efecto inmunosupresor, induciendo inmunotolerancia, y suprimiendo la actividad de las células T1. Su función hasta ahora no es enteramente conocida. Se sugiere que la IDO tiene capacidad de regular el sistema inmune a través de dos vías: una, mediante la deprivación de triptofano, que es esencial para la proliferación de linfocitos T y la otra por el efecto citotóxico de los metabolitos del triptófano.
La IDO cataliza la degradación oxidativa del triptófano al romper la unión del doble enlace en posición 2,3 en el anillo indólico dando lugar a N-formil-quinurenina, que es rápidamente metabolizada a quinurenina. En la mayoría de los estudios los niveles de quinurenina en plasma se cuantifican mediante la técnica de HPLC_UV, y son indicadores de la actividad IDO.
El incremento de a IDO como respuesta a estímulos inflamatorios ha llevado a describir su implicación en la aterosclerosis, especialmente en etapas tempranas de la misma2. También se ha observado que la IDO está sobreexpresda en una alta variedad de tumores humanos y algunos estudios lo correlacionan con la progresión de la enfermedad y a una reducción en la supervivencia3.
Para considerar los rangos a partir de los cuales se puede considerar que está alterado, se hace necesario antes establecer los niveles de quinurenina en plasma de individuos sanos. Con el objetivo de contribuir a establecer dichos valores, hemos realizado un estudio de los niveles de quinurenina en individuos sanos adultos, analizado los valores de un grupo de 69 donantes habituales altruístas de sangre de Burgos. Asimismo, hemos recopilando los valores de los controles publicados en distintos artículos científicos, obtenidos a través de las base de datos Pubmed, Scopus, ISI knowledge4-16.
MATERIAL Y METODOS
El estudio se realizó con muestras de sangre de 69 donantes habituales, voluntarios aparentemente sanos, que aceptaron participar en el estudio y que firmaron el consentimiento después de ser informados de forma oral y escrita el objetivo del estudio a realizar.
A los donantes seleccionados se les extrajo, con ocasión de su donación altruísta en la Unidad de Donantes, en el Hospital Divino Valles de Burgos, una sola y única muestra de sangre para la realización del estudio. Dicha muestra se recogió en tubos heparinizados, se centrifugó a 8000 rpm durante 6 minutos para la obtención de plasma que a su vez fue recogido y se mantuvo congelado a -80°C hasta el momento del análisis.
La medida de la actividad enzimática de IDO se realiza midiendo los niveles de quinurenina siguiendo el método desarrollado por Alegre y col.17. A partir de 200 µL de plasma y 100 µL de MLR se precipitaron las proteínas con 100 µL de ácido tricloroacético. La muestra se incubó a 100°C durante 10 minutos y se centrifugó a 2500g. La concentración de quinurenina de determinó mediante HPLC usando una columna Waters C18 (4.5mm x 15cm). Como fase móvil se utiliza tampón acetato de sodio 15mM, pH 4 y acetonitrilo 2.7%. La absorbancia se mide a 360nm y la concentración de quinurenina se expresa en µM.
RESULTADOS Y DISCUSIÓN
En nuestro medio, los valores obtenidos en los 69 individuos adultos, aparentemente sanos, correspondientes a la media y desviación estandar de la determinación de quinurerina fue de 1,54 ± 0,24 µmol/L.
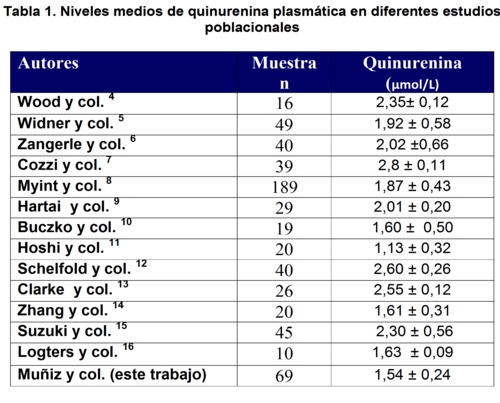
En la tabla 1 se resumen los niveles de quinurenina plasmática en las muestras de sangre de la población de donantes evaluada en Burgos, y los datos obtenidos en los diferentes artículos de la revisión bibliográfica efectuada, correspondiente a diferentes grupos de sujetos que fueron controles de diversos estudios realizados en poblaciones con patologías diversas. Asimismo, en la figura 1, se observa la representación gráfica de los valores de media y desviacion estandar obtenidas por dichos autores.
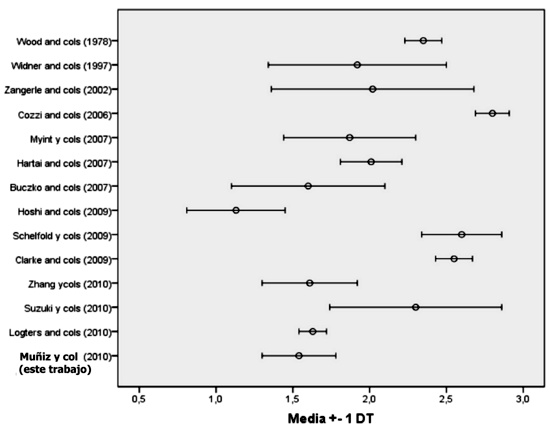
Figura 1. Valores de media y desviación estandar publicados por los diferentes autores referidos
Los resultados muestran los valores medios obtenidos de quinurenina en plasma, donde el valor medio más bajo fue el obtenido por Hoshi y col.11 con un valor de 1,13 y el más alto fue obtenido por Cozzi y col.7 que se corresponde a un valor de 2,80 µmol/L de quinurenina.
Así mismo, se observó una gran variabilidad en cuanto al tamaño de la población utilizada en los distintos estudios, con trabajos que utilizarón una población de n=10, y otros con valores de n=189, nuestro estudio se corresponde a una población intermedia de n=69.
Se observa tambien que la variabilidad de los valores obtenidos por los diferentes autores, es independiente del tamaño de la muestra.
REFERENCIAS
1.- López AS, Alegre E, Díaz-Lagares A, García-Girón C, Coma MJ, González A. Effect of 3-hydroxyanthranilic acid in the immunosuppressive molecules IDO and HLA-G in macrophages. Immunol Lett. 2008;117:91-95
2.- Pertovaara M, Raitala A, Juonala M et al. Indoleamine 2,3-dioxygenase enzyme activity correlates with risk factors for atherosclerosis. Clin Exp Immunol. 2007; 148:106-111.
3.- López AS, García-Girón C, Cavia M, López-Muñoz A, García-González M, Coma MJ, Muñiz P. Inmunotoleracia en tumores gastrointestinales. HLA-G e Indolamina, 2-3, dioxigensasa. Electron J Biomed 2007;3:59-65.
4.- Wood K, Harwood J, Coppen A. The Effect of Antidepressant Drugs on Plasma Kynurenine in Depressed Patients. Psychopharmacology 1978; 59: 263-266.
5.- Widner B, Werner ER, Schennach H, Wachter H, Fuchs D. Simultaneous measurement of serum tryptophan and kynurenine by HPLC. Clin Chem 1997;43:2424-2426.
6.- Zangerle R, Widner B, Quirchmair G, Neurauter G, Sarcletti M, Fuchs D. Effective Antiretroviral Therapy Reduces Degradation of Tryptophan in Patients with HIV-1 Infections Clin Immunol 2002; 104: 242-247.
7.- Cozzi A, Zignego AL, R, Carpendo R, Biagiotti T, Aldinucci A, Monti M, Giannini C, Rosselli M, Laffi G, Moroni F. Low serum tryptophan levels, reduced macrophage IDO activity and high frequency of psychopathology in HCV patients Viral Hepat. 2006; 13:402-408.
8.- Myint AM, Kim YK, Verkerk R, Scharpé S, Steinbusch H, Leonard B, Kynurenine pathway in major depression: Evidence of impaired neuroprotection Affect Disord. 2007; 98:143-151.
9.- Hartai Z, Juhasz A, Rimanoczy A, Janaky T, Donko T, Dux L, Penke B, Toth G, Janka Z, Kalman J. Decreased serum and red blood cell kynurenic acid levels in Alzheimer's disease. Neurochemistry International 2007; 50: 308-313.
10.- Buczko P, Tankiewicz-Kwedlo A , Buraczewska A , My?liwiec M, Pawlak D. Accumulation of kynurenine pathway metabolites in salive and plasma of uremic patients. Pharmacological Reports. 2007; 59:199-204.
11.- Hoshi M, Ito H, Fujigaki H, Takemura M, Takahashi T, Tomita E, Ohyama M, Tanaka R, Saito K, Seishima M. Indoleamine 2,3-dioxygenase is highly expressed in human adult T-cell leukemia/lymphoma and chemotherapy changes tryptophan catabolism in serum and reduced activity. Leuk Res. 2009; 33:39-45
12.- Schefold JC, Zeden JP, Pschowski R, Hammoud B, Fotopoulou C, Hasper D, Fusch G, Von Haehling S, Volk HD, Meisel C, Schütt C, Reinke P. Treatment with granulocyte-macrophage colony-stimulating factor is associated with reduced indoleamine 2,3-dioxygenase activity and kynurenine pathway catabolites in patients with severe sepsis and septic shock. Scand J Infect 2010; 42 :164-171.
13.- Clarke G, Fitzgerald P, Cryan JF, Cassidy EM, Quigley EM, Dinat TG. Tryptophan degradation in irritable bowel syndrome: evidence of indoleamine 2,3-dioxygenase activation in a male cohort. BMC Gastroenterol. 2009; 9:6
14.- Zhang X, Show A, He Y, Ding M. Simultaneous determination of tryptophan and kynurenine in plasma samples of children patients with Kawasaki disease by high-performance liquid chromatography with programmed wavelength ultraviolet detection. J Chromatogr B. 2009; 877: 1678-1682
15.- Suzuki Y, Suda T, Furuhashi K, Suzuki M, Fujie M, Hahimoto D, Nakamura Y, Inui N, Nakamura H, Chida K. Increased serum kynurenine/tryptophan ratio correlates with disease progression in lung cancer. Lung Cancer 2010;67: 361-365.
16.- Lögters TT, Laryea MD, Altrichter J, Sokolowski J, Cinatl J, Reipen J, Linhart W, Windolf J, Scholz M, Wild M. Increased plasma kynurenine values and kynurenine-tryptophan ratios after major trauma are early indicators for the development of sepsis. Shock. 2009;32:29-34
17.- Alegre E, López AS, González A. Tryptophan metabolites interfere with the Ehrlich reaction used for the measurement of kynurenine. Analitical Biochemistry 2005; 339:188-9
18.- Pertovaara M, Raitala A, Uusitalo H. Mechanisms dependent on tryptophan catabolism regulate immune responses in primary Sjögren's syndrome. Clin Exp Immunol. 2005;142:155-161
AGRADECIMIENTOS:
Al Servicio de Hematología y Hemoterapia, por su colaboración en el Banco de Sangre y las continuas facilidades que nos han dado.
Trabajo realizado con una ayuda de Caja Burgos, y la Gerencia Regional de Salud de la Junta de Castilla y León (GRS 389/A/09).
CORRESPONDENCIA:
Mónica Cavia
Unidad de Investigación
Hospital General Yagüe
Burgos. España.
Email: cavia @ hgy.es
