Indice del volumen Volume index
Comité Editorial Editorial Board
Comité Científico Scientific Committee
EFECTO DEL TRATAMIENTO CON OXALIPLATINO
SOBRE LOS NIVELES DE TIORREDOXINA Y DE LA
MOLÉCULA IDO (INDOLAMINA 2,3 DIOXIGENASA)
EN LINEAS CELULARES DE CÁNCER COLORRECTAL.
1Mónica Cavia PhD, 1Susana Gonzalez-Mateo,
1Carlos García Giron PhD, 2Pilar Muñiz PhD
1Unidad de Investigación del Hospital General Yagüe.
Complejo Asistencial Universitario de Burgos.
2Departamento de Bioquímica y Biología Molecular. Universidad de Burgos.
Burgos. España
cavia @ hgy.es
Rev Electron Biomed / Electron J Biomed 2012;1:37-40
Comentario de la revisora Dra Victoria Valls Belles. Investigadora del Departamento de Pediatría, Ginecología y Obstetricia de la Universidad de Valencia. Valencia. España.
Comentario de la revisora Ana Sofía López González PhD. Doctora en Farmacia, Licenciada en Bioquímica y especialista en Bioquímica Clínica. Miranda de Ebro. Burgos. España.
RESUMEN:
Incrementos en la actividad de la enzima indoleamine-2-3dioxigenasa (IDO) y cambios en estado redox celular están implicados en las distintas etapas de la evolución del cáncer. Sin embargo, su relacion con los tratamientos quimioterápicos todavía no son conocidos. El objetivo de este estudio fue evaluar la respuesta al tratamiento con oxaliplatino de líneas celulares de cáncer colorrectal (Caco-2 y SW480) sobre la molécula inmunosupresora IDO y su relación con los niveles de Trx. Resultado de este estudio se observa una mayor actividad de la enzima IDO en las células Caco-2 que en las células metastásicas SW480 asociado a niveles más bajos del sistema tiorredoxina.
PALABRAS CLAVE:IDO. Tiorredoxina. Tiorredoxina reductasa. Cáncer
SUMMARY:
Increases in indoleamine-2-3-dyoxigenase activity and changes in redox state have been reported in cancer. However, their relationship with chemoterapy remains unknown. The aim of the present study was to evaluate the oxaliplatin treatment in colorectal cancer cell lines (Caco-2 and SW480) on the immunosuppressive molecule IDO and its relationship with the Trx/TrxR system. Results of this study was a higher IDO enzyme activity in Caco-2 cells than in SW480 cells associated with lower levels of the thioredoxin.
KEYWORDS: IDO. Thioredoxin. Thioredoxin reductase. Cancer
INTRODUCCIÓN
El cáncer colorrectal es una de las lesiones neoplásicas más frecuentes y entre los diferentes mecanismos implicados en el desarrollo y avance tumoral se incluyen el escape de las células tumorales a la respuesta del sistema inmune y cambios en el estado redox celular1,2. El oxaliplatino (cis (1R,2R)-1,2,-ciclohexanedimine-N-N') oxalato (2)-O,O'-platino tiene una fuerte actividad antiproliferativa especialmente en líneas de cáncer de colon. Entre los mecanismos de la acción tóxica del oxaliplatino está el estrés oxidativo, pudiendo interactuar sobre grupos tiólicos de proteínas recién sintetizadas haciéndolas sensibles a las especies oxigénicas reactivas3-4.
La tiorredoxina (Trx) es una proteína tiolica que elimina dichas especies además de actuar como regulador de proteínas reguladoras de la apoptosis5-7 mientras que la IDO está sobreexpresada en células tumorales estando implicada en la metástasis celular8. Por ello objetivo de este estudio fue evaluar el efecto del oxaliplatino sobre los niveles de la actividad IDO y sobre la TRx/TRxR en dos líneas celulares de cáncer colorrectal (Caco-2 y SW480).
MATERIAL Y MÉTODOS
Cultivos celulares: Las líneas celulares SW480 y Caco-2 fueron cultivadas con DMEN y 10% de suero fetal bovino, 1% de Penicilina (50U/ml)- Estreptomicina (50mg/ml) y 1% L-glutamina 2mM. Las células (30000 células/cm2) se mantuvieron a 37ºC y 5% CO2. Se estimuló la producción de IDO con interferón-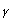 (750U/ml) y se incubaron en presencia y ausencia de oxaliplatino (5 µM).
(750U/ml) y se incubaron en presencia y ausencia de oxaliplatino (5 µM).
Determinación de la actividad IDO en cultivo celulares9: La concentración de quinureina se determinó mediante HPLC usando una columna Symetry Shiel RP (3.9 mm x 15 cm). Como fase móvil se utiliza tampón acetato de sodio 15 mM pH: 4 y acetonitrilo 2.7%. La absorbancia se midió a 360 nm y la concentración de quinureina se expresa en µM.
Determinación de los niveles de Trx/TrxR: Los niveles de tiorredoxina se determinó utilizando la técnica de ELISA (Redox Bioscience)10 usando anticuerpos monoclonales (mAb) anti-trx clone 2G11 y anti-Trx biotinilado como indicador del anticuerpo.
La actividad tiorredoxina reductasa se determinó usando el método de reducción de la insulina descrito por Holmgren y Bjornstedt11, siguiendo la actividad de la enzima espectrofotométricamente a 412 nm.
RESULTADOS Y DISCUSIÓN
En primer lugar evaluamos el tratamiento de ambas líneas celulares con oxaliplatino, en las condiciones descritas en material y métodos, sobre la viabilidad celular. Los resultados muestran una disminución de la viabilidad celular en ambas líneas, de un 54% en las células Caco-2 y de un 57% en las células SW680 independiente de la presencia de interferón en el medio.
La actividad IDO expresada como niveles de quinuereina en presencia y ausencia de oxaliplatino se muestra en la Figura 1. Los resultados muestran que los niveles de quinureina en el medio de células metastásicas SW480 son más altos que en la células Caco-2 y el tratamiento con interferón incrementa significativamente la actividad de la enzima en ambas líneas celulares, destacando el incremento en la línea Caco-2. Estos resultados apoyan la idea de que en las células tumorales la actividad de la IDO está relacionado con el ambiente inmunosupresor y sus niveles pueden estar relacionados con el potencial metatásico de las células.
 |
 |
Los resultados son media ± SD de n=3. *p < 0.005
La proteína tiólica tiorredoxina (Trx) es un biomarcador que opera en sinergia con la enzima tiorredoxina reductasa (TrxR) jugando un papel en el mantenimiento del estado redox celular. La proteína tiorredoxina es liberada al medio en respuesta a un incremento del estrés oxidativo, actuando como regulador del crecimiento y/o apoptosis celular. Los niveles de tiorredoxina (figura 2 A) y los niveles de tiorredoxina reductasa (figura 2B) en el medio de las células SW480 al ser células en metástasis fueron significativamente más altos que las células Caco-2.
 |
 |
Los resultados son media ± SD de n=3. *p < 0.005. Letras diferentes indica diferencia significativa dentro de la misma línea celular.
El tratamiento con oxaliplatino no modifica los niveles de tiorredoxina ni TrxR en las células Caco-2, sin embargo en la linea celular SW480 los niveles de ambas son más bajos aunque la diferencia solo es significativa para la actividad tiorredoxina reductasa independiente de la presencia o no de interferón en el medio.
Estos resultados nos permiten concluir que el tratamiento con oxilaplatino reduce los niveles de quinureina y de la relación Trx/TrxR en las células metastásicas.
REFERENCIAS
1. Cavia M, Muñiz P, DeSantiago R, Herreros-Villanueva M., García-Giron C., López AS, Coma MJ, Changes in the levels of thioredoxin and indoleamine-2,3-dioxygenase activity in plasma patients with colorectal cancer treated with chemotherapy. Biochem Cell Biol 2012; 90: 1-7.
2. Uyttenhove C. Evidence for a tumoral immune resistance mechanism based on tryptophan degradation by indoleamine 2,3-dioxygenase. Nat Med 2003; 9: 1269-1274.
3. Valko M, Leibfritz D, Moncol J, Cronin MT, Mazur M, Telser J. Free radicals and antioxidants in normal physiological functions and human disease. Int J Biochem Cell Biol. 2007;39:44-84.
4. Oliva MR, Ripoll F, Muñiz P, Iradi A, Trullenque R, Valls V, Drehmer E, Sáez GT. Genetic alterations and oxidative metabolism in sporadic colorectal tumors from a Spanish community. Mol Carcinog. 1997;18:232-243.
5. Biaglow JE, Miller RA. The thioredoxin reductase/thioredoxin system: novel redox targets for cancer therapy. Cancer Biol Ther. 2005;4:6-13.
6. Fujino G, Noguchi T, Takeda K, Ichijo H. Thioredoxin and protein kinases in redox signaling. Semin Cancer Biol. 2006;16:427-435.
7. Lu J, Chew EH, Holmgren A. Targeting thioredoxin reductase is a basis for cancer therapy by arsenic trioxide. Proc Natl Acad Sci U S A. 2007;104:12288-12293.
8. Munn DH. Indoleamine 2,3-dioxygenase, tumor-induced tolerance and counter-regulation. Curr Opin Immunol 2006; 18:220-225
9. Alegre E, López AS, González A. Tryptophan metabolites interfere with the Ehrlich reaction used for the measurement of kynurenine. Analitical Biochemistry 2005;339:188-9
10. Soderberg A, Sahaf B, Rosen A. Thioredoxin reductase, a redox-active selenoproein, is secreted by normal and neoplastic cells: presence in human plasma. Cancer Res 2000; 60: 2281-2289.
11. Holmgren A, Björnstedt M. Thioredoxin and thioredoxin reductase. Methods Enzymol 1995; 252: 191-208.
CORRESPONDENCIA:
Monica Cavia Saiz
Unidad de Investigación del Complejo Asistencial Universitario de Burgos
Burgos. España
Email: cavia @ hgy.es
