Indice del volumen Volume index
Comité Editorial Editorial Board
Comité Científico Scientific Committee
- Influjo de iones
- Fragmentación de ADN
- Morfología nuclear
-
1.- Normal
2.- Condensado
3.- Cuerpos apoptóticos - Índice Mitótico
DERIVADOS DEL 2-FURILETILENO INDUCEN LA MUERTE CELULAR PROGRAMADA EN CÉLULAS CHO DE MAMÍFERO
Oscar C. Hernández MDa, Hector Pimentel MSc.b, Llanetsy Llanes MDb, Sandra Fernándeza, Nayadis Vazquez a, Gisselle C.Perez MD c.
a Centro de Inmunología y Productos Biológicos (CENIPBI),
Universidad Médica, Camagüey.
bUniversidad Ciencias Médicas Camagüey. Departamento de Farmacología.
c Centro de Bioactivos Químicos (CBQ), Universidad Central de Las Villas.
Villa Clara. Cuba.
oscar.hernandez1964 @ yahoo.es
Rev Electron Biomed / Electron J Biomed 2012;2:27-37.
Comentario de la revisora Dra. Larisa Ivón Carrera. Profesora e Investigadora, Facultad de Ciencias Médicas, Universidad Nacional del Litoral, Santa Fe (Argentina)
Comentario de la revisora Dra. María Cristina Tarrés. Profesora e Investigadora, Facultad de Ciencias Médicas, Universidad Nacional de Rosario, Rosario (Argentina)
RESUMEN:
Objetivo: evaluar los cambios morfofisiológicos que los productos sintéticos G1 y UC245, ocasionan sobre la línea celular CHO y su asociación con la apoptosis.
Material y Métodos: se midió el influjo de iones Ca2+, la fragmentación de ADN cromosomal en geles de agarosa 1,8%, y se midió el índice mitótico (IM) de estos compuestos como evidencia de apoptosis inducidas.
Resultados: se evidenció por primera vez las variaciones morfofuncionales ocasionadas en un modelo celular in vitro por los productos ensayados y se mostraron las marcas moleculares y morfológicas más utilizadas en la actualidad para confirmar la inducción de una muerte celular programada o apoptosis.
Conclusiones: las técnicas aquí utilizadas confirmarían el efecto inductor de la apoptosis de los productos sintéticos G1 y UC245.
PALABRAS CLAVE: Bromo. Apoptosis. Furiletileno. Fragmentación de ADN. Células. CHO. Índice mitótico.
SUMMARY: APOPTOSIS INDUCED BY 2-FURYLETHYLENE DERIVATIVES IN MAMMALIAN CHO CELLS
Aim: to evaluate the morphological and physiological changes induced by the synthesized products G1 and UC245 and the apoptotic process using CHO cell culture.
Material and Methods: the Ca2+ uptake, DNA fragmentation in 1,8% agarose gel electrophoresis, nuclear morphology and mitotic index were studied as evidence of programated death cell.
Results: the cytosolic Ca2+ increase and DNA fragmentation observed in association with nuclear morphology changes were consistent as molecular mark of apoptosis induced by the 2-furylethylene derivatives studied.
Conclusions: these two synthesized products could confirm an inductor effect on apoptotic mechanism of this cell line.
KEYWORDS: Bromine. Apoptosis. Furylethylene. DNA fragmentation. CHO. Mitotic index
INTRODUCCIÓN
El cáncer es la segunda causa de muerte a nivel mundial, después de las enfermedades cardíacas. Sin embargo, las muertes por enfermedades cardiovasculares están disminuyendo, mientras las provocadas por el cáncer van en aumento. Se estima que a lo largo del siglo XXI, el cáncer será la primera causa de muerte en los países desarrollados1.
Anualmente se diagnostican cerca de 10 millones de personas afectadas, y de ellas fallecen aproximadamente 7 millones; pero esta incidencia podría aumentar hasta el año 2020 en el que habría 15 millones de casos nuevos. En Cuba se detectan anualmente 29 000 casos y fallecen alrededor de 19 000 pacientes por esta patología. En el año 2009 la tasa de mortalidad nacional se elevó a 189.7 x 100 000 habitantes (21 316 fallecidos)2.
Hasta el momento no existen tratamientos completamente eficaces que logren la muerte selectiva de las células tumorales. Desde hace unos años, han surgido una serie de tratamientos alternativos denominados bioterapia del cáncer, sin embargo su efectividad y eficacia es limitada en la actualidad. Por este motivo existe una tendencia a la búsqueda y caracterización de nuevos productos, y otras terapias con mayor eficacia en el tratamiento de los diversos tipos de cáncer al inducir la apoptosis en células afectadas3-5.
El organismo humano se caracteriza por tener una marcada estabilidad para mantener el medio interno, lo cual depende de un adecuado control de los mecanismos que regulan la proliferación, diferenciación y muerte celular de las diferentes poblaciones celulares que tienen lugar en sus tejidos y órganos. La muerte celular consiste en la detención de los procesos biológicos de la célula, que produce cambios morfológicos, funcionales y bioquímicos irreversibles y le impiden realizar sus funciones vitales. Ella se produce continuamente en muchos tejidos de nuestro organismo y constituye un aspecto esencial para su desarrollo, mantenimiento y reparación6-10. Existen dos tipos de muerte celular: la patológica y la fisiológica a esta última llamada apoptosis11. Sin embargo investigaciones recientes evidencian que la necrosis, tradicionalmente considerada como una forma accidental de muerte celular, puede en ciertos casos ser iniciada o modulada por mecanismos programados de control y han aparecido indicios de otra subrutina necrótica regulable. En la muerte celular estimulada por TNF-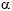 , con una inhibición previa de caspasas, la muerte celular no es evitada, pero adquiere una morfología necrótica, siendo denominada necroptosis. O sea que necrosis y apoptosis no son formas de muerte celular excluyentes, sino que pueden coincidir en determinados momentos del proceso degenerativo de algunos tipos celulares, como ocurre en la muerte neuronal12.
, con una inhibición previa de caspasas, la muerte celular no es evitada, pero adquiere una morfología necrótica, siendo denominada necroptosis. O sea que necrosis y apoptosis no son formas de muerte celular excluyentes, sino que pueden coincidir en determinados momentos del proceso degenerativo de algunos tipos celulares, como ocurre en la muerte neuronal12.
En las últimos tres décadas se ha producido un desarrollo acentuado en el conocimiento de este fenómeno y hoy sabemos que la apoptosis tiene un significado biológico muy importante, se piensa que la mayoría, sino toda la muerte celular fisiológica sucede por apoptosis9 o sea la apoptosis es un fenómeno biológico permanente, dinámico e interactivo; la célula decide morir en respuesta a un estímulo específico, no necesariamente tóxico y pone en marcha un programa de eventos metabólicos y genéticos que culminan en su total desintegración12.
Además de los cambios morfológicos, se produce la fragmentación del ADN en fragmentos de 50 a 300 kb. La acción de endonucleasas dependientes del Ca2+ y del Mg2+ es la responsable de esta peculiar fragmentación del ADN y sus típicas escaleras en la visualización por electroforesis, que contrastan con el patrón continuo o en "frotis" indicativo de necrosis14. Por esto, las terapias que puedan inducir la apoptosis en células cancerosas tienen gran potencial en el tratamiento de diversos tipos de cáncer y numerosas investigaciones relacionadas con el uso de nuevos productos sintéticos, son llevadas a cabo en nuestro laboratorio13.
El presente trabajo evaluó los cambios morfofuncionales que originan dos derivados del 2-furiletileno (G1 y UC-245) sobre una línea celular. Estos productos fueron sintetizados en el Centro de Bioactivos Químicos (CBQ) de Santa Clara, su estructura molecular podrá encontrarse en la literatura revisada14-16. La posibilidad de que estos fármacos provoquen en las células en estudio cambios a nivel de su ultraestructura molecular y su morfología, que indique la presencia de una muerte celular programada o apoptosis, conlleva sin dudas a un desarrollo en las investigaciones encaminadas a obtener una terapéutica antitumoral mucho más eficaz y constituye el objetivo principal del presente trabajo.
MATERIAL Y MÉTODOS
Obtención de los productos sintéticos
Los productos sintéticos G1 y UC245 fueron obtenidos por el Centro de Bioactivos Químicos (CBQ) de la Universidad Central de Las Villas en Santa Clara, Cuba. La descripción de estos productos y sus características químicas así como otras propiedades de interés aparecen en la literatura consultada. 14-16
Línea celular, dosis y variables seleccionadas
Los experimentos se realizaron con la línea celular no tumoral CHO-K1 (epiteliales de Ovario de Hámster Chino, ECACC No.85050302) gentilmente donada por el Centro de Inmunología Molecular (La Habana, Cuba). Tanto las condiciones de cultivo, las dosis empleadas de estos productos y los controles del experimento aparecen publicadas con anterioridad. 17-18 En estos ensayos se incorporó como control positivo la fitohemoaglutinina en los experimentos de índice mitótico (180µg/ml). La muestra para cada tratamiento estuvo constituida por 1000 células estudiadas por muestreo probabilístico aleatorio y se seleccionaron las siguientes variables dependientes:
Medición de la concentración citosólica de los iones Na+, K+ y Ca2+
El objetivo de este ensayo fue estudiar el efecto de los productos G-1 y el UC-245 sobre el influjo de los iones Na+, K+ y Ca2+ citoplasmático y su posible relación con la apoptosis.
Los ensayos se realizaron en duplicados para cada producto empleando placas de 24 pozos con una densidad de siembra de 300 000 células/ml. Posterior a las 24 horas de tratamiento de las células con dosis de 70 y 100 µmol/L de UC-245 y G-1 respectivamente a 37ºC, se procedió a la tripsinización (0.125%) y centrifugación. Las células fueron lavadas con PBS 1X (137mM NaCl, 2.7mM KCl, 4.3mM Na2HPO4, 1.47mM KH2PO4 con un pH=7.2) dos veces y sometidas a choque hipotónico con 150µl de agua bidestilada estéril durante 30 minutos a temperatura ambiente (TA) y centrifugadas a 10 000rpm por 5 min. El sobrenadante fue pasado a tubo limpio. Las muestras fueron medidas con la ayuda de un gasómetro ABL500, empleado en la sala de Terapia Intensiva del Hospital Pediátrico Provincial "Eduardo Agramonte Piña".
Inducción de apoptosis por fragmentación del ADN
Para evaluar si los productos ensayados inducen la muerte celular programada en estas células, se realizó la técnica de fragmentación de ADN. 19
Morfología nuclear
Para los estudios de morfología nuclear se procedió al tratamiento de las células con ambos productos por un periodo de 24 horas. Al concluir el tiempo de exposición, las células fueron desprendidas del soporte por tratamiento enzimático con tripsina y extendidas en láminas portaobjeto. Se procedió a la fijación en alcohol absoluto para luego colorearlas con la técnica de hematoxilina y eosina.20 Las láminas histológicas se observaron con un Microscopio Olimpus CX21 con una ampliación máxima de 400X y se procedió a la clasificación antes mencionada.
Determinación del Índice Mitótico
Posterior a la incubación con ambos productos por 48 horas para permitir la ocurrencia de más de un ciclo de división celular y determinar el índice mitótico (IM) de cada producto, las células de cada tratamiento fueron sometidas al protocolo descrito por Verma y Babu, 1995, 21 para la obtención de metafases. Se contaron un total de 1000 células por tratamiento con la ayuda de un microscopio Olimpus BX51 utilizado en el Centro Provincial de Genética Médica de la Provincia de Camagüey. Se emplearon resoluciones de 400X y 1000X. La fórmula utilizada para el cálculo fue:

En el ensayo de índice mitótico se emplearon además los compuestos G0, UC244 y MA, familias moleculares de los productos G1 y UC245.
Procesamiento estadístico
Se empleó la estadística no paramétrica. La prueba seleccionada para el estudió fue el "test de comparación de proporciones". El paquete estadístico empleado fue el SPSS 15.0 para Windows. La diferencia se consideró significativa para valores de p < 0.05.
Las investigaciones se llevaron a cabo en los laboratorios de Cultivo Celular y de Inmunoanálisis del Centro de Inmunología y Productos Biológicos (CENIPBI) de la Universidad de Ciencias Médicas "Carlos J Finlay" de Camagüeyen colaboración con el Departamento de Histoembriología de dicha Institución, el Hospital Pediátrico Provincial "Eduardo Agramonte Piña" y el Centro Provincial de Genética Médica de Camagüey; en el trienio 2008- 2011.
RESULTADOS Y DISCUSIÓN
Medición de la concentración citosólica de los iones Na+, K+ y Ca2+
Es conocido que muchos mecanismos asociados a la citotoxicidad de los compuestos están relacionados o comprometidos con el influjo de determinados iones al interior celular mediante eventos endocíticos como la pinocitosis22.
La gráfica 1, muestra los resultados de los ensayos con dosis de 70 y 100 µmol/L de UC-245 y G-1 respectivamente y sometidas posteriormente a choque hipotónico. Puede evidenciarse el incremento intracelular de los iones Na+, K+ y Ca2+ en ambos tratamientos con relación a los controles empleados, siendo el efecto del producto G1 superior al UC245 en los tres iones cuantificados. El efecto inductor sobre el influjo de Na+ y K+ fue mucho menor al compararse con el ion Ca2+ pero superior al control negativo. El Na+ incrementó su concentración en 1,4 y 1,8 veces mientras que la entrada del ion K+ aumentó entre 5 y 7 veces para el UC245 y G1 respectivamente (Gráfico 3A y 3B). Los valores aquí mostrados para el control negativo (25mmol/L) se corresponden con los valores reportados en la literatura (12mmol/L) 23, si tenemos en cuenta que estos valores dependerán del tipo celular así como el estadio fisiológico de la célula en estudio.
Las células presentan dos fuentes principales de Ca2+: la extracelular y la existente en orgánulos intracelulares como las mitocondrias 24 o el retículo endoplasmático25-26, siendo este último el reservorio más importante de Ca2+ intracelular. Se plantea que la muerte celular programada o apoptosis está correlacionada con el influjo de este ión, el cual activa las caspasas dependientes de Ca2+ para entre otras funciones, activar nucleasas que degradan la molécula de ADN de la célula destinada a morir 27. La determinación de niveles incrementados del ión Ca2+ en el citosol, puede sugerir uno de los mecanismos bioquímicos involucrados en la muerte celular programada en los cultivos de células CHO tratados con los productos en estudio, donde se evidenció un incremento de 57 y 100 veces para células tratadas con UC245 y G1 respectivamente. Una célula no tratada y en actividad fisiológica normal contiene concentraciones bajas de Ca2+ intracelular en el orden de 0,0001mmol/L que pueden ante alguna actividad inducida llegar a valores entre 0,005 y 0,001 mmol/L 23, 28. El uso mantenido durante 24 horas de exposición de los dos productos en estudio, incrementó las concentraciones intracelulares de este ion a valores cuantificables de 0,057 y 0,1mmol/L, detectables mediante la técnica de cromatografía de gases utilizada para tales fines. Teniendo en cuenta los valores citosólicos del ion Ca2+ para ambos productos, fue de interés determinar su asociación con un proceso necrótico o apoptótico según lo reportado en la literatura, para lo cual se diseñaron experimentos cuyos resultados se muestran a continuación.
Fragmentación del ADN
Otro de los cambios moleculares que acompaña a la célula en su muerte programada, es la ruptura que ocurre entre los nucleosomas del ADN nuclear, esta manifestación molecular visible en el laboratorio mediante técnicas de fragmentación de ADN en gel de agarosa 1,8%29-31, se debe a la acción de nucleasas dependientes de los iones Ca2+ y Mg2+ 32.
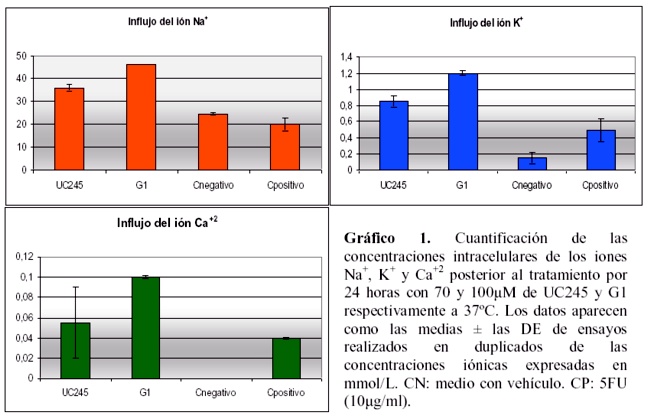
En la década de los 90, se planteaba que la sobrecarga de Ca2+ puede mediar la muerte celular del tipo necrótico33, aunque existen numerosas pruebas que involucran al Ca2+ en la apoptosis. Por ejemplo, el corte de la cromatina nuclear en fragmentos oligonucleosómicos, característico en el proceso apoptótico, es el resultado de la activación de una endonucleasa dependiente de Ca2+34-35. Recientemente se descubrió que la endonucleasa apoptótica es la enzima clave que media la fragmentación regulada del ADN así como la condensación de la cromatina en respuestas a señales apoptóticas tales como los ligandos de muerte celular (FAS, TNF), radiaciones ionizantes, y agentes antitumorales. Una endonuleasa que es activada específicamente por caspasa-3 fue identificada en humanos y ratones por el grupo de Yoshida y col, 200636. La línea celular seleccionada para estos experimentos fueron las células CHO. Estudios realizados con esta línea pero con una mutación en su genotipo (-/-) para el gen de la caspasa-3, evidenció que la fragmentación de ADN puede seguir vías dependientes o independientes de la caspasa-3, según sea el agente químico empleado en el ensayo37, otra línea celular como la MCF-7 deficiente de caspasa-3 mostró la fragmentación de su genoma nuclear ante la inducción con palmitato38. En los experimentos llevados a cabo en geles de agarosa 1.8% y que se muestran en la figura 1, se evidencia la presencia de fragmentos oligonucelosómicos en las tallas esperadas, obtenidos a partir de la purificación del ADN genómico de células CHO tratadas con ambos productos (líneas 2 y 3). Puede observarse la no presencia de estas bandas en la línea 1 donde se depositó igual cantidad de ADN de células no tratadas (control negativo). Este resultado confirma que la fragmentación de ADN es debida directamente a la acción de los productos en estudio sobre las moléculas encargadas de este fenómeno y no a la contaminación de los cultivos celulares con micoplasmas, como sugieren varios trabajos publicados por otros autores39-40.
Por no contar nuestro laboratorio con las herramientas moleculares específicas para identificar las diferentes vías de inducción de la apoptosis (intrínseca y extrínseca) y actualmente en uso por otros laboratorios internacionales, no se pudo precisar cuál de estas vías es activada por G1 y UC245 para inducir el fenómeno de fragmentación de ADN, tampoco pudo definirse si la fragmentación ocurre dependiente de caspasa-3 ó independiente de esta molécula. No obstante, la fragmentación de ADN aquí mostrada, es una evidencia de que ambos productos desencadenaron un fenómeno molecular característico de la apoptosis41-42 y sugiere la ocurrencia de cambios morfológicos a nivel nuclear como respuesta a una apoptosis inducida. Para confirmar esta teoría se procedió al estudio de la morfología nuclear en busca de los cuerpos apoptóticos en células tratadas y sus respectivos controles.
Morfología nuclear
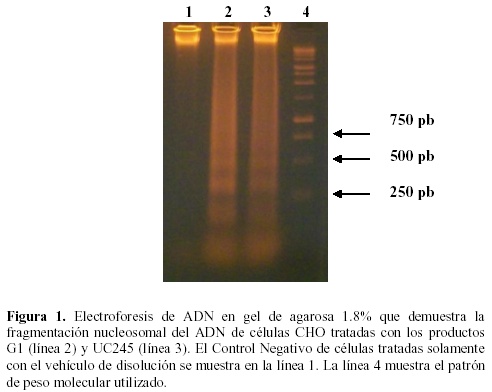
Las variaciones morfológicas deseadas para aquellos productos con actividad antitumoral, deben estar dirigidas a la aparición de cuerpos apoptóticos como los que se observan en la figura 2C y que constituyen indicadores de apoptosis en las células tratadas. La presencia de núcleos apoptóticos fueron observados en ambos tratamientos con índices superiores al control negativo empleado en el ensayo (gráfico 2). Este resultado confirma junto con los experimentos de fragmentación de ADN visto con anterioridad, el efecto de los productos G1 y UC245 en la activación de vías proapotóticas.
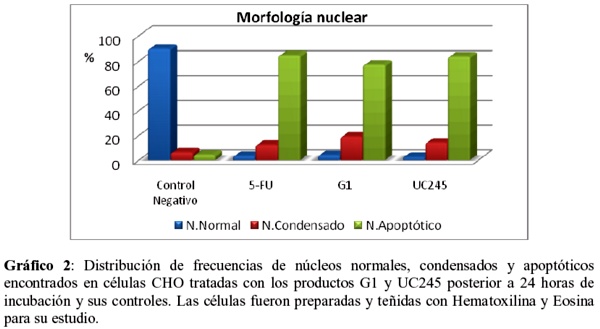
Como control positivo del experimento para evaluar la inducción de apoptosis, se utilizó el conocido quimioterapéutico 5-fluororacilo (5-FU), como puede observarse el mismo logró inducir el 80% de cuerpos apoptóticos. Este compuesto es ampliamente utilizado en la quimioterapia contra una amplia gama de células malignas.
En ensayos realizados con células tratadas con combinaciones de 5-FU y cisplastine, se demuestra un incremento significativo en la inducción de apoptosis43-44. Otros estudios demuestran la inducción de proteínas proapotóticas como la caspase-3, p53 y Bid en líneas celulares leucémicas (TJK, T3JK), y hepáticas HepG2 inducida por 5-FU45-46. También en el gráfico 2 pueden observarse las proporciones encontradas de los diferentes tipos de núcleos (normales y condensados) encontrados en los controles y los tratamientos realizados a las células CHO. Los núcleos normales predominaron en el control negativo, mientras que núcleos condensados y principalmente los cuerpos apoptóticos predominaron en las células tratadas.
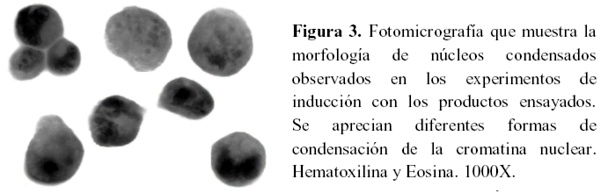
Especial atención se les confirieron a los núcleos condensados y que se muestran en la figura 2B, por ser el estado previo a la formación de los cuerpos apoptóticos y que se caracteriza por una disminución del tamaño, así como por un reordenamiento de la cromatina. Muy frecuentemente se plantea en la literatura que este reordenamiento es en forma de media luna como la observada en estos experimentos47, pero también fueron observadas otras formas de condensación nuclear que puede variar entre el 70 y el 10% del tamaño original del núcleo y que aparecen en la figura 3.
Índice Mitótico
Un importante marcador a tener en cuenta en la selección de productos con actividad antitumoral, son los valores de índice mitótico (IM) que logran estos en cultivos celulares in vitro. Varios autores utilizan esta variable como medidor de eficiencia del producto en estudio48-50.
El gráfico 3 muestra los valores medios del IM con las desviaciones estándar determinadas para los dos productos de interés y comparado con tres productos de la misma familia (G0, UC-244 y el MA). Puede observarse el efecto inductor de la fitohemoaglutinina (5.47) con relación a los valores normales de IM de la población de células CHO (3.57), este producto es utilizado en los estudios in vitro de citogenética para inducir el crecimiento de fibroblastos humanos.
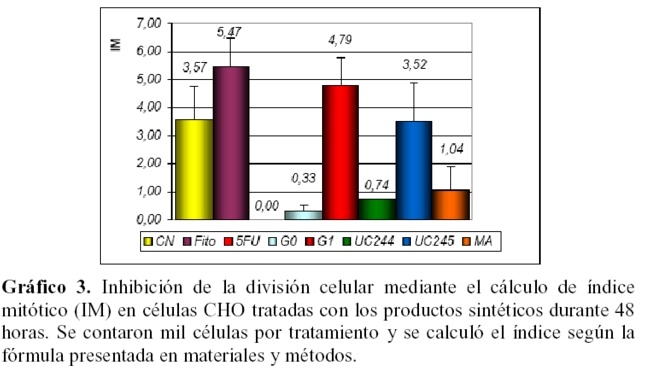
Un efecto inhibidor de la mitosis se observó con el fármaco comercial 5-fluoruracilo utilizado a razón de 10 µg/ml. El empleo de estos controles permitió la correcta interpretación de los resultados del experimento. Los productos G1 y UC245 no fueron inhibidores de mitosis, mostrando el primero valores de IM comparables con el control positivo (p=0,001) mientras que el UC245 presentó un IM típico de esta población celular al no mostrar diferencias significativas con el control negativo (p=0.823).
Es importante tener en cuenta que estos ensayos se realizan sin la presencia del factor metabolizante contenido en la fracción S9 y obtenida de células hepáticas de rata, necesaria para llevar a cabo estos ensayos in vitro ya que la misma contiene las enzimas presentes en el hígado encargadas del metabolismo de las drogas, no obstante los resultados aquí mostrados, brindan información sobre el comportamiento de estos cinco productos y su modo de acción (directa o indirecta).
Los productos G1 y UC245, mostraron una correlación positiva entre la inducción de la apoptosis evaluada por el por ciento de núcleos apoptóticos (77.1% y 83.6% respectivamente) y el índice mitótico (IM). La literatura consultada muestra que no siempre las drogas en estudio correlacionan negativamente la inducción de apoptosis con la inhibición de la proliferación celular, parámetro evaluado por el cálculo del IM.
Por otra parte, en estudios realizados en 90 pacientes con retinoblastoma, se evaluó la relación entre el índice mitótico (IM) y el índice apoptótico (IA), en este estudio los tumores mostraron una alta asociación entre ambas variables51. Ratas F344 alimentadas con una dieta carente de colina y ácido fólico durante 3 y 9 semanas evidenciaron un incremento significativo en los cuerpos apotóticos acompañada con un sustancial incremento en el índice mitótico (IM)52.
En la actualidad, se planifican otros experimentos para evidenciar las vías moleculares implicadas en la muerte celular programada, inducida por los productos G1 y UC245.
CONCLUSIONES
Se evidenció por primera vez variaciones morfofuncionales producidas en un modelo celular in vitro por dos productos sintetizados derivados del 2-furiletileno, mostrándose las marcas moleculares y morfológicas que confirmarían la inducción de una muerte celular programada o apoptosis.
REFERENCIAS
1. Martínez I. Prevención del cáncer. Curación definitiva. Rev Cub Oncol. 1998; 14(3): 141-142.
2. Anuario Estadístico 2009. En: http://websie.eclac.cl/anuario_estadistico/anuario_2010/docs/Anuario%20Estadistico_2010.pdf
3. Michel HR, Gordon I, Kaye, Wojciech P. Histología texto y atlas color con Biología celular y molecular. Editorial Médica Panamericana. 4ta ed. Argentina 2005.
4. Díaz T, Fernández M, Arango MC. Factores etiopatogénicos y moleculares en la génesis del cáncer. Rev Cubana Oncol. 1998; 14: 42-50.
5. Schmitt C, Lowe SW. Apoptosis and therapy. J Pathol 1999; 187:127-137.
6. Sánchez V. Mecanismos reguladores de la muerte celular no necrótica.Rev Cubana Invest Biomed. 2001; 20:266-274.
7. Colell A. Vida y muerte celular. Cell 2006; 129(55):983-997.
8. McGraw-Hill. Patología estructural y funcional. Patología celular: Lesión y muerte celulares. 3ed. R Cotran, Kumar V, Collins T. 2000.
10. Abbas AK, Lichtmann AH, Pober JS. Inmunología celular y molecular. Ed. Mac-Graw-Hill- Interamericana de España. 3ed. Madrid 2002
11. Degterev A, Huang Z, Boyce M, Li Y, Jagtap P, Mizushima N, et al. Chemical inhibitor of nonapoptotic cell death with therapeutic potential for ischemic brain injury. Nat Chem Biol. 2005; 1:234.
12. Sastry P, Rao KS. Apoptosis and the nervous system. J Neurochem. 2000; 74:1-20.
13. Ríos M, Hernández M. Los genes supresores de tumores y el cáncer. Rev Cubana Oncol 2001; 17:65-71.
14. González JI, Creus A and Marcos R. Genotoxic evaluation of the furylethylene derivative 1-(5-bromofur-2-yl)-2-nitroethene in cultured human lymphocytes. Mutat Res. 2002; 519:179-185.
15. González J, Creus A, Marcos R, Molla R, Zapatero J. The mutagenic potential of the furylethylene derivative 2-furyl-1- nitroethene in the mouse bone marrow micronucleus test. Toxicol Sci. 2003; 72:359-362.
16. Estrada E. Structure-mutagenicity relationships in 2-furylethylene derivatives. A molecular orbital study of the role of nitro groups. Mutat Res 1998; 420:67-75.
17. Hernández O, Martínez Y, Vazquez N, Fernández S, Perez G. El número y posición de los átomos de bromo en compuestos derivados del 2-furiletileno afectan la citotoxicidad e inducen resistencia en células de mamíferos. Rev Electron Biomed / Electron J Biomed 2011;3:44-52.
18. Hernández O, Martínez Y, Pimentel H, LLanes LL, Perez G, Quesada L, Vazquez N, Fernández S. Effect of bromine atom number on the cytotoxicity of two substances 2-furylethylene derivatives in normal and tumoral cell lines.Rev Electron Biomed / Electron J Biomed 2012;1:26-36
19. Yoo C, Han KT, Cho KS, Ha J, Park HJ, Nam JH, Kil UH, Lee KT. Cancer Lett. 2005;225:41-52.
20. Rodiles HC y col. Citohistopatología. Procedimientos básicos. La Habana Editorial Ciencias Médicas. 2008.
21. Verma RS, Babu A. Chromosomes. Principles and Techniques. 2nd Ed. New York. 1995; p 9-29
22. Gerasimenko JV, Tepikin AV, Petersen OH, Gerasimenko OV. Calcium uptake via endocytosis with rapid release from acidifying endosomes. Curr Biol. 1998; 8:1335-1338.
23. Lodish H, Berk A, Zipursky L, Matsudaira P, Baltimore D, Darnell J. Molecular Cell Biology. W.H.Freeman; 4th Edition. 2005 New York.
24. Szalai G, Krishnamurthy R, Hajnoczky G. Apoptosis driven by IP(3)-linked mitochondrial calcium signals. EMBO J. 1999;18:6349-6361.
25. Bassik MC, Scorrano L, Oakes SA, Pozzan T, Korsmeyer SJ. Phosphorylation of BCL-2 regulates ER Ca2+ homeostasis and apoptosis. EMBO J. 2004; 23:1207-1216.
26. Mirnikjoo B, Balasubramanian K, Schroit AJ. Mobilization of lysosomal calcium regulates the externalization of phosphatidylserine during apoptosis. J Biol Chem. 2009;. 284:6918-6923.
27. Klatt EC. Robins y Cotran. Atlas de Anatomía Patológica. Ed. Elsevier España S.A. 2007.
28. Díaz O. El ion calcio: su regulación y función en la célula ß pancreática. Rev Cubana Endocrinol. 2003; 14:67-72.
29. Quadrilatero J, Bombardier E, Norris SM, Talanian JL, Palmer MS, Logan HM, et al. Prolonged moderate-intensity aerobic exercise does not alter apoptotic signaling and DNA fragmentation in human skeletal muscle. Am J Physiol Endocrinol Metab. 2010; 298(3):E534-47.
30. Aruscavage PJ, Hellwig S, Bass BL. Small DNA pieces in C. elegans are intermediates of DNA fragmentation during apoptosis. PLoS One. 2010; 5(6):e11217.
31. Zunino SJ, Storms DH. Carnosol delays chemotherapy-induced DNA fragmentation and morphological changes associated with apoptosis in leukemic cells. Nutr Cancer. 2009; 61:94-102.
32. Sundaresan N, Pillai CK, Suresh CH. Role of Mg2+ and Ca2+ in DNA bending: evidence from an ONIOM-based QM-MM study of a DNA fragment. J Phys Chem A J. 2006;110:8826-8831.
33. Ankarcrona M. Glutamate induced cell death: apoptosis or necrosis?. Prog Brain Res. 1998; 116:265-72.
34. Iga M, Manaboon M, Matsui H, Sakurai S. Ca2+-PKC-caspase 3-like protease pathway mediates DNA and nuclear fragmentation in ecdysteroid-induced programmed cell death. Mol Cell Endocrinol. 2010; 321:146-151.
35. Yip KW, Ito E, Mao X, Au PY, Hedley DW, Mocanu JD, et al. Potential use of alexidine dihydrochloride as an apoptosis-promoting anticancer agent. Mol Cancer Ther. 2006; 5:2234-2240.
36. Yoshida AY, Pommier Y, Ueda T. Endonuclease activation and chromosomal DNA fragmentation during apoptosis in leukemia cells. Int J Hematol. 2006; 84:31-37.
37. Kitazumi I, Maseki Y, Nomura Y, Shimanuki A, Sugita Y, Tsukahara M. Okadaic acid induces DNA fragmentation via caspase-3-dependent and caspase-3-independent pathways in Chinese hamster ovary (CHO)-K1 cells. FEBS J. 2010; 277:404-412.
38. Semenov DV, Aronov PA, Kuligina EV, Potapenko MO, Richter VA. Oligonucleosome DNA fragmentation of caspase 3 deficient MCF-7 cells in palmitate-induced apoptosis. Nucleosides Nucleotides Nucleic Acids. 2004; 23:831-836.
39. Paddenberg R, Wulf S, Weber A, Heimann P, Beck L, Mannherz H. Internucleosoma DNA fragmentation in cultured cells under conditions reported to induce apoptosis may be caused by mycoplasma endonuclease. Eur J Cell Biol. 1996: 69:105-119.
40. Paddenberg R, Weber A, Wulf S, Mannherz H. Mycoplasma nucleases able to induce internucleosomal DNA degradation in cultured cells possess may characteristics of eukaryotic apoptotic nucleases. Cell Death Differ. 1998; 5:517-528.
41. Abid-Essefi S, Baudrimont I, Hassen W, Ouanes Z, Mobio TA, Anane R, Creppy EE, Bacha H. DNA fragmentation, apoptosis and cell cycle arrest induced by zearalenone in cultured DOK, Vero and Caco-2 cells: prevention by Vitamin E. Toxicology. 2003; 192:237-248.
42. Sakkas D, Alvarez JG. Sperm DNA fragmentation: mechanisms of origin, impact on reproductive outcome, and analysis. Fertil Steril. 2010; 93:1027-1036.
43. Azuma M, Harada K, Supriatno, Tamatani T, Motegi K, Ashida Y, Sato M. Potentiation of induction of apoptosis by sequential treatment with cisplatin followed by 5-fluorouracil in human oral cancer cells. Int J Oncol. 2004; 24:1449-1455.
44. Haag C, Stadel D, Zhou S, Bachem MG, Möller P, Debatin KM, Fulda S. Identification of c-FLIP(L) and c-FLIP(S) as critical regulators of death receptor-induced apoptosis in pancreatic cancer cells. Gut. 2011: 60:225-237.
45. Ma SH, Chen GG, Ye C, Leung BC, Ho RL, Lai PB. Susceptibility of Hep3B cells in different phases of cell cycle to tBid. Biochim Biophys Acta. 2011; 1813:179-185.
46. Zhao L, Chen Z, Wang J, Yang L, Zhao Q, Wang J, et al. Synergistic effect of 5-fluorouracil and the flavanoid oroxylin A on HepG2 human hepatocellular carcinoma and on H22 transplanted mice. Cancer Chemother Pharmacol; 2010; 65:481-489.
47. Yamada T, Takatsu Y, Kasumi M, Ichimura K, van Doorn WG. Nuclear fragmentation and DNA degradation during programmed cell death in petals of morning glory (Ipomoea nil). Planta 2006; 224:1279-1290.
48. Wiebe JP, et al. Opposing actions of the progesterone metabolites, 5alpha-dihydroprogesterone (5alphaP) and 3alpha-dihydroprogesterone (3alphaHP) on mitosis, apoptosis, and expression of Bcl-2, Bax and p21 in human breast cell lines. J Steroid Biochem Mol Biol. 2010; 118:125-132.
49. Soldati R, Wargon V, Cerliani JP, Giulianelli S, Vanzulli SI, Gorostiaga MA, Bolado J, do Campo P, Molinolo A, Vollmer G, Lanari C. Inhibition of mammary tumor growth by estrogens: is there a specific role for estrogen receptors alpha and beta?. Breast Cancer Res Treat. 2010;123:709-724.
50. Smilek P. [Molecular predictors in head and neck tumours]. Klin Onkol, 2010; 23(4):218-223.
51. Sitorus RS, Gumay S, van der Valk P. The apoptotic paradox in retinoblastoma. Ann N Y Acad Sci. 2009;1171:77-86.
52.James SJ, Miller BJ, Basnakian AG, Pogribny IP, Pogribna M, Muskhelishvili L. Apoptosis and proliferation under conditions of deoxynucleotide pool imbalance in liver of folate/methyl deficient rats. Carcinogenesis. 1997; 18(2):287-293.
AGRADECIMIENTOS:
Esta investigación ha sido económicamente sustentada por el Sistema Nacional de Salud Cubano.
CORRESPONDENCIA:
Oscar C. Hernández MD
Avenida de la Sierra, 23. Bajo A.
Logroño, La Rioja. España
Permanent Affiliation Address: Centro de Inmunología y Productos Biológicos (CENIPBI),
Universidad Médica. Camagüey.
CP 70100. Apdo 150. Cuba
Email:oscar.hernandez1964 @ yahoo.es
