Indice del volumen
Volume index
Comité Editorial
Editorial Board
Comité Científico
Scientific Committee
CITOMETRÍA DE FLUJO: FUNDAMENTO, INSTRUMENTACIÓN Y APLICACIONES EN MICROBIOLOGÍA CLÍNICA
Gabriel Alberto March Rosselló1, José María Eiros Bouza 2
1Hospital Clínico Universitario de Valladolid.
2Facultad de Medicina. Universidad de Valladolid
España.
gmr810 @ hotmail.com
Rev Electron Biomed / Electron J Biomed 2012;3:45-53.
Comentario del revisor Prof. Pilar Codoñer Franch MD. PhD. Profesora Titular del Departamento de Pediatría, Obstetricia y Ginecología de la Universidad de Valencia. Sección de Nutrición, Gastroenterología y Hepatología Pediátrica. Hospital Universitario Dr. Peset de Valencia. España. España.
Comentario del revisor Comentario del revisor Pilar Vicente MD. PhD. Servicio de Hematología y Hemoterapia del Hospital Universitario de Burgos. Burgos. España
RESUMEN:
La citometría de flujo (CMF) es una técnica que permite el análisis óptico e individual de diferentes partículas y puede aportar resultados en unos pocos minutos tras la realización de las determinaciones. Son numerosas las aplicaciones de esta técnica a la Microbiología Clínica, que van desde la detección y cuantificación de microorganismos hasta estudios en los que se evalúan diferentes parámetros de la célula microbiana, como por ejemplo pruebas tan importantes como la determinación de la susceptibilidad a los agentes quimioterápicos.
En este trabajo se pretende revisar el fundamento y la instrumentación de la CMF incluyendo el analizador de orinas Sysmex UF-1000i (Sysmex Corporation, Kobe, Japón), y las principales aplicaciones de esta técnica en Microbiología Clínica. Palabras clave:
PALABRAS CLAVE:Citometría de flujo. Microbiología clínica. Sysmex UF-1000i
SUMMARY: FLOW CYTOMTRY: BASIS, INSTRUMENTATION AND APPLICATIONS IN CLINICAL MICROBIOLOGY.
Flow cytometry is a technique that allows individual optical analysis of different particles and can provide results in a few minutes after the completion of the determinations. There are many applications of this technique to the Clinical Microbiology, ranging from the detection and quantification of microorganisms up to studies that evaluated different microbial cell parameters, as for example tests such as important as the determination of the susceptibility to chemotherapeutic agents.
This paper aims to review the basis and instrumentation of the flow cytometry including UF-1000i Sysmex urine analyzer (Sysmex Corporation, Kobe, Japan), and the main applications of this technique in Clinical Microbiology.
KEYWORDS: Flow cytometry. Clinical microbiology. Sysmex UF-1000i
INTRODUCCIÓN
Una de las principales dificultades que deben superar los laboratorios de Microbiología Clínica respecto a otros laboratorios Clínicos es el dilatado tiempo que se requiere para emitir informes definitivos. Los métodos tradicionales de bacteriología y micología precisan el crecimiento y aislamiento de los microorganismos para poder realizar la identificación, la susceptibilidad a los antimicrobianos u otras pruebas, de tal forma que en muchos casos los resultados están disponibles en 48/72 horas o más.
Con el fin de disminuir el tiempo necesario para llevar a cabo el diagnóstico microbiológico los laboratorios de Microbiología Clínica han sufrido importantes cambios durante los últimos años ya que las infecciones graves requieren una terapia dirigida administrada lo más pronto posible, y para ello se debe conocer el agente causal y su susceptibilidad a los antimicrobianos. Entre estos cambios se encuentran la introducción de las técnicas basadas en la detección de antígenos y anticuerpos específicos1, las técnicas de detección molecular como el Septifast2, las de proteómica representada por el sistema MALDI-TOF3. y la citometría de flujo4.
Todas estas técnicas tienen la característica común de que pueden proporcionar datos sobre la identificación o la sensibilidad de los microorganismos a partir de la muestra directa, sin la necesidad de esperar el cultivo, pudiendo adelantar así los resultados microbiológicos. Esta reducción de tiempo es especialmente útil cuando se refiere a microorganismos que no crecen en medios de cultivo convencionales como Mycoplasma spp, microorganismos de crecimiento lento como las micobacterias, o cuando se refiere a pacientes con sepsis que presentan bacteriemia documentada. En este último ámbito la administración adecuada de antibióticos es esencial para su evolución favorable5 y cada hora de retraso en el inicio del tratamiento está asociado con una disminución de la supervivencia de casi un 8%6.
Otra línea de aplicación práctica es la de poder retrasar la aparición de resistencias bacterianas porque el cambio del tratamiento antimicrobiano empírico de amplio espectro a una terapia dirigida tan pronto como sea posible es una de las pocas medidas que se pueden adoptar habida cuenta de que la investigación en nuevos antibióticos está muy ralentizada en el presente siglo; las dos últimas moléculas que aparecieron en el mercado fueron linezolid en el año 2000 y daptomicina en el año 20037. Para poder realizar este cambio se debe disponer de los datos de susceptibilidad con el menor tiempo posible. Actualmente están disponibles algunos métodos automatizados para la determinación de la sensibilidad bacteriana, de los cuales el sistema VITEK2® (biomérieux, Marcy l'Etoile, Francia) y el sistema Phoenix® (BD Biosciences, Frankklin Lakes, NJ, USA) son los que proporcionan los resultados más rápidos con un tiempo medio de 9 horas8 y, como veremos a continuación, con la citometría de flujo es posible acortar este tiempo.
En este trabajo se pretende revisar la instrumentación de la citometría de flujo (CMF), incluyendo el analizador de orinas Sysmex UF-1000i (Sysmex corporation, Kobe, Japón), y las principales aplicaciones de esta técnica en la Microbiología Clínica.
Instrumentación de la citometría de flujo
La citometría de flujo es un proceso que permite que las partículas (generalmente células) pasen en fila dentro de un flujo a través del aparato con una velocidad de 500-4000 partículas/segundo. Cuando esto sucede, es posible realizar la medición simultánea de múltiples características de una sola célula de tal forma que es posible caracterizar, separar y cuantificar las diferentes subpoblaciones celulares que se engloban en un conjunto9.
La clasificación de las células puede basarse en propiedades físico-químicas, inmunológicas y funcionales. Los métodos de clasificación que se basan en propiedades funcionales utilizan características tales como afinidad, adherencia o crecimiento. La clasificación inmunológica se basa en la utilización de anticuerpos dirigidos frente a epítopos celulares.
En la práctica, las características físico-químicas son las más utilizadas para la separación o "sorteo celular"; se incluyen características como tamaño, volumen, densidad, propiedades de dispersión de la luz, potencial de membrana, pH, carga eléctrica y contenido de diferentes compuestos como ácidos nucleicos, enzimas y otras proteínas10.
El sistema de citometría de flujo está compuesto por cinco unidades principales: sistema de flujo celular, fuente de luz, unidad de filtros ópticos, detectores y un sistema electrónico que procesa los datos.
A continuación se describe de forma sencilla el funcionamiento del sistema4,11.
El sistema de flujo incorpora un capilar a través del cual se hace pasar un líquido isotónico que actúa a modo de funda, con una velocidad y presión constante generando así un flujo laminar sin turbulencia. Al mismo tiempo, por el centro del capilar se hace pasar la suspensión de partículas a una presión mayor que la del flujo transportador asegurándose así que las células permanecen centradas y viajan una tras otra en el chorro de inyección. De esta forma es posible realizar un análisis individual de las partículas ya que la luz de la fuente emisora incide sobre cada célula a analizar. Este fenómeno recibe el nombre de enfoque hidrodinámico.
La fuente de luz puede ser de dos tipos, un láser o una lámpara de arco. Los citómetros con lámparas de arco tienen más aplicaciones en Microbiología por su mejor resolución de la luz dispersa y los rayos láser en Inmunología y Hematología por su facilidad de excitación de los fluorocromos que se usan para marcar las partículas.
Cuando la luz de la fuente incide perpendicularmente en cada partícula ésta se dispersa hacia delante y hacia los lados. Esta luz se detecta en dos posiciones diferentes, por una parte se detecta la luz dispersa hacia adelante (en inglés "forward scattered light", FSC) y por otra la luz dispersa a un ángulo de 90 grados (en inglés "side scattered light", SSC).
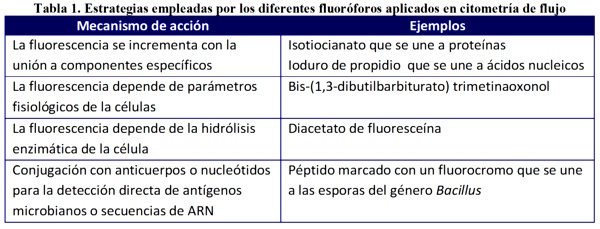
Con el fin de obtener más información las partículas pueden ir marcadas con un fluoróforo que cuando capta la energía de la luz de la fuente emite una señal fluorescente de menor energía que el rayo incidente que se detecta también a un ángulo de 90 grados. Los fluoróforos utilizados pueden clasificarse de acuerdo a su mecanismo de acción (Tabla 1).
Esta luz dispersa atraviesa unos filtros ópticos que seleccionan una longitud de onda específica. La luz filtrada llega a los detectores del tipo fotomultiplicadores que detectan y amplifican la señal la cual se transmite al sistema electrónico que se encarga del procesamiento de los datos. Para ello la luz incidente se transforma en pulsos eléctricos y se generan histogramas generalmente biparamétricos, es decir, gráficas en las que se representan dos parámetros (en inglés "dot plot" o "counter plot"). En estas gráficas, la luz dispersa hacia adelante se relaciona con el tamaño de la partícula y la luz dispersa a un ángulo de 90 grados da una idea de la estructura interna de la partícula proporcionando información sobre la granularidad y morfología celular.
Aplicaciones de la citometría de flujo en Microbiología Clínica
Son numerosos los trabajos en los que se ha demostrado que la CMF es una técnica útil para el estudio de susceptibilidad a los antimicrobianos mediante la observación de los efectos que ejercen estas moléculas sobre ciertos parámetros metabólicos de las bacterias y determinados hongos unicelulares como pueden ser el potencial de membrana, el tamaño celular, cantidad de DNA, actividad enzimática, etc. Ramani y Chaturvedi12 realizaron un estudio en el que se determinó la susceptibilidad de distintas especies de levaduras a Anfotericina B y Fluconazol.
Para ello pusieron en contacto un inóculo de las mismas con los antifúngicos en disolución a diferentes concentraciones. Al cabo de unas pocas horas añadieron a estas disoluciones el fluorocromo yoduro de propidio (PI) junto con desoxicolato. El PI es un fluorocromo que se intercala en la doble hebra del ADN, que es excluido en las células viables y sólo tiñe las bacterias con alteraciones en la membrana y por lo tanto con deterioro celular4 ; el uso de desoxicolato intensifica la penetración de PI en el interior de la célula pudiendo obtener así resultados más anticipados13.
La concentración mínima inhibitoria (CMI) por CFM se definió como la mínima concentración de antifúngico que proporcionó un incremento del 50% de la señal de fluorescencia comparada con la señal obtenida a partir de la disolución control (levadura sin antibiótico). Los resultados obtenidos de la susceptibilidad mediante CMF fueron rápidos (6 horas como máximo, dependiendo de la cepa a estudiar), reproducibles y estadísticamente comparables con los obtenidos por el método de macrodilución en caldo que es el método de referencia indicado por el Clinical and Laboratory Standards Institute (CLSI).
Otro trabajo a destacar en la determinación de la sensibilidad a los antimicrobianos mediante CMF es el realizado por Gauthier et al. 14 que partieron de muestra directa de orinas positivas para bacterias. Usaron dos flurocromos, el PI y el bis-(1,3-dibutilbarbiturato) trimetinaoxonol o DiBAC43; éste último penetra en las células que presentan la membrana despolarizada y ambos aumentan la señal cuando la célula no es viable. Partieron de 114 muestras de orina y hicieron las mediciones de la señal fluorescente mediante CMF una vez se había incubado, durante dos horas, una alícuota de cada orina en las disoluciones con diferentes antibióticos y sólo obtuvieron un 2% de discrepancias con respecto a los valores de referencia de la susceptibilidad determinados mediante la técnica de microdilución en caldo.
Otro trabajo a destacar es el realizado por Shrestha et al. 15 en el que se realizaron histogramas con la representación de la luz dispersa a un ángulo de 90 grados (SSC) frente a la señal de fluorescencia de una cepa de Staphylococcus aureus resistente a meticilina y otra sensible a tiempo cero y a las cuatro horas de incubación en un caldo con este antibiótico y observaron que las cepas resistentes presentan otra dispersión de la luz que las cepas sensibles o resistentes sin exposición al antibiótico; ésto hace suponer que aunque el microorganismo sea resistente al antibiótico éste produce un cambio en la morfología celular de la bacteria.
Las pruebas de susceptibilidad cobran una especial importancia cuando se refieren a microorganismos patógenos de crecimiento lento como Mycobacterium tuberculosis, pasando de requerir hasta tres semanas con el sistema BACTEC MGIT 960 a poder informar un resultado en 24 horas mediante CMF. Esta información es de gran utilidad para el control de brotes y para la administración correcta de antituberculosos debido a que se ha observado un incremento en el número de aislamientos de las cepas resistentes16.
En el trabajo realizado por Pina-Vaz et al. 17 se consiguió determinar en tres días la susceptibilidad a estreptomicina, isoniazida, rifampicina y etambutol. Para ello M. tuberculosis se incubó con los diferentes antituberculosos en el sistema MGIT. Después los microorganismos se tiñeron con el fluorocromo SYTO 16 que sólo penetra en las células con alteración de la membrana celular y, comparando la intensidad de la señal de fluorescencia obtenida a partir de estos microorganismos mediante CMF con microorganismos sin contacto con los antibióticos (grupo control) se pudo diferenciar entre cepas sensibles, intermedias o resistentes obteniendo unos resultados que mostraron una excelente correlación con los obtenidos mediante el sistema BACTEC MGIT 960.
Kirk et al.18 realizaron otro trabajo basandóse en la habilidad de la micobacteria para hidrolizar, mediante esterasas, el sustrato diacetato de fluoresceína (FDA) que pasa a fluoresceína, compuesto que emite fluorescencia cuando se excita con luz de longitud de onda adecuada. Si la micobacteria es sensible al antituberculoso se disminuye la capacidad hidrolítica de la micobactería y por lo tanto también disminuye la señal de fluorescencia detectada. Comparando la señal de fluorescencia y la luz dispersa a 90 grados detectada mediante CMF a partir de micobacterias sin contacto con el antituberculoso con las señales obtenidas a partir de micobacterias con una incubación de tan solo 24 horas con isonizida, etambutol y rifampicina obtuvieron un 95, 92 y 83% de concordancia respectivamente con respecto al antibiograma obtenido mediante el método de las proporciones.
Otra aplicación de la CMF es la cuantificación de bacterias viables pero no cultivables (BVNC); A título de ejemplo Khan et al.19 realizaron un trabajo en el que cuantificaron, mediante CMF, las bacterias vivas, cultivables y no cultivables, y las muertas presentes en un caldo. Para teñir las bacterias usaron dos fluorocromos, uno denominado SYTO que tiñe tanto las vivas como las muertas y el yoduro de propidio (PI) que sólo tiñe las muertas. El número total de células (vivas y muertas) se determinó utilizando el fluorocromo SYTO y el número de bacterias muertas se obtuvo con PI. Las células vivas (cultivables y no cultivables) se calcularon restando al número calculado con SYTO el número calculado con PI. Finalmente el número de bacterias viables pero no cultivables se halló restando al valor de las bacterias vivas el recuento obtenido en placa.
Además la CMF puede utilizarse en la detección y caracterización de esporas de Bacillus anthracis. En el trabajo realizado por Schumacher et al.20, las esporas de Bacillus spp. se marcaron con dos moléculas, un anticuerpo que detecta el antígeno protector (PA) que es un marcador de virulencia específico localizado en la superficie de las esporas de Bacillus anthracis, y un péptido marcado con un fluorocromo que se une a las esporas del género Bacillus. Estudiando los histogramas obtenidos con la combinación de estas dos señales estos autores consiguieron discriminar, en unas pocas horas, entre esporas de B. anthracis de otras esporas de Bacillus spp. y su virulencia.
Por lo tanto, la CMF es una técnica que permite ganar mucho tiempo en la emisión de resultados microbiológicos cuando se presenten casos que requieran una extrema rapidez y, con el desarrollo de nuevos anticuerpos, fluoróforos y sustratos fluorescentes que se unan de forma selectiva a estructuras celulares será posible la identificación y cuantificación de un gran número de estructuras.
Sysmex UF-1000i
Las muestras de orina para urocultivo son unas de las más frecuentemente recibidas y procesadas en los laboratorios de Microbiología Clínica. Dado que entre un 60 a un 80% de muestras proporcionan resultados negativos de crecimiento en placa21-22, para ganar tiempo en la emisión de informes y poder disminuir la carga de trabajo del personal técnico, en los laboratorios de Microbiología Clínica se puede disponer del analizador automatizado del sedimento urinario Sysmex UF-1000i (Sysmex Corporation, Kobe, Japón) con el que se puede realizar un cribado de las muestras de orina.
Este aparato se basa en la citometría de flujo fluorescente y permite cuantificar analitos tales como bacterias, levaduras, hematíes, leucocitos, células epiteliales, células pequeñas redondas, cilindros, espermatozoides, cristales y moco tiñendo estas partículas con colorantes fluorescentes y analizando posteriormente la impedancia, la dispersión y la fluorescencia. Así, las orinas que proporcionan valores por debajo de unos umbrales de ciertos parámetros determinados por el personal de laboratorio en función de la sensibilidad y especificidad que se pretenda alcanzar pueden ser informadas como negativas en un periodo de tiempo breve tras su recepción sin necesidad de otro tipo de procesamiento.
El equipo Sysmex UF-1000i utiliza 0.8 ml de muestra en modo manual y 1.2 ml en modo automático y puede procesar hasta 100 muestras/hora23. Debido a que la medida de los leucocitos es el método más fiable para diferenciar una probable colonización o contaminación de una infección urinaria24, el valor de este analito se suele utilizar, aparte del número de bacterias, como parámetro para discriminar entre orinas positivas y negativas. Uno de los avances del Sysmex UF1-000i respecto a su anterior modelo, el UF-500i (Sysmex Corporation, Kobe, Japón), es que posee dos canales, uno para el análisis del sedimento y otro exclusivo para las bacterias25. De esta forma se mejora el recuento de microorganismos y se evita la interferencia de los hematíes con las bacterias pudiéndose eliminar el recuento de los hematíes como parámetro para discriminar entre orinas positivas y negativas.
Para realizar el análisis cuantitativo de las bacterias se utilizan microesferas o micropartículas que llevan un marcaje fluorescente como estándares de calibración y se comparan las señales de estos calibradores con las de la muestra19; el fluorocromo utilizado es tintura polimetina que tiñe tanto las bacterias vivas como las muertas26. Este aparato también permite discriminar entre cocos y bacilos en una infección monomicrobiana mediante el histograma en el que se representa la luz dispersa hacia delante en función de la señal de fluorescencia23.
El "gold standard" del diagnóstico microbiológico de las infecciones del tracto urinario (ITU) se fundamenta en la lectura e interpretación de las colonias que se forman en medios de cultivo. En función de los criterios de interpretación de las placas que se adopten en cada laboratorio se establecen los puntos de corte óptimos de los diferentes parámetros usados en el sistema Sysmex UF-1000i para discriminar entre orinas positivas y negativas; estos valores condicionan las características operacionales de sensibilidad (S), especificidad (E), valor predictivo positivo (VPP) y valor predictivo negativo (VPN) del equipo tal como se muestra en la Tabla 2.
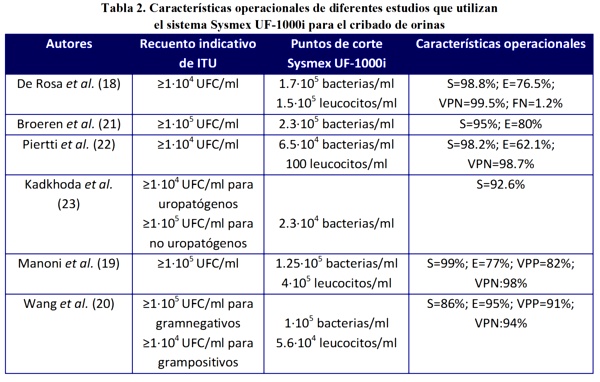
Para una prueba de cribado lo que interesa es que la técnica tenga elevada sensibilidad y elevado valor predictivo negativo con el fin de minimizar el número de falsos negativos (FN). Por otra parte, los falsos positivos obtenidos pueden ser debidos a la presencia de bacterias muertas debido a la toma de antibióticos antes de la recogida de la muestra de orina, a la presencia de bacterias viables pero no cultivables, o a un arrastre de bacterias desde una muestra muy positiva a una negativa. Broeren et al.27 consiguieron reducir los cultivos de las orinas en un 52%, Piertti et al.28 un 43% y Kadkhoda et al.29 un 35% respectivamente.
Para la optimización del Sysmex UF-1000i se deberían establecer los puntos de corte en función de la edad del paciente, del sexo y del tipo de muestra de orina ya que, según como indica la Sociedad Española de Microbiología Clínica, en varones en los que la obtención de orina es menos susceptible de contaminarse son significativos los recuentos >1x103 UFC/ml, en orinas obtenidas por punción suprapúbica o que proceden del riñón cualquier recuento es indicativo de infección y en orinas obtenidas por sondaje vesical se consideran significativos recuentos >1x103 UFC/ml de cualquier microorganismo en cultivo puro30.
Un trabajo a destacar realizado con el Sysmex UF-1000i es el llevado a cabo por Broeren et al31. con un título muy sugerente: Antimicrobial susceptibility testing in 90 min by bacterial cell count monitoring. En este trabajo se dispuso de una concentración inicial bacteriana entre 5x104 y 2x105 bacterias/ml calculada mediante el Sysmex UF-1000i en diferentes disoluciones de caldo de enriquecimiento con concentraciones crecientes de antibióticos equivalentes a las que se emplean para determinar la CMI por microdilución en los métodos estandarizados. Se ensayaron los microorganismos E. coli, P. aeruginosa y S. aureus y los antibióticos amoxicilina, gentamicina y piperacilina. Se efectuó la medición del número de bacterias de cada disolución de antibiótico a diferentes tiempos: 60, 90, 120, 180 y 240 minutos. También prepararon un control positivo y un control negativo.
La CMI por citometría de flujo se definió como la mínima concentración de antibiótico que proporcionó una reducción del 80% del número de bacterias cuando se comparó con el control positivo después de 240 minutos. La susceptibilidad obtenida mediante citometría de flujo concordó con el 100% de las susceptibilidades obtenidas mediante los sistemas VITEK, Etest y Macrodilución en caldo.
REFERENCIAS
1. Kumar A, Congeni BL, Nankervis GA. Latex agglutination test for rapid detection of bacterial antigens in body fluids. Ann Clin Lab Sci. 1980;10:377-382.
2. Grif K, Fille M, Wurzner R, Weiss G, Lorenz I, Gruber G, et al. Rapid detection of bloodstream pathogens by real-time PCR in patients with sepsis. Wien Klin Wochenschr. 2012;124:266-270.
3. March GA, Eiros JM. Impacto de la metodología MALDI-TOF en la identificación clínica de agentes infecciosos. Electron J Biomed (revista electrónica) 2012;1:60-65. Disponible en: http://biomed.uninet.edu/2012/n1/march.html.
4. Alvarez-Barrientos A, Arroyo J, Canton R, Nombela C, Sanchez-Perez M. Applications of flow cytometry to clinical microbiology. Clin Microbiol Rev. 2000;13:167-195.
5. Kumar A, Ellis P, Arabi Y, Roberts D, Light B, Parrillo JE, et al. Initiation of inappropriate antimicrobial therapy results in a fivefold reduction of survival in human septic shock. Chest. 2009;136:1237-1248.
6. Kumar A, Roberts D, Wood KE, Light B, Parrillo JE, Sharma S, et al. Duration of hypotension before initiation of effective antimicrobial therapy is the critical determinant of survival in human septic shock. Crit Care Med. 2006;34:1589-1596.
7. Infectious Disease Society of America. Bad bugs, no drugs. As antibiotic discovery stagnates, a public health crisis brews. White paper. Alexandria: Infectious Disease Society of America, 2004; 1-35.
8. Eigner U, Schmid A, Wild U, Bertsch D, Fahr AM. Analysis of the comparative workflow and performance characteristics of the VITEK 2 and Phoenix systems. J Clin Microbiol. 2005;43:3829-3834.
9. Parks DR, Herzenberg LA. Fluorescence-activated cell sorting: theory, experimental optimization, and applications in lymphoid cell biology. Methods Enzymol. 1984;108:197-241.
10. Orfao A, Ruiz-Arguelles A. General concepts about cell sorting techniques. Clin Biochem. 1996;29:5-9.
11. Bonner WA, Hulett HR, Sweet RG, Herzenberg LA. Fluorescence activated cell sorting. Rev Sci Instrum. 1972;43:404-409.
12. Ramani R, Chaturvedi V. Flow cytometry antifungal susceptibility testing of pathogenic yeasts other than Candida albicans and comparison with the NCCLS broth microdilution test. Antimicrob Agents Chemother. 2000;44:2752-2758.
13. Green L, Petersen B, Steimel L, Haeber P, Current W. Rapid determination of antifungal activity by flow cytometry. J Clin Microbiol. 1994;32:1088-1091.
14. Gauthier C, St-Pierre Y, Villemur R. Rapid antimicrobial susceptibility testing of urinary tract isolates and samples by flow cytometry. J Med Microbiol. 2002;51:192-200.
15. Shrestha NK, Scalera NM, Wilson DA, Procop GW. Rapid differentiation of methicillin-resistant and methicillin-susceptible Staphylococcus aureus by flow cytometry after brief antibiotic exposure. J Clin Microbiol. 2011;49:2116-2120.
16. Dye C, Scheele S, Dolin P, Pathania V, Raviglione MC. Consensus statement. Global burden of tuberculosis: estimated incidence, prevalence, and mortality by country. WHO Global Surveillance and Monitoring Project. JAMA. 1999;282:677-686.
17. Pina-Vaz C, Costa-de-Oliveira S, Rodrigues AG. Safe susceptibility testing of Mycobacterium tuberculosis by flow cytometry with the fluorescent nucleic acid stain SYTO 16. J Med Microbiol. 2005;54(Pt 1):77-81.
18. Kirk SM, Schell RF, Moore AV, Callister SM, Mazurek GH. Flow cytometric testing of susceptibilities of Mycobacterium tuberculosis isolates to ethambutol, isoniazid, and rifampin in 24 hours. J Clin Microbiol. 1998;36:1568-1573.
19. Khan MM, Pyle BH, Camper AK. Specific and rapid enumeration of viable but nonculturable and viable-culturable gram-negative bacteria by using flow cytometry. Appl Environ Microbiol. 2010;76:5088-5096.
20. Schumacher WC, Storozuk CA, Dutta PK, Phipps AJ. Identification and characterization of Bacillus anthracis spores by multiparameter flow cytometry. Appl Environ Microbiol. 2008;74:5220-5223.
21. Brilha S, Proenca H, Cristino JM, Hanscheid T. Use of flow cytometry (Sysmex) UF-100) to screen for positive urine cultures: in search for the ideal cut-off. Clin Chem Lab Med. 2010;48:289-292.
22. Okada H, Sakai Y, Miyazaki S, Arakawa S, Hamaguchi Y, Kamidono S. Detection of significant bacteriuria by automated urinalysis using flow cytometry. J Clin Microbiol. 2000;38:2870-2872.
23. De Rosa R, Grosso S, Bruschetta G, Avolio M, Stano P, Modolo ML, et al. Evaluation of the Sysmex UF1000i flow cytometer for ruling out bacterial urinary tract infection. Clin Chim Acta. 2010;411:1137-1142.
24. Manoni F, Fornasiero L, Ercolin M, Tinello A, Ferrian M, Hoffer P, et al. Cutoff values for bacteria and leukocytes for urine flow cytometer Sysmex UF-1000i in urinary tract infections. Diagn Microbiol Infect Dis. 2009;65:103-107.
25. Wang J, Zhang Y, Xu D, Shao W, Lu Y. Evaluation of the Sysmex UF-1000i for the diagnosis of urinary tract infection. Am J Clin Pathol. 2010;133:577-582.
26. Okada H, Horie S, Inoue J, Kawashima Y. The Basic Performance of Bacteria Counting for Diagnosis of Urinary Tract Infection Using the Fully Automated Urine Particle Analyzer UF-1000i. Sysmex J Int. 2007;17:95-101.
27. Broeren MA, Bahceci S, Vader HL, Arents NL. Screening for urinary tract infection with the Sysmex UF-1000i urine flow cytometer. J Clin Microbiol. 2011;49:1025-1029.
28. Pieretti B, Brunati P, Pini B, Colzani C, Congedo P, Rocchi M, et al. Diagnosis of bacteriuria and leukocyturia by automated flow cytometry compared with urine culture. J Clin Microbiol. 2010;48:3990-3996.
29. Kadkhoda K, Manickam K, Degagne P, Sokolowski P, Pang P, Kontzie N, et al. UF-1000i flow cytometry is an effective screening method for urine specimens. Diagn Microbiol Infect Dis. 2011;69:130-136.
30. Andreu A, Cacho I, Coira A, Lepe JA. Procedimientos en Microbiología Clínica. Diagnóstico microbiológico de las infecciones del tracto urinario. 2ª Edición (14a), 2010. Disponible en: http://www.seimc.org/documentos/protocolos/microbiologia/
31. Broeren MA, Maas Y, Retera E, Arents NL. Antimicrobial susceptibility testing in 90 min by bacterial cell count monitoring. Clin Microbiol Infect. 2012 Feb 9.
CORRESPONDENCIA:
Gabriel Alberto March Rosselló.
Hospital Clínico Universitario de Valladolid
Plaza de la trinidad número 5 3º B
47003 Valladolid. España.
Mail: gmr810 @ hotmail.com
