Indice del volumen Volume index
Comité Editorial Editorial Board
Comité Científico Scientific Committee
RESISTENCIA A LOS ANTIBIÓTICOS EN CEPAS DE KLEBSIELLA PNEUMONIAE,
SERRATIA SPP. Y ACINETOBACTER SPP.
AISLADAS DE PACIENTES CON
INFECCIÓN DEL TRACTO URINARIO - LIMA, PERU
Daniel Angel Luján Roca1 Jimmy Omar Ibarra Trujillo2
Edgardo Mamani Huamán3
1Universidade Federal de Minas Gerais. Minas Gerais, Brasil.
2Facultad de Medicina y Ciencias de la Salud, Universidad Alas Peruanas;
3Dirección de Salud, Ministerio de Salud.
Lima, Perú.
d_lujan @ terra.com
Rev Electron Biomed / Electron J Biomed 2013;1:25-30.
Comentario del revisor Prof. Dr. José María Eirós Bouza MD. PhD. Catedrático de Microbiología. Facultad de Medicina de la UNiversidad de Valladolid. España.
Comentario del revisor Dra. Maria Ángeles Mantecón Vallejo PhD. Sección de Microbiología. Hospital Universitario de Burgos. España.
RESUMEN:
Introducción: La infección del tracto urinario (ITU) es una de las infecciones más comunes en la práctica clínica. Bacterias gramnegativas como Klebsiella pneumoniae, Serratia spp. y Acinetobacter spp. pueden causar ITU.
Objetivo: Estudiar la resistencia antibiótica en cepas de K. pneumoniae, Serratia spp. y Acinetobacter spp. aisladas de ITU.
Material y métodos: Urocultivos fueron colectados de Enero 2003 a Diciembre 2003. La identificación de las bacterias aisladas incluyó características bioquímicas. La prueba de difusión con discos de Bauer-Kirby fue realizada.
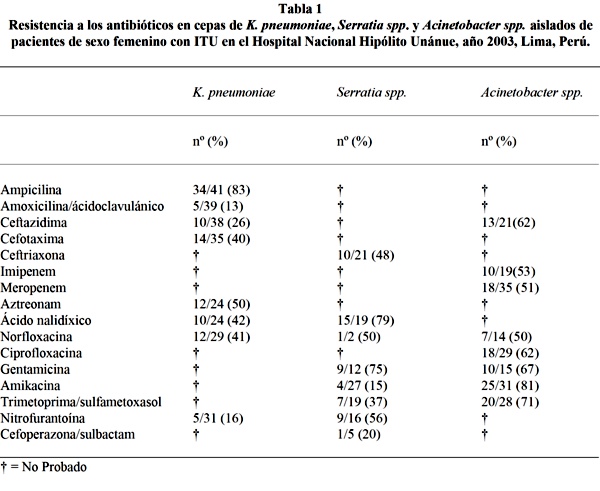
Resultados: Un total de 106 cepas fueron evaluadas (41 de K. pneumoniae, 28 de Serratia spp. y 37 de Acinetobacter spp.). Entre los aislados de K. pneumoniae la resistencia a ampicilina (83%) fue notable. Los aislados de Serratia spp. exhibieron un alto nivel de resistencia a ácido nalidíxico (79%) y gentamicina (75%). En los aislados de Acinetobacter spp. altas proporciones de resistencia fueron observados frente a amikacina (81%), gentamicina(67%) y trimetoprima/sulfametoxasol (71%).
Conclusiones: En general, los patrones de resistencia a los antibióticos fueron altos. Acinetobacter spp. manifestó elevada prevalencia de resistencia (>50%) frente a los antibióticos incluidos.
PALABRAS CLAVE:Klebsiella pneumoniae. Serratia spp. Acinetobacter spp. Resistencia antibiótica. Infección del tracto urinario.
SUMMARY: ANTIBIOTIC RESISTANCE IN KLEBSIELLA PNEUMONIAE, SERRATIA SPP. AND ACINETOBACTER SPP. STRAINS ISOLATED FROM PATIENTS WITH URINARY TRACT INFECTION - LIMA, PERU
Introduction: Urinary tract infection (UTI) is one of the most common infections in clinical practice. Gram negative bacteria as Klebsiella pneumoniae, Serratia spp. and Acinetobacter spp. can cause UTI.
Objective: To study antibiotic resistance in K. pneumoniae, Serratia spp. and Acinetobacter spp. strains isolated from UTI
Material and methods: Urine cultures were collected from January 2003 to December 2003. Identification of isolated bacteria included biochemical characteristics. Bauer-Kirby disc diffusion test was performed.
Results: A total of 106 strains were evaluated (41 of K. pneumoniae, 28 of Serratia spp. and 37 of Acinetobacter spp.). Among K. pneumoniae isolates resistance to ampicillin (83%) was remarkable. The Serratia spp. isolates displayed a high level of resistance to nalidixic acid (79%) and gentamicin (75%). In Acinetobacter spp. isolates high resistance rates were observed against amikacin (81%), gentamicin (67%) and trimethoprim/sulfamethoxazole(71%).
Conclusions: In general, antibiotic resistance patterns were high. Acinetobacter spp. showed elevated resistance rates (>50%) against antibiotics included.
KEY WORDS: Klebsiella pneumoniae. Serratia spp., Acinetobacter spp. Antibiotic resistance. Urinary tract infection.
INTRODUCCIÓN
La infección del tracto urinario (ITU) es un conjunto de procesos patológicos asociados a una respuesta inflamatoria como resultado de la presencia de microorganismos, generalmente bacterias. Después de las infecciones respiratorias, la ITU es la enfermedad más frecuente a nivel hospitalario y ambulatorio1; estimándose que el 48% de las mujeres sufrirá por lo menos un caso de ITU durante su vida2.
Las bacterias gramnegativas son la causa más frecuente de ITU, siendo reportadas entre ellas Klebsiella pneumoniae, Serratia spp. y Acinetobacter spp.; las cuales también pueden ocasionar otras importantes infecciones hospitalarias3-8.
Existe un problema actual respecto al tratamiento de la ITU ya que muchas cepas han desarrollado resistencia a diversos antibióticos. En Latinoamérica algunos estudios refieren el incremento de esta problemática9-11.
Por lo expuesto, el objetivo de esta comunicación es evaluar la resistencia a los antibióticos en cepas de K. pneumoniae, Serratia spp. y Acinetobacter spp. aisladas en pacientes de sexo femenino con ITU atendidos en el Hospital Nacional Hipólito Unanue.
MATERIAL Y METODOS
Fue realizado un estudio retrospectivo en el Hospital Nacional Hipólito Unánue (nivel III), ubicado en el distrito de El Agustino, Lima, Perú. El hospital cuenta con 653 camas.
Los resultados de los urocultivos de los pacientes ambulatorios e internados de sexo femenino fueron registrados durante el periodo de 1º de Enero al 31 de Diciembre de 2003. Solo un aislado por cada paciente fue considerado.
Las muestras de orina fueron sembradas en agar Mc Conkey y agar CLED e incubadas a 37º por 18-24 horas. El aislamiento de las cepas fue realizado de acuerdo a la guía del Instituto Nacional de Salud12. No se tomó en cuenta la sintomatología ó la edad. La ITU fue establecida para un conteo 105 UFC/mL.
El análisis de susceptibilidad se realizó mediante la técnica de Bauer-Kirby de disco difusión13 con recomendaciones del NCCLS14. Las cepas con susceptibilidad intermedia se asumieron como sensibles. Los siguientes antibióticos fueron incluidos: ampicilina (10µg), amoxicilina/ácido clavulánico (20/10µg) ceftazidima (30µg), cefotaxima (30µg), ceftriaxona (30µg), imipenem (10µg), meropenem (10µg) aztreonam (30µg), ácido nalidíxico (30µg), norfloxacina (10µg), ciprofloxacina (5µg), gentamicina (10µg), amikacina (30µg), trimetoprima/sulfametoxasol (25µg), nitrofurantoína (300µg) y cefoperazona/sulbactam (75µg/30 µg). Como cepas control fueron utilizadas Pseudomonas aeruginosa ATCC 27853 y Escherichia coli ATCC 25922.
Para el análisis estadístico se utilizó la prueba Mid-P exacta para proporciones simples.
RESULTADOS
Durante el año de estudio fueron aisladas 41 cepas de K. pneumoniae (38,7% [IC 95%=29,4%-48,6%]), 28 de Serratia spp. (26,4% [IC 95%=18,3%-35,9%] y 37 de Acinetobacter spp. (34,9% [IC 95%=25,9%-44,8%]) sumando 106 cepas (10,6% [IC 95%=8,8%-12,6%]) de un total de 1002 microorganismos aislados en orina.
El análisis de la prevalencia de resistencia durante el periodo de análisis mostró que K. pneumoniae fue altamente resistente a ampicilina (83%), mientras que, la resistencia a amoxicilina/ácido clavulánico y nitrofurantoína fue moderada (13-16%). En el caso de Serratia spp. se registraron elevadas resistencias a ácido nalidíxico y gentamicina (75-79%), entretanto, frente a amikacina se constató una resistencia ligera (15%). Referente a los aislados de Acinetobacter spp. estos presentaron globalmente proporciones de resistencia por encima del 50%, siendo las más elevadas para trimetoprima/sulfametoxasol, gentamicina y amikacina (67-81%) (Tabla 1).
DISCUSIÓN
La ITU se encuentra entre las infecciones más comunes en la práctica clínica, resultando en una considerable ansiedad y morbilidad entre las mujeres15. La etiología y la frecuencia de los agentes causantes de ITU ha sido bien documentada3, 16-18.
En nuestro estudio K. pneumoniae evidenció una alta resistencia a ampicilina (83%), lo cual corresponde con otros estudios realizados19-20. Esta elevada cifra indica que este antibiótico debe ser desestimado como opción terapéutica de primera línea.
En el caso de Serratia spp. la mayor resistencia se presentó frente al ácido nalidíxico (79%), similar a lo constatado en un análisis21 aunque mayor a lo indicado en otro22. Este antibiótico es específico para la ITU aunque con la desventaja de que puede manifestarse una rápida aparición de bacterias resistentes.
Asimismo Acinetobacter spp. exhibió una considerable resistencia frente a amikacina(81%), cifra mayor a otros reportes23-24. Hallazgo poco menos que preocupante ya que este es un potente antibiótico indicado para infecciones severas.
Tanto Serratia spp. así como Acinetobacter spp. presentaron resistencia a trimetoprima/sulfametoxazol por encima del 20% que es el límite recomendado por The Infectious Diseases Society of America (IDSA)25 y por lo tanto su uso no sería recomendable en el tratamiento empírico de la ITU.
Cabe resaltar que Acinetobacter spp. en general registró niveles de resistencia arriba del 50% para los antibióticos incluidos en el estudio. Hecho que no es sorprendente ya que la resistencia de Acinetobacter spp. a diversos antibióticos en años recientes se ha incrementado8,26-29 debido probablemente a la relativa impermeabilidad de su membrana externa y a la exposición ambiental a un amplio grupo de genes de resistencia30.
Lamentablemente no se dispuso de información de la producción de betalactamasas (AmpC, BLEE y carbapenemasas) las cuales tienen participación importante en el fenómeno de la resistencia a los antibióticos31-32.
Algunas sugerencias para disminuir el impacto en la salud de la resistencia a los antibióticos son: evitar el uso indiscriminado de antibióticos por parte de los médicos, evitar la automedicación y el incumplimiento terapéutico luego de iniciada la mejoría clínica del cuadro, evitar la dispensación de antibióticos sin receta médica e incrementar las campañas informativas sobre uso racional de antibióticos33.
Finalmente, los microorganismos estudiados registraron considerables niveles de resistencia a los antibióticos utilizados, especialmente Acinetobacter spp., correspondería a las autoridades sanitarias tomar cartas en el asunto y viabilizar soluciones para evitar que se agudice este problema en ese hospital.
CONCLUSIONES
En general, los patrones de resistencia a los antibióticos fueron altos. Acinetobacter spp. manifestó elevada prevalencia de resistencia (>50%) frente a los antibióticos incluidos.
REFERENCIAS
1. Pemberthy C, Gutiérrez J, Arango N, Monsalve M, Giraldo N, Gutiérrez F, et al. Aspectos clínicos y farmacoterapéuticos de la infección del tracto urinario. Revisión estructurada. Rev CES Med 2011;25:135-152.
2. Heilberg IP, Schor N. Abordagem diagnóstica e terapêuticana infecção do trato urinário-ITU. Rev Assoc Med Bras 2003;49:109-16.
3. Luján DA, Pajuelo GR. Frecuencia y susceptibilidad antimicrobiana de patógenos aislados en infección del tracto urinário. Rev Biomed 2008;19:110-115.
4. Amin A, Ghumro PB, Hussain S, Hameed A. Prevalence of antibiotic resistance among clinical isolates of Klebsiella pneumoniae isolated from a tertiary care hospital in Pakistan. Malaysian J Microbiol 2009;5:81-86.
5. Li B, Yi Y, Wang Q, Woo PCY, Tan L, Jing H, et al. Analysis of drug resistance determinants in Klebsiella pneumoniae isolates from a tertiary-care hospital in Beijing, China. PLoS ONE 2012;7(7):e42280.
6. Lancaster LJ. Role of Serratia species in urinary tract infections. Arch Intern Med 1962;109:536-539.
7. Manjunath GN, Prakash R, Vamseedhar A, Kiran S. Changing trends in the spectrum of antimicrobial drug resistance pattern of uropathogens isolated from hospital and community patients with urinary tract infections in Tumkur and Bangalore. Int J Biol Med Res 2011;2:504-507.
8. Nazmul MHM, Jamal H, Fazlul MKK. Acinetobacter species-associated infections and their antibiotic susceptibility profiles in Malaysia. Biomed Res-India 2012;23:571-575.
9. Andrade SS, Sader HS, Jones RN, Pereira AS, Pignatari ACC, Gales AC. Increased resistance to first-line agents among bacterial pathogens isolated from urinary tract infections in Latin America. Mem Inst Oswaldo Cruz 2006;101:741-748.
10. Castro R, Barreto AC, Guzmán H, Ortega RJ, Benítez L. Patrones de resistencia antimicrobiana en uropatógenos gramnegativos aislados de pacientes ambulatorios y hospitalizados Cartagena, 2005-2008. Rev Salud Publica 2010;12:1010-1019.
11. Luján DA, Luján LM, Mamani E. Padrão de susceptibilidade antimicrobiana de Enterobacter spp. isolada de infecções urinárias em pacientes ambulatoriais em um hospital da cidade de Lima, Peru. Perspect Med 2009;20:16-18.
12. Instituto Nacional de Salud. Manual de procedimientos bacteriológicos en infecciones intrahospitalarias. Ministerio de Salud. Lima, Perú. 2001.
13. Bauer AW, Kirby EM. Antibiotic susceptibility testing by standardized single disk method. Am J Clin Pathol 1966;45:493-496.
14. NCCLS. Performance standards for antimicrobial disk susceptibility tests. Approved standard M02-A7. National Committee for Clinical Laboratory Standards, Villanova. PA. USA; 2002.
15. Car J. Urinary tract infections in women: diagnosis and management in primary care. Br Med J 2006;332:94-97.
16. Kiffer CR, Mendes C, Oplustil CP, Sampaio JL. Antibiotic resistance and trend of urinary pathogens in general outpatients from a major urban city. Int Braz J Urol 2007;33:42-49.
17. Jones RN, Kugler KC, Pfaller MA, Winokur PL, and the Sentry Surveillance Group, North America. Characteristics of pathogens causing urinary tract infections in hospitals in North America: results from the Sentry Antimicrobial Surveillance Program 1997. Diagn Microb Infect Dis 1999;35:55-63.
18. Ochoa C, Eiros JM, Pérez C, Inglada L y grupo de Estudio de los Tratamientos Antibióticos. Etiología de las infecciones del tracto urinario y sensibilidad de los uropatógenos a los antimicrobianos. Rev Esp Quimioterap 2005;18:124-135.
19. Sikarwar AS, Batra HV. Prevalence of antimicrobial drug resistance of Klebsiella pneumoniae in India. IJBBB 2011;1:211-215.
20. Cardona M, Castaño JJ, Coral SC, Martínez XG, Gañan A, García YL, y col. Comportamiento de la sensibilidad y resistencias en urocultivos de pacientes adultos con infección urinaria de Manizales, 2009. Arch Med (Manizales) 2011;11:9-22.
21. Manikandan S, Ganesapandian S, Singh M, Kumaraguru AK. Antimicrobial susceptibility pattern of urinary tract infection causing human pathogenic bacteria. Asian J Med Sci 2011;3:56-60.
22. Alvarez J. Mapa bacteriológico de bacilos Gram negativos. Tesis doctoral. Madrid, España, Universidad Complutense, 1991.
23. Amim M, Mehdinejad M, Pourdangchi Z. Study of bacteria isolated from urinary tract infection and determination of their susceptibility to antibiotics. Jundishapur J Microbiol 2009; 2:118-123.
24. Lee K, Kim MN, Kim JS, Hong HL, Kang JO, Shin JH, et al. Further increases in carbapenem-, amikacin-, and fluoroquinolone-resistant isolates of Acinetobacter spp. and Pseudomonas aeruginosa in Korea: KONSAR study 2009. Yonsei Med J 2011; 52:793-802.
25. Warren JW, Abrutyn E, Hebel JR, Johnson JR, Schaeffer AJ, Stamm WE. Guidelines for antimicrobial treatment uncomplicated acute bacterial cystitis and acute pyelonephritis in woman. Infectious Diseases Society of America (IDSA). Clin Infect Dis 1999;29:745-758.
26. Bergogne-Bérézin E, Towner KJ. Acinetobacter species as nosocomial pathogen: microbiological, clinical and epidemiological features. Clin Microbiol Rev 1996;9:148-165.
27. Prashanth K, Badrinath S. Nosocomial infections due to Acinetobacter species: clinical findings, risk and prognostic factors. Indian J Med Microbiol 2006;24:39-44.
28. Corrêa LL, Botelho LAB, Barbosa LC, Mattos CS, Carballido JM, de Castro CLT, et al. Detection of blaOXA-23 in Acinetobacter spp. isolated from patients of a university hospital. Braz J Infect Dis 2012;16:521-526.
29. Lahiri KK, Mani NS, Purai SS. Acinetobacter spp. as nosocomial pathogen: clinical significance and antimicrobial sensitivity. MJAFI 2004;60:7-10.
30. Hernández A, García E, Yagüe G, Gómez J. Acinetobacter baumanii multirresistente: situación clínica actual y nuevas perspectivas. Rev Esp Quimioterap 2010;23:12-19.
31. Livermore DM. ?-lactamase-mediated resistance and opportunities for its control. J Antimicrob Chemother 1998;41(Suppl. D):25-41.
32. Philippon A, Arlet G. Les bêta-lactamases chez les bacilles à Gram-négatif que de nouveautés en 15 ans!. Antibiotiques 2005;7:247-259.
33. Candel FJ, Matesanz M, Candel I, Betriu C, Picazo JJ. ¿Qué hacer frente al aumento de la resistencia a los antibióticos?. JANO 2003;64:35-40.
AGRADECIMIENTOS:
AL Hospital Nacional Hipólito Unánue por el soporte económico del trabajo.
CORRESPONDENCIA:
Dr. Daniel Angel Luján Roca
Rua Pedra Bonita 1131/33. Bairro Alto Barroca.
Belo Horizonte
Minas Gerais
Brasil.
d_lujan @ terra.com