Indice del volumen Volume index
Comité Editorial Editorial Board
Comité Científico Scientific Committee
SEDOANALGESIA CON KETAMINA-MIDAZOLAM-FENTANILO EN RATONES.
CARACTERÍSTICAS Y SEGUIMIENTO POR UNA PLANILLA DE REGISTRO.
Gustavo A. Elena PhD1, Darío G. Colucci1, Guillermina Harvey1,
Gastón Echaniz1, Carolina Fini1, Francisco Consiglio1,
Nora Raquel Puig PhD1-2.
1Instituto de Inmunología, Facultad de Ciencias Médicas.
2Consejo de investigaciones,
Universidad Nacional de Rosario.
Rosario. República Argentina.
inmunestesia @ yahoo.com.ar
Rev Electron Biomed / Electron J Biomed 2014;1:25-32.
Comentario de la revisora Dra. Paula A. Enz, MD.
Servicio de Dermatología. Hospital Italiano de Buenos Aires. Argentina
Comentario del revisor Dr. Carlos G. Musso. Unidad de Biología del Envejecimiento. Hospital Italiano de Buenos Aires. Argentina
RESUMEN:
El presente trabajo se propuso analizar la utilidad de una planilla que registra los cambios clínicos para caracterizar la sedoanalgesia obtenida con ketamina-midazolam-fentanilo en ratones. Los efectos de las drogas anestésicas utilizadas para alcanzar el estado de sedoanalgesia dependen, entre otros factores, de la edad de los animales.
En el presente trabajo se compararon las variables que caracterizan la sedoanalgesia en ratones machos púberes, adultos jóvenes y adultos mayores. No se observó diferencia atribuible a la edad en las latencias hasta sedación y analgesia y se registró una menor duración de la sedoanalgesia inicial en los adultos mayores. Además en este grupo se verificó alta mortalidad, que no pudo modificarse al variar el esquema anestésico.
El seguimiento sistemático realizado permitió cuantificar los efectos del procedimiento anestésico y su interacción con animales de experimentación en diferentes etapas de desarrollo. Los resultados indicarían diferencias relacionadas con la edad y una respuesta más heterogénea de los adultos mayores frente a estas drogas anestésicas.
PALABRAS CLAVE: Anestesia. Roedores. Ficha anestésica. Sedación. Anestesia intraperitoneal
SUMMARY:
Ketamine-midazolam-fentanyl sedoanalgesia in mice. Characteristics and follow up by a specially designed anesthetic chart. The aim of this work was to analyze the characteristics of ketamine-midazolam-fentanyl sedoanalgesia in puber, adult and 200 days old mice. Variables were recorded in a specially designed anesthetic chart, where complementary physiological information was also recorded.
Latency to achieve unconsciousness and blockade of motor response to a noxious stimulus was registered, together with the period needed to recover from these stages. Sedoanalgesia was achieved when both end points were obtained. There were no age-related differences in latency to unconsciousness and analgesia, but the sedoanalgesia was shorter in 200 days old mice. Additionally, in the 200 days old mice group mortality was registered, which could not be modified by reducing the anesthetics dose.
The anesthetic schedule was adequate for providing sedoanalgesia to puber and adult mice, but not suitable for 200 days old mice. Systematic follow up by means of the anesthetic chart proved to be useful to assist the recognition of adverse effects, and to reduce the overall drug dosage, since maintaining physiological conditions is important for the overall outcome following anaesthesia.
KEY WORDS: Anesthesia. Rodents. Anesthetic chart. Sedation. Intraperitoneal anesthesia
INTRODUCCIÓN
La utilización y manipulación de animales en programas de investigación los enfrenta a situaciones con potencial capacidad para generar estrés y distrés. Cualquier estímulo que cause lesión de algún tejido o cambios en el bienestar de los animales, aunque fuere de baja intensidad o duración, puede ser disparador de respuestas de estrés y de los mecanismos de adaptación, y aún de cambios en la respuesta inmunitaria. La administración de anestésicos resulta necesaria no sólo para facilitar procedimientos quirúrgicos sino para disminuir la expresión dañina de la respuesta de estrés. Los animales deberán recibir los cuidados necesarios para mantener la homeostasis1-5.
Se han descrito respuestas particulares a los anestésicos en las diferentes etapas de la vida, como en los neonatos, pubertad, adultos jóvenes y mayores6-7.
Entre los estímulos generados en la manipulación puede incluirse al traslado o la realización de maniobras necesarias para la administración de diversos tratamientos, en cuyo caso podría indicarse como protección la sedación o la sedoanalgesia. La sedación es la depresión del nivel de conciencia (alteraciones en la percepción cognitiva), mientras se mantiene la vía aérea permeable y la respuesta a estímulos sensoriales. Si bien analgesia significa ausencia de dolor, se entiende por analgesia clínica a la reducción de la intensidad del dolor percibido. Sedoanalgesia, entonces, es la combinación de un estado de depresión de la conciencia (sedación), acompañado de analgesia clínica8.
Los cambios clínicos que acompañan a la sedoanalgesia constituyen una fuente de información para caracterizar adecuadamente el procedimiento empleado. El registro de dichos cambios en una planilla anestésica constituye un testimonio permanente, confiable y contemporáneo del curso del procedimiento, debido a que se construye con un recuento detallado de las decisiones tomadas, así como de las repercusiones fisiológicas9. Así, se condensa, en forma contemporánea con la acción, la evolución clínica del procedimiento frente a todas las complejas contingencias de una situación tan particular y crítica como es el acto anestésico10.
En la actualidad, el registro de los efectos de los anestésicos en ratones no es práctica habitual. Se propone aquí verificar la utilidad del seguimiento de los cambios clínicos en una planilla para validar la eficacia de un procedimiento de sedoanalgesia y reducir la cantidad total de anestésico administrado, lo que mejorará el resultado global del procedimiento11.
En la elección de los fármacos a administrar se ha considerado que para traslado y manipulación de animales bajo sedoanalgesia se requiere la utilización de drogas que no exijan la conexión permanente a dispositivos que administren la misma, tales como anestésicos inhalatorios. Para ello se cuenta con drogas que pueden ser administradas en forma intraperitoneal y reúnen acciones farmacodinámicas que proveen sedoanalgesia. Para la sedación, pueden ser útiles las benzodiacepinas, que aumentan el potencial de reposo de los receptores benzodiacipínicos. Dentro de ellas, el midazolam muestra un perfil farmacocinético adecuado. El compuesto sintético fentanilo, opioide con función agonista de los receptores µ, se consideró adecuado para la analgesia. Además la ketamina, una fenciclidina antagonista de los receptores de N-metil-D-aspartato, con propiedades combinadas de sedación y analgesia, ha sido utilizada en anestesia veterinaria. Estas tres drogas administradas conjuntamente, actúan sinérgicamente para alcanzar sedoanalgesia con amplio margen terapéutico12.
Objetivo: En el presente trabajo se describirán y compararán las variaciones en el estado clínico que ocurren bajo sedoanalgesia con ketamina-midazolam-fentanilo en ratones púberes, adultos jóvenes y adultos mayores.
Se utilizaron ratones machos de la cepa CBi13 cuyo manejo se efectuó según normas establecidas por el Committee for the Update of the Guide for the Care and Use of Laboratory Animals14. Los procedimientos se refinaron para reducir dolor e incomodidades de acuerdo con las recomendaciones bioéticas internacionales para el empleo experimental de roedores de laboratorio y los requerimientos del Comité Institucional para el Cuidado y Uso de Animales de Laboratorio (CICUAL), Facultad de Ciencias Médicas, UNR.
Grupos experimentales
Se trabajó con tres grupos de animales: Grupo púberes: 49 días de edad; Grupo adultos jóvenes: 100 días de edad y Grupo adultos mayores: mayores de 230 días de edad. Cada animal integró sólo uno de los grupos experimentales.
Método anestésico
Para la sedoanalgesia se administró ketamina 60 mg/kg, midazolam 5mg/kg y fentanilo 25µg/kg. La mezcla se realizó inmediatamente antes de la administración por vía intraperitoneal, con el animal en decúbito dorsal, en el hemiabdomen inferior izquierdo, con aguja 23g ó 25g y líquido a temperatura 22° a 27°C. El procedimiento fue llevado a cabo en un ambiente cálido (27-28°C, mediante la utilización de lámpara infrarroja y plaqueta de calor) y silencioso, sobre superficie almohadillada y no se realizaron procedimientos simultáneos.
Criterio de reinyección: Una vez alcanzada la sedoanalgesia, al registrarse cualquiera de los indicadores de interrupción de sedoanalgesia, se realizó una segunda inoculación, administrando un tercio de la dosis inicial de la mezcla anestésica.
Descripción de la planilla de seguimiento anestésico (Figura 1)
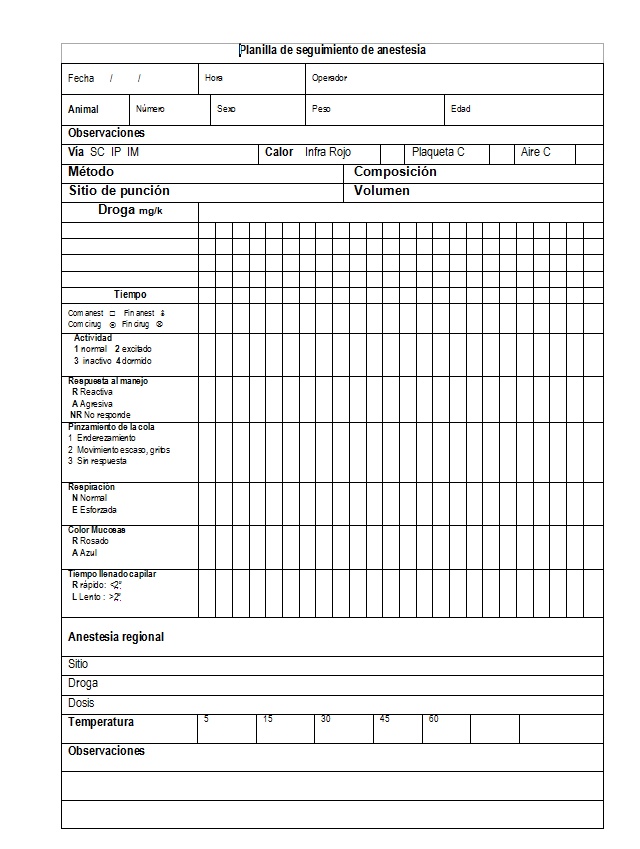
La planilla de datos clínicos de la anestesia recabó:
1. Datos estáticos: No son tiempo-dependientes, corresponden a tareas repetitivas, preestablecidas, programadas y normadas de acuerdo a una rutina, que consiste en la estructura del proceso (protocolo), se corresponden con acciones de bajo nivel decisorio ya que obedecen a determinaciones normadas y rutinarias. Estos datos cubren los siguientes aspectos del acto anestésico:
a) Procedimientos profilácticos relacionados con el bienestar del animal, limpieza y asepsia.
b) Procedimientos rutinarios: posición, método de fijación, administración de oxígeno.
c) Descripción de la técnica anestésica.
d) Enumeración de los monitores empleados.
Se registraron la fecha, hora, operador, la identificación del animal y su sexo, peso y edad. Asimismo, se indicó el método de administración de calor. En relación a la anestesia general, las drogas administradas, número de dosis, vía de administración, sitio de punción y volumen total.
2. Datos dinámicos: Son tiempo-dependientes, corresponden a tareas no programadas y no repetitivas, reflejan la toma de decisiones
Durante el procedimiento, se registró la respuesta clínica mediante variables funcionales (cambiantes de momento en momento) como expresión de los parámetros vitales registrados por el operador.
Los datos del presente trabajo incluyen: comienzo y fin del procedimiento anestésico, tipo de actividad, respuesta al manejo, respuesta a un estímulo doloroso, tipo de respiración, color de las mucosas y tiempo llenado capilar. Adicionalmente, para evaluar la presencia de signos de distress e incomodidad, se registraron los siguientes cambios dinámicos post anestésicos: tipo de actividad, ingestión de alimentos y agua, peso y conducta a las 24, 48 y 72 horas después del procedimiento anestésico15-16.
En resumen, la planilla anestésica registró, mediante signos convenidos para tal fin, los pasos más importantes: secuencia de los estímulos realizados y la respuesta a los mismos, información relacionada con la respuesta hemodinámica y la temperatura del animal, comienzo y fin del procedimiento anestésico. El sector de Observaciones, señala situaciones particulares de cada procedimiento, contingencias inesperadas derivadas de las maniobras realizadas
Variables
Dado que la sedoanalgesia puede ser indicada por la falta de respuesta a diversos estímulos, se registraron diversos indicadores.
Actividad: Normal: camina y explora el territorio. Excitado: desplazamientos constantes sin propósito determinado ni exploratorio, agresivo, o emisión de gritos. Inactivo: movimientos de desplazamiento ausentes, sólo movimientos en el lugar (cabeza y/o miembros) o Dormido: reposo en decúbito sin movimientos, relajado.
Respuesta al manejo: Se observa la respuesta del animal tras la implementación de cambios pasivos de posición: Reactiva: despierta, deambula o intenta huir; Agresiva: gritos y/o conductas de ataque o No responde: permanece en la posición en la que se lo coloca.
Pinzamiento de la cola: Evalúa la respuesta ante un estímulo doloroso estandarizado, modificación del método de Haffner17, que consiste en aplicar una presión equivalente a 500g en la parte media de la cola, sin producir lesión de la piel. Categorías: Enderezamiento: despierta, cambios de posición o deambulación; Movimientos escasos: responde con movimientos de los miembros pero sin cambios de la posición o Sin respuesta: no se observa reacción frente al estímulo.
El movimiento escaso y enderezamiento representan dos intensidades de respuesta que están en relación a la profundidad de la analgesia.
Respiración: Normal: movimientos respiratorios con abdomen y tórax en forma coordinada o Esforzada: movimientos respiratorios descoordinados de tórax y abdomen, tiraje, respiración superficial.
Color de mucosas y piel: Se observa la coloración de las superficies mucosas de la boca y nariz y de las cutáneas en los miembros, en las zonas desprovistas de pelo. Categorías: Rosado: indicador de buena perfusión tisular, Violáceo: signo de mala oxigenación e hipercarbia.
Tiempo de llenado capilar: Se evalúan dos categorías, de acuerdo al tiempo de recuperación de la coloración normal de la piel, luego de ejercer compresión digital en la cara plantar de las patas traseras: categorías: Rápido: menor a 2 segundos; Lento: superior a 2 segundos
Registros: Se realizaron cada minuto después de la administración de la mezcla anestésica y hasta los 5 min y luego, cada 5 min hasta la recuperación total.
A partir de los datos registrados se calcularon latencias: el tiempo en minutos que transcurre entre la inoculación de las drogas hasta que el animal no responde al manejo, se ha dormido como indicador de actividad (indicadores de sedación) y que no responde tras el pinzamiento de la cola (indicador de analgesia).
Además, se definió como inicio de sedoanalgesia el momento en el que el animal presentó simultáneamente respuesta negativa al manejo, estaba dormido, no respondía al pinzamiento de la cola y mantenía respiración espontánea normal. Una vez alcanzada la sedoanalgesia, la modificación de cualquiera de estos indicadores determinaba la administración de una dosis adicional de la mezcla anestésica, correspondiente a un tercio de la dosis inicial.
Duración del acto anestésico: Tiempo en min. desde la inoculación de las drogas hasta la recuperación de actividad normal, donde el animal deambula, explora el territorio.
Como duración de sedoanalgesia se consideró al resultado de la suma de la duración de la sedoanalgesia inicial y la post-reinyección.
Análisis estadístico:
Se obtuvieron las medidas estadísticas de resumen para los grupos experimentales: promedio ± DE (desvío estándar) o bien mediana (mín. - máx.) y se realizaron las comparaciones aplicando el análisis de la variancia a un factor (ANOVA) o el test de Kruskal-Wallis según correspondiera de acuerdo a la distribución de los datos. Cuando se encontraron resultados estadísticamente significativos tras la aplicación del ANOVA, se realizaron las comparaciones múltiples según el test de Tuckey. Para comparar frecuencias se utilizó el test de Chi-cuadrado. Se consideró como estadísticamente significativa una probabilidad asociada menor que 0,05.
RESULTADOS
Los datos de la población estudiada se presentan en la tabla 1.
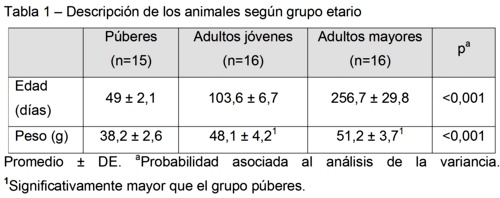
Con respecto a las latencias hasta alcanzar los parámetros indicadores de sedoanalgesia, no se verificaron diferencias significativas entre los grupos (tabla 2). No hubo una respuesta homogénea dentro de cada edad ante los diferentes estímulos y en ambos grupos adultos se verificó que la latencia hasta actividad dormido fue menor que la latencia hasta no respuesta al pinzamiento de cola.
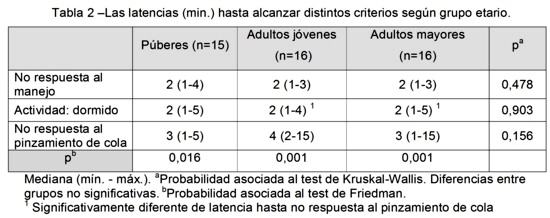
En la tabla 3 se resumen indicadores del procedimiento anestésico. En la duración sedoanalgesia inicial se hallaron diferencias significativas entre los grupos (p=0,006) y que la duración de la sedoanalgesia inicial fue mayor en los púberes con respecto a los adultos mayores (p=0,005). En cuanto a la duración de la sedoanalgesia post-reinyección no se observan diferencias significativas entre grupos. Los grupos estudiados no difirieron significativamente en la duración de total de la sedoanalgesia y del procedimiento anestésico.
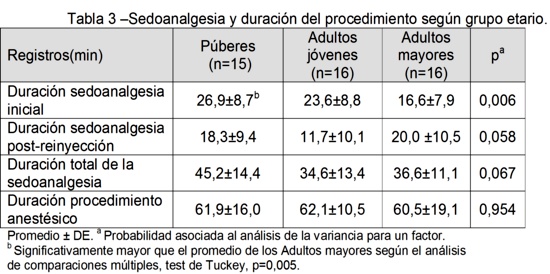
En los animales que se recuperaron de la anestesia, no se registraron cambios a lo largo del procedimiento en la respiración, el tiempo de llenado capilar, el color de la piel y mucosas y la temperatura rectal.
Efectos adversos: En el grupo de adultos mayores se verificó muerte de animales durante la anestesia (6 de 22 animales, 27,3%, 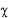 2 = 7,3; p<0,05). Los datos presentados en las tablas 1, 2 y 3 corresponden a los 16 animales sobrevivientes. En la búsqueda de disminuir la mortalidad, se procedió a reducir la dosis de la mezcla anestésica en 20%. Al evaluar 20 animales adultos mayores, la mortalidad no se modificó significativamente cuando se disminuyó la dosis de la mezcla anestésica (murieron 3 de 20, 15%,
2 = 7,3; p<0,05). Los datos presentados en las tablas 1, 2 y 3 corresponden a los 16 animales sobrevivientes. En la búsqueda de disminuir la mortalidad, se procedió a reducir la dosis de la mezcla anestésica en 20%. Al evaluar 20 animales adultos mayores, la mortalidad no se modificó significativamente cuando se disminuyó la dosis de la mezcla anestésica (murieron 3 de 20, 15%, 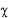 2 = 0,937; p=0,333) y 10/17 animales no lograron sedoanalgesia, tanto con la dosis inicial como con la dosis post-reinyección, por lo que la mezcla compuesta por ketamina 48mg/kg, midazolam 4mg/kg y fentanilo 20 ug/kg, no proveyó adecuada sedoanalgesia en este grupo etáreo.
2 = 0,937; p=0,333) y 10/17 animales no lograron sedoanalgesia, tanto con la dosis inicial como con la dosis post-reinyección, por lo que la mezcla compuesta por ketamina 48mg/kg, midazolam 4mg/kg y fentanilo 20 ug/kg, no proveyó adecuada sedoanalgesia en este grupo etáreo.
En cuanto a los controles post anestésicos, la actividad, ingestión de alimentos y agua, peso y conducta a las 24, 48 y 72 horas después del procedimiento anestésico fueron normales.
DISCUSIÓN
La utilización de la planilla anestésica permitió establecer que la edad de los ratones determina las particularidades de la sedoanalgesia obtenida con ketamina-midazolam-fentanilo, principalmente al evaluar la mortalidad y la duración de la sedoanalgesia inicial. La planilla de seguimiento permitió describir la evolución de variables relevantes en el proceso anestésico. Así, se pudo conocer en los diferentes grupos la latencia para alcanzar la sedoanalgesia y su duración. Esto permitirá estimar el momento adecuado para prolongar la sedoanalgesia mediante la administración de una segunda dosis, equivalente a un tercio de la dosis inicial, en caso de ser necesaria una sedoanalgesia de mayor duración.
Las diferencias observadas en la duración de la sedoanalgesia inicial entre los ratones púberes (26,9±8,7 min) y adultos mayores (16,6±7,9 min), podrían ser atribuidas a una diferente tasa de absorción de la mezcla anestésica administrada. Sin embargo, a pesar de la influencia de la edad en la farmacocinética y farmacodinamia, las tasas de eliminación de los compuestos anestésicos podrían ser semejantes, ya que no se observaron diferentes duraciones del procedimiento anestésico18
El esquema anestésico evaluado en este trabajo no sería adecuado para animales adultos mayores, dada la alta mortalidad (27%), que no se redujo en forma significativa con una dosis menor de fármacos administrados. En estas experiencias no se ha comprobado la presencia de marcadores clínicos específicos que señalaran a los animales con peligro cierto de sufrir efectos adversos y que permitieran identificar antes del procedimiento a los ratones susceptibles. La reducción de la cantidad de anestésico no ofreció sedoanalgesia adecuada en el 58.8% de los animales de este grupo etario, lo que indicaría que los ratones adultos mayores resultan más heterogéneos en su respuesta que los otros grupos estudiados.
Con respecto a los indicadores utilizados en este trabajo, se comprueba que los efectos sedantes evaluados a través de la actividad se manifiestan precozmente con respecto a la analgesia en ambos grupos de adultos. Las dosis de mezcla anestésica deben ser modificadas en caso de recurrir a un estímulo nociceptivo de mayor intensidad19. La evaluación permanente de los animales permitió reconocer tempranamente que la respuesta al estímulo doloroso fue precoz con respecto a la recuperación de los indicadores de salida de sedación.
La evaluación de la respiración, la perfusión, la oxigenación y la regulación de la temperatura ambiente y de los líquidos administrados para lograr una temperatura central constante en los animales que durante el procedimiento anestésico pierden mecanismos de ganancia de temperatura (piloerección, espasmos musculares, vasoconstricción), asegurarán la estandarización de los procedimientos anestésicos. Asimismo, el seguimiento de los procedimientos anestésicos permitirá administrar una anestesia tan corta como sea posible, con la consiguiente reducción de la cantidad total de anestésico administrado y un mejor cuidado de los animales, contribuyendo así a evitar sesgos en los resultados experimentales.
El seguimiento de los cambios clínicos durante el procedimiento permite concluir que el registro sistemático es útil para evaluar y caracterizar los efectos de las drogas con propiedades sedoanalgésicas.
REFERENCIAS
1.- Definition of pain and distress and reporting requirements for laboratory animals. Commite on Regulatory Issues in Animal Care and Use. Institute for Laboratory Animal Research. National Research Council 2000.
2.- Hurford W, Bailin M, Davison J, Haspel K, Rosow C. Procedimientos de anestesia. Quinta Edición. Massacusetts General Hospital Marban Libros, SL Madrid España 1999
3.- Smith JA, Birke L, Sadler D. Reporting animals use in scientific papers. Lab Anim 1997;31:312-317
4.- Carstens E, Moberg GP. Recognizing pain and distress in laboratory animals. ILAR Journal 2000;41:62-67.
5.- Colucci D, Harvey G, Gayol MC, Elena G, Puig N. Halothane anesthesia in mice: effect on the phagocytic activity and respiratory burst of peritoneal macrophages. Neuroinmmunomodulation 2011;18:11-18.
6.- Minto CF, Schnider TW, Egan TD, Youngs E, Lemmens HJ, Gambus PL, Billard V, Hoke JF, Moore KH, Hermann DJ, Mandema JW, Shafer SL. Influence of age and gender on the pharmacokinetics and pharmacodynamics of remifentanil: 1. Model development. Anesthesiology 1997;86:10-23.
7.- Fang Z, Ionescu P, Gong D, Kendig J, Harris A, Eger EI 2nd. Maturation Decreases Ethanol Minimum Alveolar Anesthetic Concentration in Mice as Previously Demonstrated in Rats: There Is No Species Differences. Anesth Analg 1997;85:160-163.
8.- Estébanez-Montiel MB, Alonso-Fernandez MA, Sandiumenmge A, Jiménez-Martín MJ. Sedación prolongada en Unidades de Cuidados Intensivos. Med Intensiva 2008;32:19-30
9.- Wikinski JA, Piaggio AN. La historia clínica de anestesia y sus implicaciones medico-legales, Revista Argentina de Anestesiología 1993;51:15-36
10.- WVU ACUC Approved guidelines: anesthesia and analgesia in rats. West Virginia University. Animal Care and Use Committee. 2011, www.oric.research.WVU.edu/animals/guidelines
11.- Sinner B, Becke K, Engelhard K. General anaesthetics and the developing brain: an overview. Anaesthesia. 2014 May 14. doi: 10.1111/anae.12637.
12.- Arras M, Autenried P, Rettich A, Spaeni D, Rülicke T. Optimization of intraperitoneal injection anesthesia in mice: drugs, dosages, adverse effects and anesthesia depth. Comp Med 2001; 51:443-56
13.- Elena G; Amerio N, Ferrero P, Bay ML, Valenti J, Colucci D, Puig NR. Effects of repetitive sevoflurane anaesthesia on immune response, select biochemical parameters and organ histology in mice. Lab Anim 2003;37:193-203.
14.- Committee for the Update of the Guide for the Care and Use of Laboratory Animals. Guide for the care and use of laboratory animals. Institute for Laboratory Animal Research. National Academy of Sciences. Eighth edition. The National Academies Press. Washington, DC 2011.
15.- Piersma FE, Daemen MA, Bogaard AE, Buurman WA. Interference of pain control employing opioids in in vivo immunological experiments Lab Anim 1999;33:328-333
16.- Hawkins P. Recognizing and assessing pain, suffering and distress in laboratory animals: a survey of current practice in the UK with recommendations. Lab Anim 2002; 36(4):378-395.
17.- Mogil JS, Smith SB, O'Reilly MK, Plourde G. Influence of nociception and stress induced antinociception on genetic variation in isoflurane anesthetic potency among mouse strains. Anesthesiology 2005;103:751-758.
18.- Sogawa N, Hazehara Y, Kunitomo M, Morita Y , Yoo B, Ohyama K, Sogawa C, Kitayama S. Age-dependent changes in the susceptibility to thiopental anesthesia in mice. Analysis of the relationship to the functional expression of GABA transporter. Pharmacol Biochem Behav 2012;103:267-272
19.- Fini C, Consiglio FJ, Puig N, Elena G. Administración de ketamina-midazolam- fentanilo en ratones adultos CBi. Evaluación de dos indicadores de inmovilidad. XIX Congreso Científico Argentino de Estudiantes de Medicina. COCAEM 2008, Rosario. pag 13.
SOPORTE ECONÓMICO: El presente trabajo fue subsidiado por aportes de la Facultad de Ciencias Médicas y de la Secretaría de Ciencia y Tecnología de la Universidad Nacional de Rosario, República Argentina.
CONFLICTOS DE INTERÉS: Los autores declaran no tener conflictos de interés
CORRESPONDENCIA:
Prof. Dra. Nora Raquel Puig
Instituto de Inmunología
Facultad de Ciencias Médicas, UNR
Santa Fe 3100
Rosario (CP 2000)
Correo electrónico: inmunestesia @ yahoo.com.ar
