Indice del volumen Volume index
Comité Editorial Editorial Board
Comité Científico Scientific Committee
TROMBOCITOPENIA ALOINMUNE DEL FETO Y EL NEONATO: A PROPÓSITO DE 2 CASOS
Elena Martínez-Cuevas, Covadonga García-Díaz1, Mercedes Goñi Imízcoz1, Beatriz Cuevas-Ruiz1
Servicio de Pediatría. Centro de Salud Gamonal-Antigua.
1Servicio de Hematología-Hemoterapia.
Hospital Universitario de Burgos. Burgos. España
elena_mc_frias @ hotmail.com
Rev Electron Biomed / Electron J Biomed 2014;3:33-38
RESUMEN
La trombocitopenia fetal/neonatal aloinmune se considera en la actualidad la causa más común de trombocitopenia grave en el recién nacido. Definimos trombocitopenia aloinmune del feto y el neonato (TAIFN) como aquella resultante de la formación de aloanticuerpos plaquetarios específicos maternos que reacciona con un antígeno de las plaquetas fetales/neonatales heredado del padre que conduce a la destrucción de éstas. Como consecuencia se produce una citopenia variable en su cuantía en el feto/recién nacido. En la mayoría de casos se sospecha esta entidad al observar en el neonato una diátesis hemorrágica cuyo grado de gravedad varía en función de la cifra de plaquetas, pero la hemorragia puede afectar a otros órganos como en sistema nervioso central.
Actualmente en nuestro medio no existen programas de cribado universal, sólo son diagnosticados los recién nacidos con clínica sugestiva y aquellas madres y fetos de riesgo por antecedentes de trombocitopenia aloinmune o sospecha de la misma en embarazos previos. Como consecuencia se considera que esta patología esta infradiagnosticada, ya que solo abarcamos el diagnóstico de los que presentan clínica hemorrágica moderada-severa.
En los últimos años se han llevado a cabo distintos avances en esta entidad de TAIFN. Se han descritas nuevas técnicas de diagnóstico que permiten una mejor tipificación de los antígenos implicados en nuestra población, así como medidas encaminadas al tratamiento prenatal y a la modulación de la inmunización materna.
PALABRAS CLAVE: trombocitopenia aloinmune del feto/ neonato. Hemorragia intracraneal.
SUMMARY:
The fetal / neonatal alloimmune thrombocytopenia is currently considered the most common cause of severe thrombocytopenia in the newborn. Alloimmune thrombocytopenia define the fetus and neonate (TAIFN) as that resulting from the formation of platelet-specific maternal alloantibodies that reacts with an antigen of inherited fetal / neonatal platelets father leading to their destruction. Following a variable cytopenia occurs in amount in the fetus / newborn. In most cases this condition is suspected to be observed in the newborn hemorrhagic diathesis whose severity varies platelet count, bleeding but can affect other organs and central nervous system.
Currently in our programs are not universal screening, only diagnosed infants with suggestive symptoms and those mothers and fetuses at risk for alloimmune thrombocytopenia history or suspicion of it in previous pregnancies. As a result it is considered that this disease is underdiagnosed, as only we cover the diagnosis of those with moderate to severe hemorrhagic syndrome.
In recent years they have carried out various developments in this institution TAIFN. Described new diagnostic techniques that allow a better characterization of the antigens involved in our community, as well as measures aimed at prenatal treatment and modulation of maternal immunization.
KEY WORDS: fetal/neonatal alloimmune thrombocytopenia. Intracranial hemorrhage.
INTRODUCCIÓN
La trombocitopenia aloinmune del feto y el neonato (TAIFN), es una patología infradiagnosticada, puesto que se considera la causa más frecuente de trombocitopenia grave en el recién nacido con una incidencia estimada de 1 por cada 1.000 nacidos vivos1.
Esta entidad destaca por su alta morbimortalidad ya que se asocia a hemorragia cerebral en un 10-20% de los casos2.
La destrucción de las plaquetas fetales/neonatales se produce cuando el feto porta un antígeno plaquetario (HPA) heredado del padre del cual la madre carece; esto induce en la madre, la formación de anticuerpos antiplaquetarios que cruzan la placenta y destruyen las plaquetas fetales. En el 75% de los casos el responsable de la incompatibilidad materna es el antígeno HPA-1a, siendo el HPA-5b el implicado en segundo lugar (16% de los casos) y el HPA-15 b con un 4% es el tercer afectado3.
La trombocitopenia severa se presenta en aproximadamente un tercio de las gestaciones con aloinmunización HPA-1a4
Con el objetivo de difundir esta entidad presentamos dos casos:
DESCRIPCIÓN
Caso 1:
Recién nacido a término, mujer con Apgar 9/10 y parto vaginal. Hija de madre sana, de 27 años y raza caucásica con embarazo controlado de curso normal; había tenido un primer hermano sano y un segundo hermano que falleció a las 48 horas por muerte súbita.
Ingresó en Neonatologia a las 15 horas de vida por presentar exantema petequial generalizado, con buen estado general, objetivándose trombocitopenia de 28 x 109 plaquetas; el hemograma y el estudio de coagulación de la madre fueron normales. Durante su ingreso se planteó un diagnostico diferencial con las entidades más frecuentes asociadas a trombocitopenia descartándose infección o síndrome dismórfico, y ante la sospecha de TAIFN se contactó con el Servicio de Hematología que efectuó estudio con frotis de sangre periférica observándose una morfología plaquetaria normal sin agregados plaquetarios y solicitándose estudio específico cuyos resultados se muestran en la tabla 1.
Tabla 1.
|
|
CASO 1 |
CASO 2 |
|
Ac antiplaquetares Anti-HPA-1, Anti-HPA-3, Anti-HPA-4, Anti-HPA-5, Anti-HLA clase I; fase sólida: Pack 12, Quick Screen; GTI |
POSITIVO (102% respecto al control positivo) |
POSITIVO (113% respecto al control positivo) |
|
Prueba cruzada plaquetar
(plaquetas del padre-plasma de la madre, Capture P Immucor): |
POSITIVO (+3) |
NEGATIVO. |
|
Genotipo plaquetar: |
Madre: HPA-1 1b1b Padre: HPA-1 1a1a Hijo: HPA-1 1a1b |
Madre: HPA-1 1b1b Padre: HPA-1 1a1a Hijo: HPA-1 1a 1b |
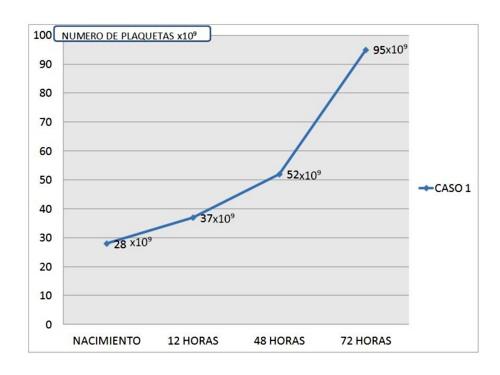
La paciente presentó aumento progresivo de la cifra de plaquetas (Figura 1) sin precisar ningún tratamiento y manteniéndose asintomática; en las primeras horas del inicio de la sintomatología descrita se realizó una ecografía cerebral descartándose hemorragia cerebral.
Caso 2:
Recién nacido a término, varón con Apgar 9/10 y parto vaginal. Hijo de madre con 29 años de raza caucásica, con hipotiroidismo tras tratamiento con Yodo radioactivo por enfermedad de Graves-Basedow, siendo el embarazo controlado de curso normal. Como antecedente había presentado un aborto previamente.
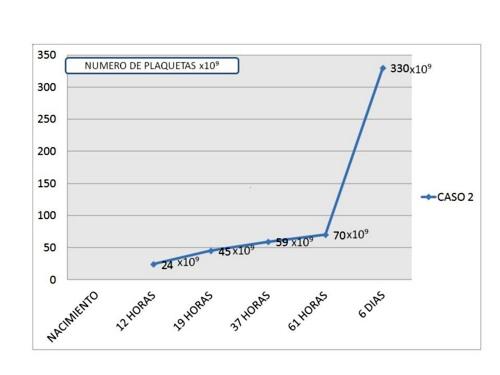
Ingresó en Neonatologia por retraso del crecimiento intrauterino con peso al nacimiento de 1.960 gr.; en el hemograma efectuado se objetivó una cifra de plaquetas de 24 x 109 sin acompañarse de sintomatología hemorrágica. El hemograma y estudio de coagulación materno fueron normales. El recién nacido no presentó datos de infección o sospecha de síndrome dismórfico. Dado que durante la evolución se mantuvo asintomático, no se consideró subsidiario de ningún tratamiento y, en los controles posteriores se objetivó un aumento progresivo de la cifra de las plaquetas (Figura 2)
Como en el caso anterior, se contactó con el Servicio de Hematología que inició estudio; no se observaron en el frotis alteraciones en la morfología plaquetaria ni agregados y, ante la sospecha diagnóstica de TAIFN se remitieron las muestras necesarias al centro de referencia (Tabla 1). Así mismo, se descartó la presencia de sangrado cerebral a través de la ecografía transfontanelar en las primeras horas.
DISCUSIÓN
La trombocitopenia aloinmune del feto y el neonato (TAIFN), es la causa más frecuente de trombocitopenia grave en el recién nacido. Aunque varias patologías fetales pueden presentar una trombocitopenia asociada, son pocos los cuadros clínicos que se acompañan de una trombocitopenia severa.
Siempre deben descartarse otras situaciones clínicas que puedan ocasionar trombocitopenia como infecciones víricas y bacterianas, coagulopatía de consumo, hemangiomas y patología autoinmune materna (Lupus, Trombocitopenia inmune), síndromes dismórficos como trisomía 13, 18 y 21 y trombocitopenias hereditarias. Hay que tener en cuenta que un tercio de los pacientes con TAIFN presentan causas concomitantes de trombocitopenia debiendo descartar éstas aunque exista una alta sospecha de TAIFN5.
La TAIFN forma parte del diagnóstico diferencial en cualquier neonato con clínica de hemorragia en las primeras horas de vida y que presente una cifra de plaquetas inferior o igual a 50 x 109 /l y, que además sea hijo de una madre sin antecedentes de coagulopatía congénita.
Destacar que esta patología puede presentarse en la primera gestación (hasta en el 50 % de los casos) ya que el pase de anticuerpos se produce en el segundo trimestre del embarazo y hay hasta un 90 % de recurrencias en las gestaciones posteriores6
La complicación más grave de esta entidad es la aparición de una hemorragia cerebral que puede presentarse en un 10-20% de los casos. En el estudio de Tiller y cols. de un total de 592 casos registrados de TAIFN, en 43 se confirmó una hemorragia intracraneal. La mayoría de las hemorragias se produjeron antes de la 28 semana de gestación y un tercio de los niños murieron en los 4 días posteriores al parto; de los que sobrevivieron, un 53 % tenían una severa afectación neurológica y solo un 12 % estaban vivos y bien al alta; en este estudio se constata que hasta en un 91 % de los casos no se realizó tratamiento antenatal7.
La TAIFN es un proceso autolimitado y transitorio pues los anticuerpos pasivos, de origen materno, tienden a desaparecer espontáneamente en el transcurso de los días.
El diagnóstico serológico comprende la demostración de la presencia de un aloanticuerpo plaquetario específico en el suero materno, la evidencia de la incompatibilidad HPA materno-fetal junto con la genotipificación plaquetaria de los padres y del recién nacido.
En primer lugar debe establecerse la incompatibilidad materno-paterna para HPA-1, HPA- 3, HPA- 4, HPA-5, HPA-15; una vez identificada la incompatibilidad frente a HPA de los progenitores, para confirmar la TAIFN deben aislarse los anticuerpos frente a HPA paterno/fetal desarrollados por la madre; en nuestro caso el centro de referencia (Centro Regional de Transfusión Sanguínea de Castilla y León) utiliza una técnica de ELISA (Capture-P®)
En algunas gestantes HPA-1a negativas, los anticuerpos pueden no ser detectados en el periparto, por lo que se recomienda repetir el estudio de aloanticuerpos cada 10 semanas en el siguiente embarazo para identificarlos y confirmarlos.8.
Hasta la actualidad, se han identificado, 33 antígenos plaquetarios humanos (HPA) que se agrupan en seis complejos funcionales de glicoproteínas plaquetarias (GP) y han sido implicados en trastornos plaquetarios aloinmunes, como la trombocitopenia aloinmune fetal y neonatal (TAIFN), la púrpura postransfusional y la refractariedad plaquetaria tras multitransfusión.
20 de los 33 HPA residen en el complejo GPIIb / IIIa, que sirve de receptor a ligandos de mediadores de la hemostasia como el fibrinógeno y el Factor von Willebrand; así mismo, participa en la activación plaquetaria y la inflamación. Otros complejos de glicoproteínas plaquetarias ( GPIb / V / IX, GPIa / IIa y CD109), expresan los 13 antígenos plaquetarios humanos restantes. El HPA-1a, el más frecuentemente implicado en TAIFN en la población caucásica.9
Muñiz-Díaz y cols demostraron que la incidencia de los diferentes antígenos plaquetarios en la población española es la misma que la detectada en otros países europeos y la población blanca de EEUU.10
En ambos casos presentados, el antígeno implicado fue el HPA-1a, que comporta una madre que es HPA 1b / 1b con anticuerpos anti-HPA-1a y un padre que es HPA 1a / 1a. Hay que tener en cuenta que la presencia de antígenos plaquetarios poco frecuentes pueden ser difíciles de identificar y la prueba de suero materno contra las plaquetas paternas ayuda a detectar estos casos.
En nuestros casos observamos dos formas de presentación diferentes: en el primer caso como una purpura cutánea clara y el segundo como hallazgo casual en un hemograma, siendo éstas las formas más frecuentes de presentación de la TAIFN.3
Respecto al tratamiento, se aconseja la transfusión de plaquetas, si el recuento es inferior a 30 x 109o si hay signos de sangrado, recomendándose que sean obtenidas de donantes con fenotipo HPA, ABO y Rh compatibles y sometidas a leucorreducción11.
La segunda opción terapéutica sería la administración de inmunoglobulina a altas dosis (1g/kg/día durante 2 días) para bloquear los receptores Fc de los macrófagos neonatales. Sin embargo, este mecanismo tarda por lo menos 24 horas en comenzar a elevar los recuentos plaquetarios hasta alcanzar niveles de seguridad (superiores a 50 x 109 plaquetas). Se utiliza como tratamiento de elección para aquellos neonatos sin síndrome hemorragíparo o con recuentos plaquetarios superiores a 30 x 109
La última opción terapéutica pero la más rápida es la transfusión de plaquetas no compatibles de donantes al azar a razón de 10-20 ml /Kg peso. En un trabajo reciente se demuestra su efectividad elevando en más de 20 x 109 el recuento plaquetario postransfusional en el 88 % de los casos. Deben ser ABO y Rh compatibles y dado que tienen efecto transitorio algunos autores recomiendan asociar inmunoglobulina intravenosa12.
Sin embargo, Bakchoul et al, demostraron que la transfusión de un pool de plaquetas de varios donantes sola, sin inmunoglobulinas, fue efectiva para corregir la baja cifra de plaquetas y postulan que esta estrategia debería ser considerada como primera línea de tratamiento en recién nacidos con trombocitopenia neonatal aloinmune. 13
Los casos expuestos presentaron una cifra de plaquetas inferior a 30 x 109 pero al no presentar síntomas de sangrado y en el seguimiento aparecer una recuperación progresiva, se optó por no transfundir.
No existen programas de cribado prenatal universal en primíparas por lo que un punto clave en esta entidad es la profilaxis o estrategia antenatal en futuras gestaciones, ya que la trombocitopenia en el segundo hijo afectado es siempre tan grave o más que en el primer niño14.
Durante la etapa intrauterina existen dos modalidades de diagnóstico, tratamiento y prevención de la hemorragia cerebral. Uno, menos invasivo, consiste en el diagnóstico serológico de la presencia de aloanticuerpos plaquetarios y la administración a la madre de inmunoglobulina intravenosa (1g/kg por semana) asociado a 0,5 mg/kg/día de prednisona; dado que estos tratamientos son caros, puede estar limitado el acceso al tratamiento con Ig IV y además, no carecen de efectos secundarios, algunos autores recomiendan estratificar el tratamiento en base a la severidad presentada en anteriores gestaciones, que se ha revelado como el único factor predictivo claro de la severidad de la enfermedad. Con esta estrategia de prevención se han descrito buenos resultados si el tratamiento se ha iniciado a las 12 semanas de gestación en los embarazos posteriores a la presentación de TAIFN y hemorragia intracraneal anterior15
Otra opción consiste en la realización de cordocentesis para realizar el diagnóstico de trombocitopenia fetal y de su intensidad y posteriormente administrar plaquetas compatibles maternas leucorreducidas e irradiadas y/o inmunoglobulina intravenosa por los vasos umbilicales; no obstante, este procedimiento está limitado por el riesgo de pérdida fetal asociada al mismo.16
Ghevaert y cols, han desarrollado un anticuerpo monoclonal recombinante con alta afinidad por el antígeno plaquetario humano 1a (HPA-1a); tanto en los estudios in vitro como en voluntarios sanos se ha demostrado su potencial terapéutico al inducir una mayor supervivencia de las plaquetas sensibilizadas; estos resultados son esperanzadores y podrían constituir en el futuro, el tratamiento de esta patología.17
REFERENCIAS
-
1.- Kjeldsen-Kragh J , Killie MK, Tomter G, Golebiowska E, Randen I, Hauge R, Aune B, Øian P, Dahl LB, Pirhonen J, Lindeman R, Husby H, Haugen G, Grønn M, Skogen B, Husebekk A.A screening and intervention program aimed to reduce mortality and serious morbidity associated with severe neonatal alloimmune thrombocytopenia. Blood. 2007 ; 110: 833-39.
2.- Bussel JB, Primiani A. Fetal and neonatal alloimmune thrombocytopenia: progress and ongoing debates. Blood Rev 2008; 22: 33-52.
3.- Ghevaert C, Campbell K, Walton J, et al. Management and outcome of 200 cases of fetomaternal alloimmune thrombocytopenia. Transfusion 2007; 47:901.
4.- Kamphuis MM , Paridaans N, Porcelijn L, De Haas M, Van Der Schoot CE, Brand A, Bonsel GJ, Oepkes D.Screening in pregnancy for fetal or neonatal alloimmune thrombocytopenia: systematic review. BJOG. 2010 ;117: 1335-43
5.- Bussel JB , Zacharoulis S, Kramer K, McFarland JG, Pauliny J, Kaplan C.Clinical and diagnostic comparison of neonatal alloimmune thrombocytopenia to non-immune cases of thrombocytopenia. Pediatr Blood Cancer. 2005 ; 45: 176-83.
6.- Durand-Zaleski I, Schleger N, Blum-Boisgard C y col. Screening primiparous women and newborns for fetal/neonatal alloimmune thombocytopenia: a prospective comparison of effectiveness and costs. Am. J. Perinatol. 1996;13: 423-431.
7.- Tiller H1, Kamphuis MM, Flodmark O, Papadogiannakis N, David AL, Sainio S, Koskinen S, Javela K, Wikman AT, Kekomaki R, Kanhai HH, Oepkes D, Husebekk A, Westgren M. Fetal intracranial haemorrhages caused by fetal and neonatal alloimmune thrombocytopenia: an observational cohort study of 43 cases from an international multicentre registry. BMJ Open. 2013 ; 22;3(3).
8.- Bussel JB. Diagnosis and management of the fetus and neonate with alloimmune thrombocytopenia. J Thromb Haemost 2009; 7 (suppl 1): 253-57.
9.- Curtis BR1, McFarland JG. Human platelet antigens - 2013. Vox Sang. 2014 Feb;106 (2):93-102.
10.- Muñiz-Díaz E1, Arilla M, Ibáñez M, Bosch MA, Pastoret C, Madoz P. Frequency of platelet alloantigens in the Spanish population .Sangre (Barc).1993; 38(4): 289-93
11.- Bassler D, Greinacher A, Okascharoen C y col. A systematic review and survey of the management of unexpected neonatal alloimmune thrombocytopenia. Transfusion 2008; 48: 92-98.
12.- Kiefel V, Bassler D, Kroll H y col. Antigen-positive platelet transfusion in neonatal alloimmune thrombocytopenia (NAIT). Blood 2006; 107: 3761-3763
13.- Bakchoul T1, Bassler D, Heckmann M, Thiele T, Kiefel V, Gross I, Arnold DM, Ditomasso J, Smith JW, Paes B, Greinacher A. Management of infants born with severe neonatal alloimmune thrombocytopenia: the role of platelet transfusions and intravenous immunoglobulin. Transfusion. 2014 ; 54(3): 640-45.
14.- Birchall JE, Murphy MF, Kaplan C, et al. European collaborative study of the antenatal management of feto-maternal alloimmune thrombocytopenia. Br J Haematol 2003; 122:275.
15.- Bussel JB, Berkowitz RL, Hung C et al. Intracranial hemorrhage in alloimmune thrombocytopenia: stratified mangement to prevent recurrence in the subsequent affected fetus. Am J Obstet Gynecol 2010; 203 (2): 135.e1-14.
16.- Overton TG, Duncan KR, Jolly M, Letsky E, Fisk NM.Serial aggressive platelet transfusion for fetal alloimmune thrombocytopenia: platelet dynamics and perinatal outcome. Am J Obstet Gynecol. 2002 ; 186(4): 826-31.
17.- Ghevaert C, Herbert N, Hawkins L, Grehan N, Cookson P, Garner SF, Crisp-Hihn A, Lloyd-Evans P, Evans A, Balan K, Ouwehand WH, Armour KL, Clark MR, Williamson LM. Recombinant HPA-1a antibody therapy for treatment of fetomaternal alloimmune thrombocytopenia: proof of principle in human volunteers. Blood. 2013 8;122(3):313-20.
CORRESPONDENCIA:
Dra. Elena Martínez-Cuevas
Servicio de Pediatría.
Centro de Salud Gamonal-Antigua.
09006 Burgos. España
Recibido, 20 de diciembre de 2014.
Publicado, 29 de diciembre de 2014