Indice del volumen Volume index
Comité Editorial Editorial Board
Comité Científico Scientific Committee
- La indemnidad del número de unidades glomerulares y de sus respectivas barreras de filtración. Estas variables se ven afectadas en la insuficiencia renal tanto aguda como crónica al punto de verse alterada la filtración de diversos fármacos, los cuales comienzan a requerir ajuste en su dosis o a verse contraindicada su prescripción.
- Las características del fármaco: tamaño (pequeño), carga (no negativa), porcentaje de unión a proteínas plasmáticas (bajo), permiten su adecuada filtración. Por esta razón, durante el síndrome nefrótico puede verse propiciada la excreción de fármacos debido a la suma de los siguientes factores:
-
- la hipoalbuminemia: la cual aumenta la excreción de drogas por filtración al incrementar su fracción filtrable,
- la elevada filtración glomerular de proteínas: la cual aumenta la excreción urinaria de fármacos ligados a las mismas. - El metabolismo hepático es mucho más importante que su excreción renal.
- El pKa de la sustancia ácida es similar al límite superior del pH urinario (como sucede con el barbital, cuyo pKa es 7.8) o se encuentra por encima de él (como sucede con el 2-nitroprobenecid, cuyo pKa es 13). En este caso el ácido permanece en orina fundamentalmente en su forma no ionizada, y su excreción entonces no depende del pH urinario.
- La de los transportadores de aniones orgánicos (OAT), cuyo sustrato clásico es el para-aminohipurato. En este mecanismo el para-aminohipurato se intercambia a nivel basolateral por alfa-ketoglutarato, el cual se encuentra en el citoplasma tras haber ingresado en un sin-porte con sodio. El gradiente para el ingreso de sodio es generado por la bomba sodio-potasio ATPasa basolateral. Finalmente, la secreción del para-aminohipurato hacia el lumen tubular se realiza en intercambio con alfa-ketoglutarato.
La familia de los transportadores OAT interviene, a través de sus distintos subtipos, en la secreción de diversos fármacos y hormonas, tal como por ejemplo: para-aminohipurato, anti-retrovirales y metotrexato (OAT1, OAT2, OAT3 y OAT4), salicilatos (OAT3), cimetidina (OAT3 y OAT4), hormonas tiroideas (OATP-A y OATP-E), clorambucilo (OATP-A) y benzylpenicilina (OATP-B, OATPE).
La secreción de aniones orgánicos se ve inhibida por el probenecid, por lo cual se ha utilizado este fármaco para inhibir la acumulación celular (toxicidad) de drogas transporables por dicho mecanismo, tales como es el caso de las cefalosporinas. Otro tanto ocurre con el cisplatino, cuya toxicidad es reducida al suministrarse junto con probenecid, aunque este fármaco puede también excretarse por el sistema de trasportadores de cationes orgánicos.
- La de los transportadores de cationes orgánicos (OCT), cuyo sustrato clásico es el tetra-etilamonio. El ingreso a la célula tubular del tetra-etilamonio se realiza desde la membrana basolateral siguiendo un gradiente electroquímico favorable y sin requerimiento de gasto energético directo. Luego, la secreción del tetra-etilamonio a la luz tubular se realiza en intercambio por protón, que ingresa siguiendo un gradiente de concentración generado por un contraporte Na+-H+ localizado en la misma membrana. Finalmente, el gradiente para el ingreso de sodio desde el lumen lo genera la bomba sodio-potasio ATPasa basolateral.
La familia OCT interviene, a través de sus distintos subtipos, en la secreción de diversos fármacos y aminoácidos, tal como el tetra-etilamonio (OCT1, OCT2, OCTN1, OCTN2), aciclovir y ganciclovir (OCT1), amantadina y memantine (OCT2), cimetidina (OCT3), quinidina y verapamilo (OCTN1 y OCTN2), colina, lisina, y metionina (OCTN2).
Este tipo de transportadores también se han descripto en los túbulos distales.
Existen sustancias que son susceptibles de ser transportadas tanto por el sistema de los aniones orgánicos como por el de los cationes orgánicos (bisustratos), como por ejemplo la creatinina, la cimetidina, zidovudina y cisplatino.
- Familia de los transportadores ABC1-3,12:
Las células de los túbulos proximales (y en parte también de los distales), en su sector apical, son ricas en glicoproteínas transportadores de múltiples fármacos, sistema de transportadores denominado MDR. Estos transportadores pueden excretar en orina diversos compuestos orgánicos, como por ejemplo: vinblastina, vincristina, colchicina y ciclosporina. Por otra parte, algunas drogas pueden ser excretadas en forma compartida no sólo por el MDR, sino además por el sistema de transporte de cationes orgánicos, antes descripto, tal como sucede con: daunomicina, quinidina, verapamilo y vinblastina. Este sistema de la p-glicoproteína-MDR participa en el transporte de la ciclosporina, y algunas variantes de su expresión pueden conducir a su acumulación intra-tubular y por ende contribuir a su toxicidad. Dicha toxicidad pude empeorar si se utiliza concomitantemente sirolimus, el cual por ser también sustrato de la p-glicoproteína MDR, puede inhibir el eflujo de la ciclosporina de las células tubulares, propiciando así su nefrotoxicidad. Algo similar ocurre con la digoxina, a cual al ser excretada por el sistema transportador de la p-glicoproteína MDR, puede alcanzar niveles de toxicidad si se administra conjuntamente con fármacos que compiten con su secreción, tales como la quinidina, verapamilo, nifedipina, espironolactona y amiodarona.
FARMACOFISIOLOGÍA RENAL
Carlos G. Musso MD. PhD., Mario Acuña MD., Daniel Godoy MD.,
Ricardo Jauregui MD. PhD.
Unidad de Biología del Envejecimiento
Hospital Italiano de Buenos Aires.
Buenos Aires. Argentina
Rev Electron Biomed / Electron J Biomed 2014;3:44-51.
Comentario de la revisora Dra. Maria Noemi Pissano.
Coordinadora del grupo de Trabajo de Nefrologia. Hospital Jose Maria Penna. Ciudad Autonoma de Buenos Aires. Argentina.
Comentario de la revisora Dra. Maria Noemi Pissano. Coordinadora del grupo de Trabajo de Nefrologia. Hospital Jose Maria Penna. Ciudad Autonoma de Buenos Aires. Argentina.
Comentario de la revisora Dra. Sonia Butto. Servicio de Nefrología del Hospital Jose Maria Penna. Ciudad Autónoma de Buenos Aires. Argentina.
RESUMEN:
La fisiología renal juega un papel clave en la farmacocinética de muchos medicamentos.
El conocimiento de las particularidades de cada función nefronal (filtración, secreción, reabsorción y excreción), así como de cada uno de los mecanismos de transporte tubular (difusión simple, difusión facilitada, transporte facilitado, transporte activo, endocitosis y pinocitosis) es fundamental a fin de lograr un mejor manejo de la prescripción farmacológica.
PALABRAS CLAVE: Farmacología. Fisiología renal. Prescripción medicamentosa
SUMMARY:
Renal physiology plays a key role in the pharmacokinetics of many drugs.
Knowledge of the particularities of each nephron function (filtration, secretion, reabsorption and excretion) and each of renal tubular transport mechanisms (simple diffusion, facilitated diffusion, facilitated transport, active transport, endocytosis and pinocytosis) is fundamental to achieve better management of drug prescriptions.
KEYWORDS: Pharmacology. Renal physiology. Drug prescription.
INTRODUCCIÓN
El riñón cumple, junto con el hígado, un rol fundamental en la eliminación de fármacos del organismo. Aquellos medicamentos que se caracterizan por ser lipofílicos, poseer un alto peso molecular (> 500 daltons) y presentar una elevada unión a proteínas plasmáticas son fundamentalmente eliminados por vía hepática, mientras que aquellos caracterizados por ser hidrofílicos, de bajo peso molecular (< 500) y ligadura a proteínas, son eliminados por vía renal1. El rol principal del hígado es el de metabolizar drogas a sustancias derivadas más polares e hidrofílicas propiciando así su excreción renal. Sin embargo, los mismos sistemas enzimáticos (citocromo P-450) que se encuentran en el hígado, se hallan en el riñón, aunque su actividad es menos específica y está circunscripta a determinados segmentos nefronales, tal como es el caso del túbulo proximal. Son ejemplo de fármacos que presentan metabolización renal: ácido salicílico, acetaminofeno, morfina (conjugación), sulfisoxazol (acetilación), bumetanida, acetaminofeno (oxidación) y la conversión de enalapril a enalaprilato (esterólisis)2.
En parte por este rol de órgano metabolizador de fármacos, y en parte por características de su fisiología, el riñón es un órgano muy expuesto al daño farmacológico. A continuación detallaremos cada una de estas razones1,2:
1) El riñón es el órgano que posee la mayor superficie endotelial por gramo de tejido e hipertensión hidrostática capilar, representando su flujo un 25% del volumen minuto cardíaco. Esto favorece que en él se atrapen antígenos circulantes y se formen complejos inmunes, que representa el inicio de procesos que le resultan deletéreos.
2) La alta actividad metabólica renal producto de su gran actividad de transporte tubular, lo predispone al daño isquémico (noxa isquémica).
3) Los sistemas de transporte tubular de ácidos y bases pueden provocar la acumulación de fármacos en el interior de las células tubulares, y lesionarlas (noxa tóxica).
4) El mecanismo de concentración urinaria produce la acumulación de fármacos en la luz tubular, y esto en algunos casos puede propiciar daño renal (noxa tóxica).
Debido a la estrecha relación existente entre la fisiología renal y el rol del riñón en la farmacocinética de numerosos sustancias, describiremos a continuación el funcionamiento normal de cada sector del nefrón, así como su participación particular en el manejo farmacológico renal.
1.- Filtración Glomerular
El filtrado renal es el resultado de la suma del filtrado individual de cada una de los 800.000 nefrones con los que cuenta cada riñón, y que constituyen la masa renal funcionante3,4. Como sucede en otros territorios capilares, el movimiento de fluidos a través del glomérulo está regido por las leyes de Starling, siendo éste determinado por una combinación de factores: la permeabilidad neta de la pared del capilar glomerular, el gradiente de presión hidrostática y el gradiente de presión oncótica entre el capilar y la cápsula de Bowman. La siguiente fórmula resume lo antes expresado3-5:
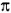 p -
p - 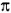 b ) ]
b ) ]Donde,
-
FG: filtrado glomerular
Lp: es la porosidad de la pared capilar
S: es la superficie disponible para la filtración
s: coeficiente de reflexión de proteínas través de la pared
capilar ( permeabilidad total = 0, e impermeabilidad total: 1)
Pcg: presión hidrostática del capilar glomerular
Pb: presión hidrostática del espacio de Bowman
Pcg - Pb: diferencia de presión hidrostática
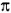 p: presión oncótica plasmática
p: presión oncótica plasmática
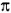 b: presión oncótica de la cápsula de Bowman
b: presión oncótica de la cápsula de Bowman
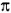 p -
p - 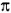 b: diferencia de presión oncótica
b: diferencia de presión oncótica
Dado que:
El filtrado es prácticamente libre de proteínas (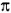 b = 0), y que
s = 1,
b = 0), y que
s = 1,
Resulta entonces que la forma simplificada de la formula de filtración glomerular es:
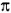 p ) ]
p ) ]Los capilares glomerulares están interpuestos entre la arteriola aferente y la arteriola eferente. En consecuencia la presión hidrostática del capilar glomerular está determinada por tres factores principales: la presión aórtica de perfusión renal, la resistencia arteriolar aferente (la cual determina el grado de presión aórtica que se transmite al glomérulo) y la resistencia arteriolar eferente5,6. Diversos factores pueden modular el diámetro de estas arteriolas: la autoregulación de flujo, la retroalimentación túbulo-glomerular, la angiotensina II, la noradrenalina, y las prostagladinas intra-renales. La angiotensina II estimula la contracción de ambas arteriolas a predominio de la eferente, la noradrenalina estimula la contracción de ambas arteriolas por igual, y ambas sustancias estimulan la liberación de las prostaglandinas intra-renales (prostaglandinas E2 e I2), que con su efecto vasodilatador sobre ambas arteriolas, funcionan como un mecanismo de contrabalanceo de los mediadores vaso-activos, y viceversa6
Los determinantes de que los fármacos sean sometidos a filtración glomerular son1,2,4,7:
Son ejemplos de sustancias que son excretadas en orina sólo por filtración glomerular, la inulina y el manitol.
2.- Función Tubular Proximal:
Este sector consta de una porción contorneada y otra lisa. En la primera se realiza la reabsorción de sodio (60%), merced a un gradiente de concentración a favor de la misma generado por una bomba (NaKATPasa) basolateral, y junto con él (cotransporte) también se reabsorbe potasio, bicarbonato, cloro (difusión simple), glucosa, aminoácidos (difusión facilitada), pequeñas proteínas (endocitosis)8,9.
El sodio pasa inicialmente al interior de la célula tubular (el cual posee una baja concentración de sodio gracias a su constante extrusión hacia el intersticio por parte de la ya mencionada bomba NaKATPasa). Luego parte del sodio reabsorbido pasa al espacio basal y paracelular donde contribuye a la reabsorción de agua como ya se explicará a continuación. El agua se reabsorbe (60-80% de la filtrada) al seguir ésta al sodio reabsorbido hasta el espacio basal-paracelular, desde donde al aumentar la presión hidrostática, terminan pasando (agua y sodio) al intersticio peritubulares donde se encuentran los capilares que concretarán su reabsorción. Agua y solutos son atraídos hacia estos vasos merced a su presión oncótica, la cual se encuentra incrementada luego de haberse concentrado las proteínas capilares merced al agua filtrada hacia la cápsula de Bowman a nivel glomerular. De lo antes mencionado se desprende que el transporte a nivel tubular proximal es iso-osmótico respecto del plasma, pues se recuperan sincrónicamente 300 mOsm de solutos por cada litro de agua reabsorbido8,9,10.
En este sector tubular también se reabsorbe urea y se secreta potasio (pars recta) desde el intersticio peritubular, lo cual da lugar al fenómeno de recirculación, el cual contribuye a la generación de una parte de la tonicidad medular11
A continuación describiremos la influencia que los distintos mecanismos de transporte de este segmento tubular poseen sobre el manejo renal de fármacos.
Reabsorción por difusión simple1-3,12:
Por este mecanismo son reabsorbidas sustancias lipofílicas, es decir que atraviesan con facilidad la membrana celular (bicapa lipídica) de las células tubulares, y las moléculas no disociadas de ácidos y bases débiles, en lo cual influyen el pKa de estas sustancias y el pH urinario. El tiempo de contacto de la molécula con la superficie tubular también influye, siendo este mayor en anti-diuresis y menor en estado de alta diuresis, situaciones que favorecen y desfavorecen respectivamente su reabsorción. La alcalinización de la orina (pH: urinario 8.5) propicia la excreción de ácidos débiles (como sucede con la acetazolamida, clorotiazida, metotrexate, derivados de la sulfonamida, penicilina G, salicilato, fenilbutazona, y fenobarbital) al ionizar a la droga, inducir su "atrapamiento" en la luz tubular y favorecer así su excreción. Este recurso puede ser utilidad en el tratamiento de intoxicaciones. Por el contrario, la acidificación urinaria (pH urinario 4.5) facilita la reabsorción de las sustancias básicas débiles (como sucede con la metadona, amitriptilina, imipramina, anfetamina, efedrina, cloroquina y quinina). La magnitud de excreción de álcalis débiles lograda por una acidificación urinaria es siempre mayor que la excreción de ácidos débiles obtenida mediante una alcalinización urinaria. Esto se debe a que existe una mucho más marcada diferencia de concentración de protones en la orina ácida, que en la orina alcalina, con respecto pH sanguíneo (pH: 7.4). Desde ya este tipo de excreción de sustancias acidas/básica débiles moduladas mediante el pH urinario carece de valor si:
Reabsorción por difusión facilitada1-3,12:
Existen algunos aniones orgánicos que son reabsorbidas a nivel del túbulo proximal a través de mecanismos de cotransporte con sodio. Tal es el caso del ácido ascórbico, biotina, piridoxina, pantotenato, nicotinato, pirazinamida, glucurónidos de morfina y oxipurinol (metabolito del alopurinol). Otro tanto sucede con la reabsorción de cationes orgánicos, como por ejemplo la colina.
En cuanto al transporte de péptidos o simil-péptidos (beta-lactámicos), éstos son reabsorbidos por transportadores de sustancias peptídicas, tales como: PEPT1 y PEPT2 localizados en el segmento S1 y S3 del túbulo proximal, respectivamente. Por este sistema también son reabsorbidos algunos antineoplásicos (bestatin) y antivirales (valaciclovir).
Reabsorción por endocitosis/pinocitosis1-3,12,13:
Este mecanismo pertenece al grupo de los transportes activos (con gasto directo de energía), y consiste en la incorporación de solutos (endocitosis) y fluido (pinocitosis) en una vesícula formada a partir de la base del ribete en cepillo de las células tubulares proximales, seguida luego de su incorporación al citoplasma y su fusión con los lisosomas. Estos solutos pueden ser de diversa naturaleza: minerales (cadmio), hormonas (insulina) o fármacos (aminoglucósidos).
Secreción de iones orgánicos1-3,12:
Este mecanismo consiste en transportadores que conducen las sustancias orgánicas desde el polo basolateral hasta el apical, y cuya ubicación es fundamentalmente en los segmentos proximales. Se trata de sistemas saturables y susceptibles de importante interacción farmacológica. Se han descrito dos grandes familias de transportadores de iones orgánicos:
3.- Asa de Henle:
Este segmento se divide en tres sectores: asa descendente, asa ascendente delgada y asa ascendente gruesa14-16
1. El asa descendente: es muy permeable al agua (posee canales estructurales de acuaporina 1) e impermeable a ciertos solutos (sodio, potasio y cloro), sin embargo es muy permeable a la urea (proveniente del intersticio peritubular) gracias a sus canales estructurales UT2. Además, debido a que está rodeada por un medio hipertónico, el agua sale de su luz hacia en intersticio, resultando de ello que su contenido se torna hipertónico llegando a presentar en su extremo inferior una osmolalidad de 1400 mOsm/l.
2. El asa ascendente delgada: este sector es impermeable al agua y muy permeable al sodio y la urea (por sus canales UT2). En su paso por este segmento ascendente el sodio pasa de la luz tubular al intersticio (por simple gradiente de concentración) contribuyendo así a su reabsorción.
3. El asa gruesa ascendente: este segmento es impermeable al agua y la urea, pero permeable al sodio por poseer un transportador apical NaK2Cl (que como lo indica su nombre cotransporta junto con el sodio, al potasio y al cloro), y cuyo gradiente está dado por la existencia de una bomba NaKATPasa baso-lateral. Este transportador es el que bloquean desde la luz tubular los diuréticos de alto techo (ejemplo: furosemida) (Figura 1).
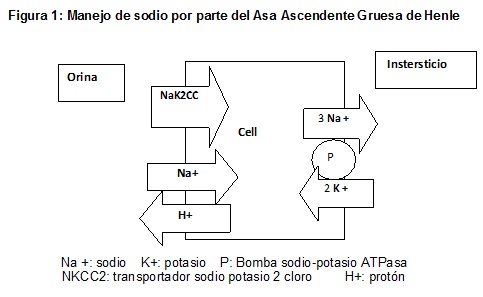
Esto determina que en este sector se reabsorba un 40% del sodio filtrado a nivel glomerular, y que se produzca una orina hipotónica, por lo cual se considera que es el sector del nefrón donde se genera el aclaramiento de agua libre. Es así que la osmolalidad de la orina al final de este segmento es de alrededor de 100 mOsm/l. Por otra parte, es el mismo mecanismo que contribuye a generar la concentración de sodio a nivel medular, y por ende es el motor impulsor del llamado mecanismo de contracorriente generador de la hipertonicidad medular.
A nivel de este segmento nefronal (Henle), y también del túbulo proximal y colector, se encuentra la familia de transportadores proteicos denominados transportadores asociados a resistencia a múltiples drogas (MRPs). De ellos, el subtipo MRP2 está localizado en el borde apical de los segmentos S1, S2 y S3, y contribuye a la detoxificación de diversas drogas principalmente de tipo conjugadas. El subtipo MRP3, se encuentra en el borde basolateral de la membrana de las células tubulares distales, y confiere resistencia al etopósido, tenoposide, y la vincristina. El subtipo MRP4 ha sido documentado en la membrana apical de las células tubulares proximales, y aumenta la resistencia a antivirales (adenovir y zidovudine) y propicia su excreción renal2.
4.- Túbulo Conector
Este sector se encuentra en la transición del asa ascendente gruesa de Henle con el túlbulo colector, de lo cual deriva su nombre. En este segmento continúa la reabsorción de sodio, mediante un transportador apical llamado NaCl, cuyo gradiente favorable a la reabsorción de sodio le es otorgado por una bomba NaKATPasa baso-lateral. Este transportador es el que bloquean desde la luz tubular los diuréticos tiazidas (ejemplo: hidroclorotiazida) o simil-tiazidas (ejemplo: metolazona). Este segmento, igual que el anterior, es impermeable a la urea, y lo mismo que el siguiente (colector), posee la capacidad de reabsorber agua libre en forma regulable por estímulo de la vasopresina1,3,4.
5.- Túbulo Colector
En las células principales del túbulo colector se reabsorbe aproximadamente un 3-5% del sodio filtrado, lo cual se realiza por medio de los canales de sodio ubicados en el polo apical de las células tubulares, gracias a un gradiente de concentración generado por una bomba NaKATPasa baso-lateral (esta bomba ingresa además potasio a la célula). El ingreso de sodio (catión) a la célula torna a la superficie luminal relativamente negativa respecto de la superficie intracelular. Simultáneamente, el potasio intracelular es secretado hacia la luz, a través de un canal de potasio, siguiendo un gradiente eléctrico y químico: el primero producto de la electronegatividad luminal y el segundo producto de la elevada concentración de potasio intracelular por el accionar de la bomba basolateral. El canal de sodio antes mencionado es el que bloquean desde la luz tubular los diuréticos ahorradores de potasio: amiloride y triamtireno, que es por lo cual logran sus efectos de incremento en la soduria y reducción en la potasiuria. Toda la actividad tubular distal antes mencionada de reabsorción de sodio y secreción de potasio, se intensifica en presencia de aldosterona sérica, la cual estimula el aumento del número y la función de los canales de sodio, potasio y bomba NaKATPasa de las células principales de este segmento. Por esta razón es que los antagosnistas de los receptores (intracelulares) de aldosterona (por ejemplo: espironolactona) incrementan también la soduria y reducen la potasiuria, teniendo así un efecto diurético y a la vez ahorrador de potasio (Figura 2)4,17,18.
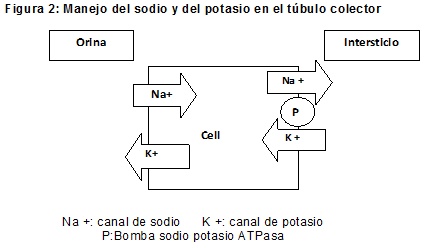
Con respecto al agua, este sector es en principio impermeable a ella. Sin embargo, en presencia de vasopresina sérica, se estimula el agregado de canales de agua regulables (acuaporina 2) desde el citoplasma a la superficie apical de las células tubulares (por medio de sus receptores V2). Este fenómeno, sumado a la presencia de un canal de agua estructural (acuaporina 1) en el polo capilar de estas células, más la hipertonicidad medular, estimulan la reabsorción de agua en los colectores (TC de agua). Dichos receptores V2 son antagonizados por drogas como el tolvaptan, que interfiere entonces en el accionar de la hormona antidiurética, promoviendo de esta forma diuresis acuosa.
El trayecto inicial del colector es impermeable a la urea, de modo que a nivel del colector medular, y como consecuencia de lo antes mencionado, la concentración luminar de urea es elevada. Sin embargo, el segmento más profundo del colector es permeable a la urea (por la presencia de canales de urea UT1 y UT2, siendo sólo el primero de ellos regulable por vasopresina), de modo que a este nivel comienza a difundir la urea pasivamente hacia el intersticio. La hipertonicidad medular antes mencionada es generada principalmente por el sodio reabsorbido a nivel del asa ascendente gruesa de Henle, más la urea recirculada desde el colector medular hacia el asa descendente de Henle, y el potasio recirculado desde el nefron distal a la pars recta del túbulo proximal. Por otra parte, mientras que la hipertonicidad es generada por los mecanismos antes mencionados, su mantenimiento está propiciado por las características particulares de la circulación medular: lentitud de flujo y similitud de osmolalidad de los vasos medulares con el intersticio circundante4,6,11,19.
A nivel de las células intercalares A del túbulo colector, más específicamente en su superficie apical, se encuentra una bomba protón ATPasa que secreta protones a la orina, con gasto energético directo y a favor de un gradiente eléctrico (generado por las células principales). Este mecanismo de acidificación distal es estimulado por la aldosterona, la cual estimula simultáneamente la secreción de protones y la amoniogénesis. Es por esta razón que cualquiera de los fármacos ahorradores de potasio, ya sean bloqueantes de canal apical de sodio como antagonistas de la aldosterona, pueden inducir retención no sólo de potasio, sino también de hidrogeniones1,7.
Existen una serie de sustancias, algunas de origen intra-renal (ejemplo: prostagalndina E2, kinina-kalicreínas, etc.), y otras de procedencias extra-renal (ejemplo: péptido atrial natriurético, etc.), que debido a su efecto vasodilatador (prostaglandinas), e inhibidor de la reabsorción de sodio y agua a lo largo de todo el nefrón, las transforma en un sistema contra-regulador al de la renina-angiotensina-aldosterona y vasopresina. Por esta razón, drogas que inhiben la síntesis de prostaglandinas, como es el caso de los anti-inflamatorios no esteroideos, pueden inducir retención hidrosalina e hipertensión arterial1,2,7.
CONCLUSIÓN:
El conocimiento de las relaciones existentes entre la farmacocinética y la fisiología renal es fundamental a fin de lograr un mejor manejo de la prescripción farmacológica.
REFERENCIAS
1.- Neal MJ. Farmacología médica en esquemas. Buenos Aires. CTM. 2003
2.- De Broe M, Roch-Ramel F. Renal handling of drugs and xenobiotics. In De Broe M, Porter G. (Eds.) Clinical nephrotoxins. New York. Springer. 2008: 43-83
3.- Vander A. Fisiología renal. Mexico. Interamericana-McGraw-Hill. 1993
4.- Rennke H, Denker B. Renal Pathophysiology. Philadelphia. Lippincott Williams & Wilkins. 1994
5.- Musso CG, Vilas M, Jauregui J. Presion de perfusión y flujo sanguíneo renal: sus relaciones y diferencias. Electron J Biomed. 2014 (en prensa).
6.- Dworkin LD, Brenner BM. The renal circulations. In Brenner BM, Levine S (Eds). Philadelphia. Saunders. 2004: 309-352
7.- Lacy C, Armstrong, Goldman M, Lance L. Dapsone. In Drug information handbook International. Hudson. Lexi-comp. 2000
8.- Musso CG, Fainstein I, Kaplan R, Macías Núñez J. Función tubular renal en el muy anciano. Revista Española de Geriatría y Gerontología. 2004; 39(5):314-9
9.- Moe OW, Baum M, Berry C, Rector F. Renal transport of glucose, amino acids, sodium, chloride, and water. In Brenner BM, Levine S (Eds). Philadelphia. Saunders. 2004: 413-452
10.- Dousdampanis P, Trigka K, Musso C, Fourtounas C. Hyperuricemia and Chronic Kidney Disease: an Enigma Yet to Be Solved. Renal Failure. 2014 (en prensa)
11.- Knepper MA, Gamba G. Urine concentration and dilution. In Brenner BM, Levine S (Eds). Philadelphia. Saunders. 2004: 599-636
12.- Scibona P, Angriman F, Vazquez C, Ferreyro BL, Perelsztein AG, Simonovich VA, Jauregui JR , Musso CG, Belloso WH. Individualisation of drug therapy in older people. Reviews in Clinical Gerontology. 2014; 24:145-157
13.- Musso C. Aminoglycosides and nephropathy.Electron J Biomed 2004; 2: 1-78
14.- Musso CG, Reynaldi J, Vilas M, De Miguel R, Imperiali N, Algranati L. Fractional excretion of K, Na and Cl following furosemide infusion in healthy, young and very old people. Int Urol Nephrol. 2010; 42: 273-277
15.- Musso CG. Magnesium metabolism in health and disease.Int Urol Nephrol. 2009;41:357-362
16.- Musso CG, Macías-Núñez JF. Dysfunction of the thick loop of Henle and senescence: from molecular biology to clinical geriatrics. Int Urol Nephrol. 2011;43(1):249-52
17.- Musso CG, Ghezzi L, Ferraris J. Renal physiology in newborns and old people: similar characteristics but different mechanisms. Int Urol Nephrol. 2004; 36 (2):273-6.
18.- Musso CG, Alvarez Gregori J, Jauregui R, Macías Nuñez J. Creatinine, urea, uric acid, water and electrolytes reanl handling in the healthy oldest old. World Journal of Nephrology. 2012; 1(5): 1-4
19.- Brown D, Nielsen S. The cell biology of vasopressin action. In Brenner BM, Levine S (Eds). Philadelphia. Saunders. 2004: 573-597
CORRESPONDENCIA:
Carlos G. Musso, PhD
Servicio de Nefrología y Medio Interno
Hospital Italiano de Buenos Aires (HIBA).
Buenos Aires.
Argentina
Mail: carlos.musso @ hospitalitaliano.org.ar
Comentario de la revisora Dra. Maria Noemi Pissano.
Coordinadora del grupo de Trabajo de Nefrologia. Hospital Jose Maria Penna. Ciudad Autonoma de Buenos Aires. Argentina.
Se trata de una revisión de los diferentes mecanismos de eliminación renal de los medicamentos, describiendo cada uno de los sectores del riñón que intervienen, los mecanismos de nefrotoxicidad de fármacos utilizados frecuentemente en la población y la comparación con los medicamentos cuya eliminación se produce principalmente por el hígado.
El conocimiento de la fisiología renal y la vinculación con la farmacocinética resulta de vital importancia a la hora de prescribir medicamentos a fin de evitar o atenuar sus efectos nefrotóxicos
Comentario de la revisora Dra. Sonia Butto. Servicio de Nefrología del Hospital Jose Maria Penna. Ciudad Autónoma de Buenos Aires. Argentina.
Desde el punto de vista farmacocinético, la excreción de medicamentos por vía renal es una de las más importantes. Su impacto disminuye en aquellas circunstancias en que un fármaco es metabolizado fundamentalmente a derivados inactivos por medio del parénquima hepático.
Dado que la fisiología renal puede verse afectada tanto por su envejecimiento, como por su enfermedad aguda o crónica, y que estos cambios pueden exponer al paciente al riesgo de sufrir sobredosis o interacciones farmacológicas adversas, es muy importante conocer los diferentes mecanismos implicados en el manejo renal de los fármacos. Su conocimiento permitirá no sólo su adecuada dosificación, sino además evitará la aparición de aquellos efectos adversos que sean previsibles.
