Indice del volumen Volume index
Comité Editorial Editorial Board
Comité Científico Scientific Committee
- Grupo etario (Púberes, Adultos y Adultos mayores )
- Peso de los animales recodificado (<35g, 35-40, 40-45, 45-50, > 50 g),
- Dosis de mantenimiento de halotano administrada (1,5%, 2%)
- Grupo experimental (Púberes - 1,5%, Púberes - 2%, Adultos - 1,5%, Adultos mayores - 1,5%, Adultos mayores - 2%)
- Condición que alcanza en primer lugar (Analgesia, Sedación, Ambos simultáneamente)
- Logro de sedoanalgesia óptima (sí, no)
- Características de la sedoanalgesia (óptima, insuficiente, no la alcanzó, falleció)
- Presencia de excitación en los animales durante la inducción (sí, no)
- Presencia de cambios durante el acto anestésico (sí, no)
- Cambios observados durante el acto anestésico (pérdida de la analgesia, pérdida de la sedación, pérdida de la sedoanalgesia, sedoanalgesia menor a 10 min.)
- Condición que indica el inicio de la recuperación (pierde sólo analgesia, pierde sólo sedación, pierde sedoanalgesia).
- Edad (días)
- Peso (gramos)
- Latencia (min) hasta actividad "inactivo"
- Latencia (min) hasta actividad "excitado"
- Latencia (min) hasta actividad "dormido"
- Latencia (min) hasta no respuesta al manejo
- Latencia (min) hasta respuesta negativa al pinzamiento de cola
- Latencia (min) hasta la sedoanalgesia
- Tiempo (min) que demora en recuperar actividad normal
- Tiempo (min) que demora en recuperar respuesta al manejo
- Tiempo (min) que demora en recuperar respuesta al pinzamiento
- Tiempo (min) que demora en perder la sedoanalgesia
- Tiempo (min) que demora en perder la sedación
- Duración (min) de la sedoanalagesia
- Tiempo (min) que demora en recuperarse desde que pierde la sedoanalgesia
- Tiempo total de recuperación
- Duración total (min) del acto anestésico
AGRUPAMIENTOS MULTIVARIADOS MODELIZAN LA RESPUESTA A LA SEDOANALGESIA CON HALOTANO EN RATONES
Tarrés MC1, Puig N2, Torres N3, Harvey G4, Elena G
1Cátedra de Biología.
2Instituto de Inmunología.
3Consejo Nacional de Investigaciones Científicas y Técnicas
4Estadística
Facultad de Ciencias Médicas y Consejo de Investigaciones. Universidad Nacional de Rosario, Argentina.
Rev Electron Biomed / Electron J Biomed 2014;3:26-32.
Comentario del revisor.Médico anestesiólogo de Hospital Italiano de Buenos Aires. Argentina.
Comentario del revisor.Médico anestesiólogo de Hospital Italiano de Buenos Aires. Argentina.
Comentario de la Dra Silvina Maria Lupi. Médica Anestesióloga. Especialista en Tratamiento del Dolor y Cuidados Paliativos. Jefa de Sección Dolor del Hospital Italiano de Buenos Aires
RESUMEN
El objetivo del estudio consistió en modelizar, a través de agrupamientos multivariados, la respuesta a un método de sedoanalgesia con halotano efectuado en ratones, mediante variables clínicas relevantes y determinar la dosis que permita obtener sedoanalgesia adecuada en cada grupo etario.
Se utilizaron ratones machos de la cepa CBi, cuyo manejo se efectuó según recomendaciones bioéticas internacionales para el empleo experimental de roedores de laboratorio. La inducción anestésica se efectuó con halotano 3% por 5 min. a todos los animales y luego la dosis de mantenimiento que correspondiera a cada grupo experimental: 1,5% ó 2%.
Se procesaron los datos mediante una combinación de técnicas estadísticas de análisis exploratorio multidimensional, que permitió una interpretación globalizada de la información. Se obtuvo una tipificación multivariada de los individuos y el análisis de todas las variables en conjunto posibilitó interpretar que la calidad de la respuesta a las maniobras anestésicas se vinculó con la edad de los animales y las dosis administradas, resultando óptima en el 75% de los casos y deficitaria en el 23%. En el caso de los animales que fallecieron (2%) no fue posible distinguir variables del acto anestèsico que resulten predictoras del desenlace.
En consecuencia, los resultados de esta modelización pueden contribuir a optimizar los procedimientos de sedoanalgesia, que permitirán administrar una anestesia tan corta como sea posible, con la consiguiente reducción de la cantidad total de drogas administradas y un mejor cuidado de los animales y además minimizar sesgos en los resultados experimentales.
PALABRAS CLAVE: Análisis exploratorio multidimensional. Clasificación anestesia. Sedación. Modelos animales
SUMMARY
Multivariate analysis clustering modelize halothane sedoanalgesia in mice
The main goals of this study were: a) to modelize the response to halothane sedoanalgesia in mice through the multivariate clustering of clinical relevant variables, and b) to assess the anesthetic schedule suitable for mice at different ages.
The experiments were conducted following international bioethical recommendations for animal studies, and 92 CBi male mice were used. Halothane was administered at 5% for 5 min. for anesthetic induction and, according to the experimental group, at 1.5% or 2.0% for the maintenance period.
Data were processed by a combination of techniques of exploratory multidimensional analysis, which permitted the global interpretation of the information. The multivariate characterization of the experimental units was obtained, which allowed us to recognize that the quality of the response to the anesthetic procedures was related both to mice's age and to the anesthetic doses administered. Sedoanalgesia resulted adequate for 75% of the evaluated cases, and not sufficient for 23%. In addition, 2% of the CBi mice died during the anesthetic procedure, but it was not possible to distinguish any variable suitable for predict mortality.
It follows, then, that modelization through multivariate clustering may contribute to optimize halothane sedoanalgesia procedures and to minimize the length of the anesthesia, with a reduction of the total amount of administered drugs. As a consequence, the better care of the experimental animals and also the reduction of the bias of experimental results due to anesthesia would be achieved.
KEY WORDS: Exploratory multidimensional analysis. Clustering. Anesthesia. Sedation. Animal models
INTRODUCCIÓN:
Uno de los desafíos fundamentales de la biología actual se vincula con el empleo de modelos que intentan predecir el comportamiento de los sistemas complejos que ellos representan1, siendo conocido que los términos modelo y modelización adquieren significados diferentes dependiendo del contexto donde se inscriban.
Según Jeffers2, un modelo sería la representación de las relaciones entre algunas cantidades o cualidades definidas formalmente y que van desde un simple esquema mental hasta complejos modelos de simulación numérica.
Otra clasificación distingue3, entre otros, los modelos físicos y los matemáticos. Desde esta perspectiva, los modelos físicos se basan en estructuras materiales empleadas en el laboratorio para simular el comportamiento de un sistema real, perteneciendo a ellos los biológicos. Estos refieren, en parte, a la experimentación con animales de laboratorio definiéndose como tal a cualquier especie que se mantiene bajo condiciones determinadas y se utiliza con fines científicos4.
El estudio de los modelos animales ha evolucionado como una rama multidisciplinaria de la ciencia biomédica que incluye el estudio de su biología y sus requerimientos ambientales, la estandarización genética y microbiológica, la prevención y el tratamiento de enfermedades y la búsqueda del mejoramiento de las técnicas experimentales y, particularmente en el caso que nos ocupa, de los procedimientos de anestesia y analgesia5-7.
Los modelos matemáticos son sistemas de ecuaciones y proposiciones lógicas que intentan representar las relaciones entre variables (propiedades mensurables del sistema cuyas magnitudes varían) y parámetros (cantidades temporalmente invariables que caracterizan al sistema). Cuando en la elaboración de modelos matemáticos se acude al uso de ordenadores se denominan computacionales, entre los que se pueden distinguir los multivariantes8.
En este sentido, al estudiar fenómenos y objetos complejos y cuando la riqueza y variedad de los datos disponibles lo permiten, es posible que éstos puedan tipificarse multidimensionalmente según diferentes criterios. Se han desarrollado y utilizado distintos enfoques para identificar subgrupos homogéneos, obteniéndose en muchos casos resultados satisfactorios en lo que respecta a la separación de lo distinto y unión de lo semejante9-11. Con respecto a ello, el análisis de clusters puede ser utilizado para elaborar agrupamientos multivariados que reúnan individuos con características similares dentro de cada clase y diferentes entre ellas12.
OBJETIVOS
En función de lo expuesto, el objetivo del presente estudio consistió en modelizar, a través de agrupamientos multivariados, la respuesta a un método de sedoanalgesia con halotano efectuado en ratones mediante variables clínicas relevantes y determinar la dosis que permita obtener sedoanalgesia en cada grupo etario.
MATERIALES Y MÉTODOS
Se utilizaron 92 ratones machos de la cepa CBi13, de edades comprendidas entre 49 y 220 días, cuyo manejo se efectuó según normas establecidas por el Committee for the Update of the Guide for the Care and Use of Laboratory Animals14 y los requerimientos del Comité Institucional para el Cuidado y Uso de Animales de Laboratorio (CICUAL) Facultad de Ciencias Médicas, UNR. Los procedimientos se refinaron para reducir dolor e incomodidades de acuerdo con las recomendaciones bioéticas internacionales para el empleo experimental de roedores de laboratorio.
Las series experimentales se llevaron a cabo en un ambiente silencioso y cálido (27-28°C). Los animales fueron identificados y pesados, luego colocados dentro de una caja de plexiglas, a la que se administró calor por medio de placas para evitarles hipotermia. No se sometió a los animales a anestesias reiteradas, por lo que cada ratón integró sólo uno de los grupos experimentales.
Se utilizó halotano (2 bromo-2 cloro-1,1,1 trifluoroetano: Fluothane, ICI-Farma) suministrado con vaporizador termocompensado (Fluotec Mark II, Cyprane), a presión atmosférica en oxígeno 100% (AGA Argentina), a un flujo de 4 l/min. durante 40 min. Para la inducción anestésica se administró halotano 3% por 5 min. a todos los animales y luego la dosis de mantenimiento que correspondiera a cada grupo experimental: 1,5% ó 2%.
Registros:
Se completó una ficha anestésica validada en ratones, donde constan variables que describen características de las unidades de análisis, del acto anestésico y su recuperación15.
Las evaluaciones se efectuaron después de comenzada la vaporización del anestésico, cada minuto durante los primeros 5 minutos, luego cada 5 minutos hasta finalizar la administración de halotano y cada 2 minutos hasta que el animal se recuperó.
Los animales fueron controlados en el período perianestésico y a las 24, 48 y 72 horas en búsqueda de signos de distress y disconfort16-17. No se observaron cambios en el tipo de actividad, ingestión de alimentos y agua, peso y conducta en post anestésico.
Definiciones
Duración del acto anestésico: Comienza con la administración de halotano y finaliza cuando el animal se recupera, pierde la analgesia y la sedación, deambula y explora el territorio.
Sedoanalgesia: Estado que combina dos características: sedación, depresión del nivel de conciencia con mantenimiento de la vía aérea permeable y analgesia clínica, reducción de la intensidad del dolor percibido. La sedación se comprueba cuando los animales, simultáneamente, no responden al manejo (cambios pasivos de posición), y están dormidos y la analgesia clínica se verifica cuando no responden al pinzamiento de la cola. La sedoanalgesia se considera óptima cuando se obtiene dentro de los 5 minutos de inducción anestésica y se mantiene durante el tiempo que se administra halotano e insuficiente cuando el animal la alcanza durante un período corto o cuando sale de ella durante el mantenimiento.
Latencias: Evaluaciones del tiempo que transcurre desde el comienzo de la administración de anestesia hasta que el animal alcanza determinada condición: dormido, no respuesta al manejo o al pinzamiento de la cola.
Análisis estadístico:
El enfoque multivariado incluye una serie de técnicas que posibilitan considerar de manera simultánea un conjunto de variables y, entre ellas, el análisis de correspondencias múltiples permite reducir las dimensiones de una matriz de datos con variables cualitativas o cuantitativas categorizadas mediante factores que den cuenta de los montos más importantes de la variación total18.
La escuela francesa del análisis de datos posibilita la elección de variables activas e ilustrativas. Las primeras son las que se incluyen en los cálculos de diagonalización de la matriz y las segundas, que pueden ser tanto cualitativas o como cuantitativas, se proyectan a posteriori en el espacio factorial19.
Para efectuar el análisis de correspondencias múltiples mencionado se consideraron como activas las siguientes variables categóricas:
Como ilustrativas se incluyeron las variables cuantitativas:
Luego de efectuado el análisis de correspondencias múltiples se construyó una tipología, teniendo en cuenta las coordenadas de los puntos en los ejes factoriales. Para evaluar el significado estadístico de las modalidades de las variables activas se compararon los porcentajes, verificando si la frecuencia relativa es mayor en una clase y al mismo tiempo menor en las otras. El aporte de las variables ilustrativas continuas se determinó comparando el promedio de cada clase con la media general, que corresponde al del conjunto total de individuos20.
Los análisis mencionados se realizaron utilizando el programa informático SPAD (Système Pour l'Analyse des Donèes), versión 4.51, CISIA-CERESTA, París, considerando en todos los casos significativo un valor de p?0,05.
Las variables numéricas se expresaron como promedio ± desvío estándar.
RESULTADOS
La descripción simultánea de la estructura de los datos mediante el análisis de correspondencias múltiples se realizó a través de una representación gráfica en ejes factoriales, donde sobre un plano dividido en cuadrantes se ubican los puntos representativos de las categorías de las variables activas, analizándose sus posiciones recíprocas.
Se construyó luego una tipología de individuos, eligiendo el número de clases mediante la inspección visual del dendrograma19. La Figura 1 indica una buena partición en cuatro clases.
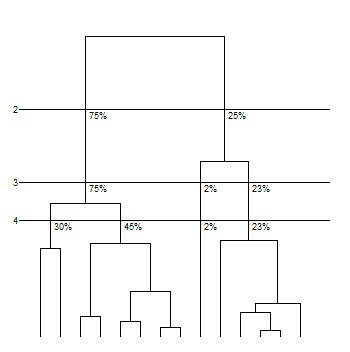
Figura 1: Representación gráfica del árbol o dendrograma, donde se visualiza una partición en 4 agrupamientos o clases,
señalada por la tercera línea horizontal. A la clase 1 pertenecieron el 30% de las unidades de análisis,
a la clase 2 el 45%, a la 3 el 2% y a la 4 el 23% de los individuos
La estructura de las clases de acuerdo al aporte estadísticamente significativo de las categorías de las variables activas (p<0,001 en todos los casos) y de los valores de las ilustrativas, se describe como sigue:
La clase 1 estuvo configurada fundamentalmente por animales púberes que recibieron halotano al 1,5% y al 2%, de peso menor de 35g, que no presentaron excitación durante la inducción, lograron sedoanalgesia óptima y se recuperaron simultáneamente de la sedación y de la analgesia. La latencia hasta la respuesta negativa al pinzamiento de cola fue superior a la media general (4,68 ± 3,14 min vs. 3,54 ± 2,48 min, p=0,002) así como la latencia hasta la sedoanalgesia (4,75± 3,10 min vs. 3,69 ± 2,37 min, p=0,002).
La clase 2 la formaron fundamentalmente ratones adultos que recibieron halotano al 1,5% y adultos mayores al 2%, con peso 50g, que tuvieron sedoanalgesia óptima y que alcanzaron en primer lugar sedación y luego analgesia. Durante la inducción, se observó excitación y en la recuperación la condición que perdieron en primer lugar fue la analgesia. La duración total del acto anestésico fue de 47,27 ± 3,08 min, superior a la media general (45,74 ± 3,12 min, p=0,000) y esta relación se mantuvo en el tiempo total de recuperación (7,27 ± 3,08 min vs. 5,74 ± 3,12 min, p=0,000), en la duración de la sedoanalagesia (42,24 ± 2,52 min vs 38,15 ± 8,83 min, p=0,000), en el tiempo que demoraron en perder la sedación (6,93± 2,76 min vs 3,20 ± 2,87 min, p=0,006) y en recuperar la actividad normal (7,12 ± 2,89 min vs 3,35 ± 2,92 min, p=0,006).
En la clase 3 se encuentran los dos animales que fallecieron durante el acto anestésico, pudiendo observarse que pertenecían al grupo de los púberes que recibieron halotano al 2% y con peso < a 35g.
La clase 4 agrupó a los adultos mayores que recibieron halotano al 1,5%, cuya sedoanalgesia fue insuficiente y durante el acto anestésico hubo episodios donde perdieron tanto sedación como analgesia. La latencia hasta la actividad "dormido" fue 3,48 ±1,09 min vs 2,85 ± 0,88 min, p=0,000), hasta no respuesta al manejo de 4,33 ± 2,53min vs 3,14 ± 2,19min, p=0,002) y el tiempo que demoraron en recuperarse desde que perdieron la sedoanalgesia fue superior al promedio general: 16,67 ± 14,17 min vs 3,44 ± 13,81 min, p=0,000.
En la Figura 2 se observan las unidades de análisis proyectadas en el gráfico factorial, identificadas según su pertenencia a cada clase.
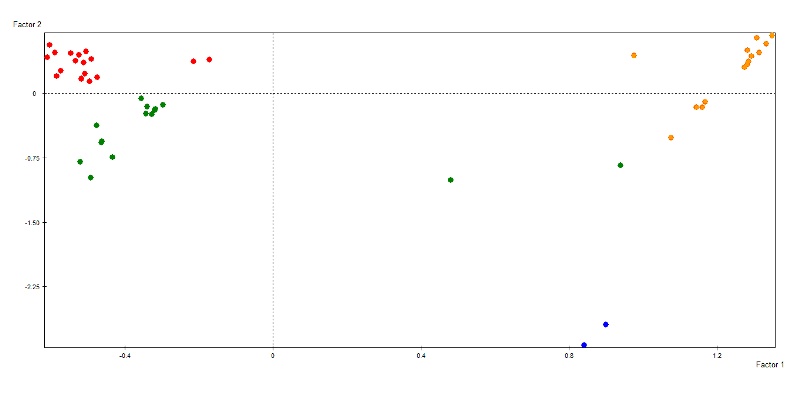
Figura 2. Proyección de las unidades de análisis según su clase de pertenencia.
La clase 1 es de color verde, la clase 2 roja, la clase 3 es azul y la 4 de color naranja
Las coordenadas representan los dos primeros ejes factoriales surgidos del análisis de correspondencias múltiples. En los clusters 1, 2 y 4 se ubican individuos superpuestos
DISCUSIÓN
La especie animal más utilizada en experimentación científica es el ratón (Mus musculus), debido no sólo a sus características reproductivas, su tamaño y la facilidad de manejo, sino también a que su genoma es totalmente conocido. Esto último ha permitido el desarrollo de modelos animales que pueden reproducir características específicas o enfermedades del hombre y de animales, convirtiéndose en reactivos biológicos sobre los cuales se pueden extrapolar los resultados de las investigaciones21.
Muchos investigadores consideran al ratón como un biomodelo casi perfecto porque además de su corto tiempo generacional, alta performance reproductiva y fácil mantenimiento, son los animales más sofisticados que pueden ser utilizados por los investigadores22-23.
El ratón es el segundo mamífero -después de los seres humanos- del que se ha logrado secuenciar su genoma, aunque sí se han publicado bosquejos de las secuencias del mono, el perro, la rata, el gato, el macaco y hasta del ornitorrinco24.
Los resultados de los trabajos experimentales con ratones son de suma importancia debido a que tienen una aplicación directa en seres humanos, dado que la estructura, función y características farmacológicas (hasta los puntos finales anestésicos) del sistema nervioso de los ratones son semejantes a la de los seres humanos. Incluso los efectos de los anestésicos se obtienen a dosis comparables con las que se usan clínicamente25. El objetivo del presente estudio consistió en modelizar, a través de agrupamientos multivariados, la respuesta a un método de sedoanalgesia con halotano efectuado en ratones mediante variables clínicas relevantes y determinar la dosis que permita obtener sedoanalgesia en cada grupo etario.
Los requerimientos de anestésicos inhalatorios pueden variar entre individuos por diferencias en genes y alelos que gobiernan la respuesta a los anestésicos26 y por efecto de factores ambientales o fisiológicos, tales como la temperatura cerebral o la edad27. En este sentido, en el presente trabajo se evaluaron características de la respiración, la perfusión y la oxigenación. Asimismo, para asegurar la estandarización de los procedimientos anestésicos, se reguló la temperatura ambiente a fin de lograr una temperatura central constante, ya que durante el procedimiento anestésico se pierden mecanismos de ganancia de temperatura (piloerección, espasmos musculares, vasoconstricción).
En general, la potencia de los anestésicos inhalatorios aumenta con la edad: la concentración necesaria en neonatos ratas, ratones y humanos es mayor que la de los adultos jóvenes28. Paradójicamente, los resultados presentes indican que en los adultos mayores el requerimiento de anestésico fue superior, es decir, la potencia anestésica disminuyó con la edad. Esto último podría relacionarse con el hecho que los ratones adultos mayores de la cepa CBi presentan en su composición corporal menor masa magra29. Dado que el tejido adiposo actúa como sitio de depósito para los anestésicos inhalatorios, drogas muy liposolubles, parte del halotano no llegaría a su diana y así el requerimiento del fármaco aumentaría.
Un comentario final merece la metodología estadística empleada en este trabajo, donde se procesaron los datos mediante una combinación de técnicas de análisis exploratorio multidimensional, que permitió una interpretación globalizada de la información. Así, a través de técnicas de clasificación sobre las coordenadas factoriales, se obtuvo una tipificación multivariada de los individuos y el análisis de todas las variables en conjunto, condujo a interpretar que la calidad de la respuesta a las maniobras anestésicas se vinculó con la edad de los animales y las dosis administradas, resultando óptima en el 75% de los casos (clases 1 y 2) y deficitaria en el 23% (clase 4). Los animales que fallecieron (2%) se ubicaron en la clase 3 y no fue posible distinguir variables del acto anestèsico que resulten predictoras del desenlace. En consecuencia, los resultados de esta modelización pueden contribuir a optimizar los procedimientos de sedoanalgesia, que permitirán administrar una anestesia tan corta como sea posible, con la consiguiente reducción de la cantidad total de drogas administradas y un mejor cuidado de los animales30 y además minimizar los sesgos de los resultados experimentales31.
REFERENCIAS
1. Balling R. From mouse genetics to systems biology. Mamm Genome 2007; 18:383-388. OK
2. Jeffers JNR. Modelling. Chapman & Hall, Londres, 1982, 80 p.
3. Ibáñez JJ, Machado C, Zuccarello V, González-Huecas C. Modelos de Simulación y Variabilidad Espacio-Temporal. Geoforma-CSIC, Logroño, 1995, 132 p.
4. Hernández S. El modelo animal en las investigaciones biomédicas. Biomedicina 2006; 2:252-256. OK
5- Öbrink KJ, Rehbinder C. Animal definition: A necessity for the validity of animal experiments? Lab Anim 1999; 22: 121-130
6- van Zutphen LFM. Laboratory animal science: a view on the edge of the millenium. Revista de Ciència 1999; 23-24:29.
7. Alonso Concepción AR, de la Peña Pino R, García Capote J. Acercamiento al accionar ético-moral del científico que trabaja con animales de experimentación. Acta Bioeth 2007; 13:9-15. OK
8. Ibáñez JJ. Concepto y tipos de modelos científicos. 2008. Disponible en: http://www.madrimasd.org/blogs/universo/2008/05/10/91441
9. McLachlan GJ. Cluster analysis and related techniques in medical research. Stat Methods Med Res 1992; 1:27-48. OK
10. Leese M, Landau S. Model-based clustering using S-PLUS. Int J Methods Psychiatr Res 2006; 15:146-156. OK
11. Ambrogi F, Biganzoli E, Boracchi P. Multiple correspondence analysis in S-PLUS. Comput Methods Programs Biomed 2005; 79:161-167. OK
12. Moscoloni N. Las nubes de datos. Métodos para analizar la complejidad. Editorial UNR, Argentina, 2005, 257 p.
13. Elena G, Amerio N, Ferrero P, Bay ML, Valenti J, Colucci D, Puig NR. Effects of repetitive sevoflurane anaesthesia on immune response, select biochemical parameters and organ histology in mice. Lab Anim 2003; 37:193-203. OK
14. Committee for the Update of the guide for the care and use of laboratory animals. Guide for the care and use of laboratory animals. Institute for Laboratory Animal Research. National Academy of Sciences. Eighth edition. The National Academies Press. Washington, DC 2011. OK
15. Elena G, Colucci D, Harvey G, Echaniz G, Fini C, Consiglio F, Puig N. Sedoanalgesia con Ketamina-Midazolam-Fentanilo en ratones. Características y seguimiento por una planilla de registro. Rev Electrón Biomed 2014; 1: (en prensa)
16. Piersma FE, Daemen MA, vd Bogaard AE et al. Interference of pain control employing opioids in in vivo immunological experiments. Lab Anim 1999; 33:328-333.
17. Hawkins P. Recognizing and assessing pain, suffering and distress in laboratory animals: a survey of current practice in the UK with recommendations. Lab Anim. 2002; 36:378-95.
18. Cuadras CM. Nuevos Métodos de Análisis Multivariante. CMC Ediciones. Barcelona, España, 2007, 249 p.
19. Lebart L, Morineau A, Piron M. Statistique exploratoire multidimensionelle. Ed Dunod, Paris, 1995, 439 p.
20. Morineau A note sur la caractérisation statistique d' une classe et les valeurs-test. Bull Tech Centre Stat Inf Appl 1984; 2:20-27.
21. Carbone C, Maschi F. El ratón nude (nu/nu) como modelo animal de inmunodeficiencia. Rev Química Viva 5, 1:19-23, 2006.
22. Atchley W, Fitch W. Genes trees and the origins of inbread strain of mice. Science 1991; 254:554-558.
23. Benavides F, Guénet J. Manual de genética de roedores de laboratorio: principios básicos y aplicaciones. SECAL. Universidad de Alcalá, 2003. 209 p.
24. Church DM, Goodstadt L, Hillier LW et al. Lineage-specific biology revealed by a finished genome assembly of the mouse. PLoS Biol 2009; 7(5): e1000112.doi:10.1371, 2009. www.plosbiology.org
25. Sonner JM, Gong D, Eger EI. Naturally ocuring variability in anesthetic potency among inbred mouse strains. Anesth Analg 2000; 91: 720-726.
26. Mogil JS, Smith SB, O'Reilly MK, Plourde G. Influence of nociception and stress induced antinociception on genetic variation in isoflurane anesthetic potency among mouse strains. Anesthesiology 2005; 103:751-758.
27. Eger EI. Anesthetic uptake and action. Williams and Wilkins Ed, Baltimore, 1974. 383 p.
28. Fang, Z, Ionescu, P, Gong, D, Kendig, J Harris A, Eger EI. Maduration decreases etanol minimum alveolar anesthetic concentration in mice as previously demonstrated in rats: there is no species difference. Anesth Analg 1997; 85:160-3.
29. Gayol MC, Chapo G, Zubillaga P, Menoyo I, Gayol MdelC, Tarrés MC. Conformación corporal, grasa abdominal y estado sanitario general diferencian hembras adultas mayores en las subcepas de ratones CBi/01 y CBi/02. XV Jornada de Divulgación Técnico Científicas 2014. Facultad de Ciencias Veterinarias. UNR. Casilda, 2014, 155-156.
30. Sinner B, Becke K, Engelhard K. General anaesthetics and the developing brain: an overview. Anaesthesia 2014; 14. doi: 10.1111/anae.12637.
31. Colucci D, Harvey G, Gayol MC, Elena G, Puig N. Halothane anesthesia in mice: effect on the phagocytic activity and respiratory burst of peritoneal macrophages. Neuroinmmunomodulation 2011; 18:11-18.
SOPORTE ECONÓMICO: El presente trabajo fue subsidiado por aportes de la Facultad de Ciencias Médicas y de la Secretaría de Ciencia y Tecnología de la Universidad Nacional de Rosario, Argentina.
CONFLICTOS DE INTERÉS: Los autores declaran no tener conflictos de interés
CORRESPONDENCIA:
Prof. Dra. María Cristina Tarrés
Cátedra de Biología
Facultad de Ciencias Médicas, UNR
Santa Fe 3100
Rosario (CP 2000)
Argentina
Mail:mcristinatarres @ gmail.com
Comentario del revisor Médico anestesiólogo de Hospital Italiano de Buenos Aires. Argentina.
Los anestesiologos le debemos mucho al halotamo, ha sido el primer anestesico inhalatorio no imflamable en ser incorporado a quirofano lo cual mejoro ostensiblemente nuestra seguridad y la de nuestros pacientes, lento pero exelente inductor en asmaticos y pediatria.
Por su distribucion en el tejido adiposo dependia mucho de la distribucion de la misma tanto para dormir como para despertar a nuestros pacientres, mayor cantidad de tejido adiposo, mas lenta la induccion y el despertar, pero menor el requerimiento intraquirurgico. Excelente analgesico combinado con opioides. Muy buena relacion costo/ beneficio. Fue el precursor de la tecnica balanceada (combinación de fármacos de distinto mecanismo de acción para lograr la potenciación de su efecto) en anestesia.
Comentario de la Dra Silvina Maria Lupi. Médica Anestesióloga. Especialista en Tratamiento del Dolor y Cuidados Paliativos. Jefa de Sección Dolor del Hospital Italiano de Buenos Aires
El halotano fue introducido por primera vez para uso anestesiológico en 1956, reemplazando totalmente al éter por su seguridad al ser el primer anestésico volátil no inflamable. Pero presenta una elevada incidencia de toxicidad hepática, manifestándose con dos sindromes clínicos: la hepatitis por halotano, la cual es atribuida a una causa inmunológica y se caracteriza por ser impredecible con una incidencia de hasta 1/35000 luego de una exposición única y hasta 1/3000 luego de exposiciones reiteradas, y la hepatotoxicidad por halotano, la cual se interpreta como secundaria a su metabolismo hepático por oxidoreducción, con formación de radicales libres en situaciones de hipoxia tisular; observándose elevación de aminotransferasas hasta en un 30% de los pacientes.
La mayoría cursa de manera asintomática y se recupera en semanas sin mediar tratamiento, y en el caso de requerirlo, este es de soporte. De instalarse una insuficiencia hepática aguda la mortalidad suele ser del orden del 50% y del 80% si cursa con encefalopatía hepática.
En la actualidad se ha ido reemplazando por nuevos anestésicos más seguros como sevofluorano, pero aún sigue utilizándose ampliamente en el mundo.
