Indice del volumen Volume index
Comité Editorial Editorial Board
Comité Científico Scientific Committee
LINFOMA DE CÉLULAS DEL MANTO REFRACTARIO: TEMSIROLIMUS COMO OPCIÓN DE TRATAMIENTO
Virginia Benito Ibáñez1, Sara Barbadillo Villanueva1,
Beatriz Cuevas Ruiz2, María Paz Espinosa Pérez1.
1Servicio de Farmacia, 2Servicio de Hematología.
Hospital Universitario de Burgos. Burgos, España
vbenitoi @ saludcastillayleon.es
Rev Electron Biomed / Electron J Biomed 2015;3:9-14.
Comentario del revisor Prof. Francisco Abad, PhD, MD. Servicio de Farmacología Clínica. Hospital de la Princesa. Madrid.
Comentario del revisor Prof. Sandro Bustamante. M.Sc. Programa de Farmacología Molecular y Clínica. ICBM - Facultad de Medicina Universidad de Chile. Santiago de Chile. Chile.
RESUMEN
Introducción:Temsirolimus es un fármaco indicado en linfoma de células del manto (LCM) en recidiva o refractariedad. La evolución de este tipo de linfoma no Hodgkin (LNH) es agresiva y la respuesta al tratamiento es pobre.
Objetivos: Evaluar la efectividad y seguridad del temsirolimus en pacientes con LCM.
Material y métodos: Se realizó un estudio retrospectivo observacional en un hospital de tercer nivel de los pacientes en tratamiento con temsirolimus para la indicación de LCM, desde noviembre del 2011 hasta abril del 2015.
Resultados: Se estudiaron cinco pacientes, todos varones tratados con temsirolimus con un rango de edad de 78 a 91años. Se administró el fármaco en monoterapia en tres casos, y en los otros dos se asoció a rituximab.
El tratamiento se indicó desde 2 a 5 línea. La mediana de supervivencia libre de progresión (SLP) fue de 1,1 meses (0,5-8) y la mediana de supervivencia global (SG) fue de 4,9 meses (0,5-10).
Con respecto a la tolerabilidad, los tres pacientes en monoterapia tuvieron reducción de dosis debido a acontecimientos adversos. Las reacciones más frecuentes fueron anemia (100%) y neutropenia, trombocitopenia e infección con un 60%.
Discusión: Las medianas de SLP y SG son menores que en el ensayo clínico del medicamento (4,8 meses y 12,8 meses respectivamente). Hay que tener en cuenta que nuestra muestra es pequeña de edad muy avanzada y que algunos pacientes tenían enfermedades asociadas graves.
Los efectos adversos observados son los esperados, manejables con reducción de dosis.
PALABRAS CLAVE: Linfoma no Hodgkin. Inhibidor de mTOR. Linfoma de alto grado. Tratamiento en recaída.
SUMMARY
Introduction: Temsirolimus is a drug approved for relapsed or refractory Mantle Cell Lymphoma (MCL). Disease progression of this Non-Hodgkin Lymphoma is aggressive and has a poor treatment response.
Objectives: To evaluate efficacy and safety on temsirolimus in MCL.
Materials and methods: A retrospective observational study was conducted in a third level hospital of the patients receiving temsirolimus as a MCL treatment, from November 2011 to April 2015.
Results: Five patients were studied, all male aged between 78 to 91 years. Three patients received the drug in monotherapy and two in combination with rituximab.
Line of treatment varied from second line to fifth line. Progression Free Survival (PFS) was 1,1 months (0,5-8) and Overall Survival (OS) was 4,9 months (0,5-10).
Concerning tolerability, the three patients in monotherapy had dose reductions due to adverse effects. Most frequent events of both monotherapy and combination treatment were anemia (100%) followed by neutropenia, thrombocytopenia and infection (all of them 60%).
Discussion: PFS and OS are smaller than in the clinical trial (4,8 months and 12,8 months respectively). It must be taken into account that our sample size is small, aged and with severe comorbilities.
Adverse effects observed are the spectated, all manageable with dose reductions.
Key words: Non-Hodgkin lymphoma. MTOR inhibitor. High-grade lymphoma. Relapse treatment
INTRODUCCIÓN
El linfoma de células del manto (LCM) es un tipo de linfoma no Hodgkin (LNH) de linfocitos B que representa entre un 2.5-10% de todos los linfomas1. El comportamiento biológico es de carácter agresivo (clasificación de la OMS 2008)2, con una supervivencia media de 2 a 3 años presentándose en estadios avanzados hasta en el 70% de los casos. El diagnóstico es mayoritario en individuos de edad avanzada, con una media de 68 años y predominantemente en varones, proporción 4:1 con respecto a las mujeres 3.
En pacientes en recaída o refractarios las expectativas de vida son cortas.
Fenotípicamente se caracteriza por la presencia de una población monoclonal de línea B CD5+ y sobreexpresión de ciclina D1 asociada a la presencia de la translocación t(11;14)1.
La sintomatología que presentan estos pacientes suele ser de astenia, aparición de adenopatías y enfermedad diseminada que puede afectar a médula ósea, bazo, hígado y tracto digestivo1,3. Cuando se invade la médula ósea y sangre periférica hablamos de leucemización y ocurre en el 35% de los casos, el pronóstico es inferior en estos casos4.
Se ha elaborado un índice pronóstico (MIPI) con los siguientes factores: edad, estado general (ECOG), niveles de lactato deshidrogenasa (LDH) y cifra de leucocitos que clasifica a los pacientes en 3 grupos de riesgo pronóstico 5-6.
Una pequeña proporción de los pacientes cursan con una enfermedad indolente, por lo que en estos casos se puede adoptar una actitud de "esperar y ver"7. Sin embargo, como ya se ha dicho anteriormente, la mayoría de los diagnósticos se realizan en estadios avanzados, siendo ya una entidad mayoritariamente incurable, que requiere tratamiento inmediato. Aunque el LCM es un linfoma quimiosensible y radiosensible, se caracteriza por tener unas respuestas de corta duración8.
Teniendo en cuenta la edad de los pacientes al diagnóstico, se plantea la realización de trasplante de médula ósea previo tratamiento con esquemas de inducción que incluyan altas dosis de ARA-C en pacientes jóvenes. Aquellos que no sean candidatos a trasplante se pueden considerar diferentes esquemas de quimioterapia como R-CHOP [rituximab, ciclofosfamida, doxorrubicina, vincristina, prednisona], Rituximab-Bendamustina, Bortezomib, Temsirolimus, Talidomida9.
En pacientes en recaída o refractarios en los cuales las expectativas de vida son cortas, una de las opciones de tratamiento que encontramos es temsirolimus, un inhibidor selectivo mTOR (diana de la rapamicina en las células de mamífero). Con la unión a mTOR se consigue retrasar el crecimiento en la fase G1 del ciclo celular y la interrupción en la traducción de algunas proteínas reguladoras como las ciclinas de tipo D. Además podría tener la capacidad también de deprimir niveles de factores inducibles por la hipoxia (HIF) y factor de crecimiento del endotelio vascular (VEGF) reduciendo así la angiogénesis del tumor10.
Además se puede asociar al temsirolimus el anticuerpo rituximab, la combinación de ambos demostró mejores resultados frente a la monoterapia en respuestas globales, respuestas completas y supervivencia libre de enfermedad 11.
MATERIAL Y MÉTODOS
Se realizó un estudio retrospectivo observacional en un hospital de tercer nivel de los pacientes que se trataron con temsirolimus para la indicación de LCM, desde noviembre del 2011 hasta abril del 2015.
Los datos se obtuvieron de la historia clínica de los pacientes y del programa informático de dispensación a pacientes ambulantes.
Los datos recogidos fueron: edad, sexo, enfermedades asociadas, estadio de la enfermedad (clasificación Ann-Arbor)12, índice pronóstico de LCM (MIPI), líneas de tratamiento previas, dosificación y reacciones adversas asociadas a temsirolimus, supervivencia libre de progresión (SLP) y supervivencia global (SG).
RESULTADOS
Un total de cinco pacientes se trataron con temsirolimus en las fechas seleccionadas. Todos fueron hombres con edades comprendidas entre los 78-91años. El estadio de la enfermedad al diagnóstico según la clasificación Ann-Arbor fue de grado I en un paciente (afectación de una única región ganglionar o de un único sitio u órgano extraganglionar) y de grado IV en el resto (afectación diseminada de uno o más órganos extralinfáticos asociada o no con enfermedad ganglionar).
En cuanto al pronóstico calculado para nuestros pacientes según MIPI un paciente correspondía al grupo de bajo riesgo, dos al de riesgo intermedio-alto y dos al de riesgo alto.
Es importante destacar que en cuatro de los casos se encontraron comorbilidades graves: un paciente con cáncer hepático, otro con hipertensión pulmonar, otro con isquemia coronaria crónica y otro con insuficiencia renal crónica en hemodiálisis.
Como se puede ver también en la Tabla 1, se eligió la monoterapia en tres pacientes: dos iniciaron el tratamiento según las indicaciones, con dosis de 175 mg una vez a la semana durante 3 semanas, para seguir después con 75 mg semanales, sin embargo ambos dos precisaron reducciones de dosis debido a reacciones adversas, continuándose el tratamiento al 80% de la dosis en uno de los casos por astenia intensa, y al 60% en el otro por anemia. El tercer paciente de monoterapia que fue diagnosticado de LCM leucemizado, inició temsirolimus a dosis bajas (50 mg) desde el primer ciclo por su mal estado general. También requirió reducción de dosis (25mg) por trombopenia.
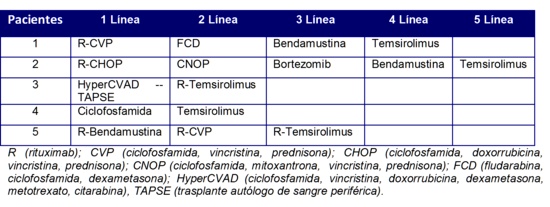
Tabla 1: Datos pacientes
En los dos pacientes restantes se optó por un tratamiento combinado con rituximab (a dosis de 375 mg/m2) semanalmente durante el primer mes, con una dosis de temsirolimus de 25 mg también semanal.
El tratamiento se indicó desde 2 a 5 línea. (Tabla 2)
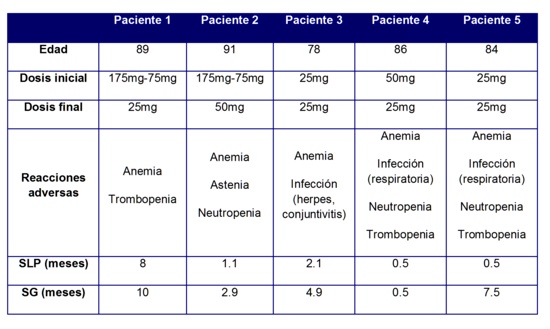
Tabla 2: Líneas previas de tratamiento de los pacientes
La mediana de SLP fue de 1,1 meses (0,5-8) y la mediana de SG fue de 4,9 meses (0,5-10). Desde el momento del diagnóstico la mediana de supervivencia fue de 5 años4-6.
La reacción adversa más frecuente fue la anemia dándose en el 100% de los casos. Fue controlada con transfusiones sanguíneas y precisó de reducción de dosis en un paciente. Neutropenia, trombocitopenia e infección fueron los efectos secundarios de mayor incidencia con un 60% cada uno.
DISCUSIÓN
Las medianas de SLP y SG son menores que en el ensayo clínico pivotal del medicamento (4,8 meses y 12,8 meses respectivamente). Sin embargo contamos con una muestra muy pequeña de edad avanzada y con pacientes que cuentan con comorbilidades graves que pueden modificar la supervivencia.
Los estudios publicados demuestran mejores resultados con la asociación de rituximab. Pese a nuestro tamaño muestral insuficiente, nuestros datos no sugieren esto.
Los efectos adversos más frecuentes son los observados en los ensayos realizados, con frecuencias mayores a las medianas, pero esperables en el rango de edad avanzada (> 65 años).
En el momento que se escriben estas líneas se encuentra disponible el fármaco inhibidor de la tirosin kinasa de bruton ibrutinib. En el estudio de fase III se compara con placebo en linfoma de células del manto en 111 pacientes refractarios o en recaída, el 21% de los pacientes alcanzó una respuesta completa y el 47% tuvo una respuesta parcial. La duración media de la respuesta al tratamiento fue de 17,5 meses. Esta podría ser una opción para futuros pacientes en recaída13-14.
REFERENCIAS
1. Jaffe ES, Harris NL, Vardiman JW, Campo E, Arber DA. Hematopathology 2011, Chapter 21, 333-348.e5
2. Jaffe ES, Harris NL, Stein H, Isaacson PG. Classification of lymphoid neoplasms: the microscope as a tool for disease discovery. Blood. 2008; 112(12):4384-99
3. Hoffman R, Benz E, Silberstein L, Heslop H, Weitz J, Anastasi J. Hematology: Basic Principles and Practice, sixth edition 2013. Chapter 80, 1226-1235.e3
4. Fabregat AB,Estela PL, Valero M. Leucemización de linfoma de células del manto. Revista del Laboratorio Clínico, December 2015
5. Hoster E, Dreyling M, Klapper W, Gisselbrecht C, van Hoof A, Kluin-Nelemans HC, et al. A new prognostic index (MIPI) for patients with advanced-stage mantle cell lymphoma. Blood. 2008;111:558-65.
6. MIPI: Mantle Cell Lymphoma International Prognostic Index. Disponible en: http://www.european-mcl.net/en/clinical_mipi.php
7. Sociedad Castellano-Leonesa de Hematología y Hemoterapia. Guías Linfoma 2014. 30,31p.
8. García-Noblejas A, Cannata J, Arranz R. Actualización del tratamiento del linfoma de células del manto 2011
9. Campo E, Rule S. Mantle cell lymphoma: evolving management strategies. January 1, 2015; Blood: 125 (1)
10. Ficha técnica Torisel EMEA. Consultada el 12/12/2015.
11. Navarro B, García-Marco JA. Linfoma de células del manto: ¿hacia una estrategia terapéutica individualizada? Medicina Clínica, 2015-06-22, Volumen 144, Número 12, Pages 553-559
12. Armitage J. Staging Non-Hodgkin Lymphoma. CA Cancer J Clin 2005;55:368-376.
13. Ficha técnica de Imbruvica®. AEMPS. Consultada el 15/12/15
14. Bernard S et al. Activity of ibrutinib in mantle cell lymphoma patients with central nervous system relapse. October 1, 2015; Blood: 126 (14)
CORRESPONDENCIA:
Virginia Benito Ibáñez.
Servicio de Farmacia
Hospital Universitario de Burgos
09006 Burgos
vbenitoi @ saludcastillayleon.es
Comentario del revisor Prof. Francisco Abad, PhD, MD. Servicio de Farmacología Clínica. Hospital de la Princesa. Madrid.
Los pacientes con linfoma de células del manto presentan un pronóstico muy malo por lo que suelen probar diferentes tratamientos.
El temsirolimus es una de las alternativas más recientes. Este estudio demuestra que el efecto beneficioso de los fármacos en la práctica clínica diaria (efectividad) es muy inferior a la observada en los ensayos clínicos (eficacia), lo que se explica porque los pacientes incluidos en los ensayos clínicos son una muestra muy seleccionada que no presentan la gravedad ni las enfermedades concomitantes que se presentan en el mundo real.
Comentario del revisor Prof. Sandro Bustamante. M.Sc. Programa de Farmacología Molecular y Clínica. ICBM - Facultad de Medicina Universidad de Chile. Santiago de Chile. Chile.
Aborda la temica esperable a juzgar por el tulo del trabajo, aunque el foco está enfatizado en la patología del linfoma que en temsirolimus.
Si bien la revisión bibliográfica no considera la información del estado del arte en la materia1, los resultados son relativamente claros y las tablas están bien elaboradas, son comprensibles y aportan información al lector.
1Hess et al. Effect of prognostic classification on temsirolimus efficacy and safety in patients with relapsed or refractory mantle cell lymphoma: a retrospective analysis. Exp Hematol Oncol 2015;4:11.
