Indice del volumen Volume index
Comité Editorial Editorial Board
Comité Científico Scientific Committee
ANÁLISIS DE LA TROMBOSIS PRE Y POSTDIAGNÓSTICO DE TROMBOCITEMIA ESENCIAL: IMPLICACIÓN EN LA SUPERVIVENCIA.
María Victoria Cuevas1, Ignacio Martínez-Sancho2, Jorge Labrador1, Cristina Martínez-Cuevas3, Beatriz Cuevas1
1Servicio de Hematología-Hemoterapia. Hospital Universitario de Burgos
2 Centro de Salud "Las Huelgas", Burgos.
3Servicio de Digestivo. Hospital Río Hortega de Valladolid,
España.
Email: mvcuevas @ hubu.es
Rev Electron Biomed / Electron J Biomed 2023;1:18-27.
Comentario de la revisora Dra.Victoria P. Musso-Enz. Servicio de Cardiología. Hospital Italiano de Buenos Aires. Argentina.
Comentario de la revisora Dra. Comentario de la revisora Dra. Carolina Martorell. Servicio de Hematología. Hospital Dr. Julio Cecilio Perrando. Resistencia. Chaco. Argentina.
RESUMEN
Introducción:
Las manifestaciones trombóticas pueden preceder o presentarse tras el diagnóstico de la Trombocitemia Esencial (TE) condicionando la supervivencia de los pacientes.
Objetivo: Analizar el número de manifestaciones trombóticas previas y posteriores al diagnóstico de Trombocitemia Esencial y valorar su impacto en la supervivencia.
Material y métodos: Estudio retrospectivo de pacientes con TE diagnosticados entre los años 2000 y 2022 inclusive. Se recogieron variables demográficas, clínicas y biológicas en el momento del diagnóstico, así como la presencia de trombosis antes o después de este diagnóstico. Se analizó la supervivencia global de los pacientes con trombosis antes del diagnóstico de TE y después de este diagnóstico.
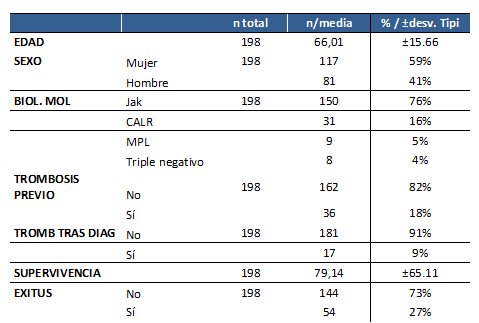
Resultados: Se evaluaron 198 pacientes, 117 mujeres (59%) y 81 hombres (41%) con una edad promedio de 66,01 (± 15,66). En cuanto a la mutación driver, 150 pacientes (75%) tenían JAK2, 31 (16%) CALR, 9 (5%) MPL y 8 (4%) fueron triple negativos. Antes del diagnóstico de TE, 36 (18%) habían tenido una trombosis y 17 (9%) una trombosis después del diagnóstico. 54 (27%) pacientes murieron durante el período de estudio. El análisis de supervivencia reveló que la aparición de una trombosis tras el diagnóstico de TE disminuye la supervivencia.
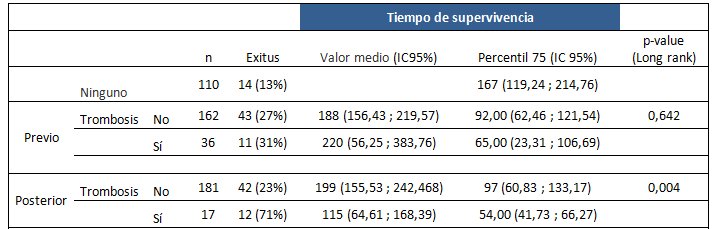
Conclusiones: La trombosis tras el diagnóstico de TE disminuye la supervivencia (p 0,004). Sin embargo, la trombosis previa al diagnóstico de trombocitemia esencial no modifica la supervivencia.
PALABRAS CLAVE: Trombocitemia Esencial, trombosis, supervivencia.
ABSTRACT: THROMBOSIS PRE AND POSTDIAGNOSIS OF ESSENTIAL THROMBOCYTEMIA: IMPLICATION IN SURVIVAL
Background: Thrombosis may precede or present after the diagnosis of Essential Thrombocythemia (ET), conditioning the patients' survival.
Objetive: To analyze the number of thromboses before and after the diagnosis of ET and to assess its impact on survival.
Material and Methods: Retrospective study of patients with ET diagnosed between the years 2000 and 2022 inclusive. Demographic, clinical and biological variables were collected at diagnosis as well as the presence of thrombosis prior to or after this diagnosis. We analyzed the overall survival of patients with thrombosis prior to the diagnosis of ET or after the diagnosis.
Results: We evaluated 198 patients, 117 women (59%) and 81 men (41%) with an average age of 66.01 (± 15.66). Regarding the driver mutation, 150 patients (75%) had JAK2, 31 (16%) CALR, 9 (5%) MPL, and 8 (4%) were triple negative. Before ET diagnosis, 36 (18%) had had a thrombosis and 17 (9%) a thrombosis after diagnosis. 54 (27%) patients died during the study period. The survival analysis revealed that the appearance of thrombosis after the diagnosis of ET decreases survival.
Conclusions: Thrombosis after the diagnosis of ET decreases survival (p 0.004). However, thrombosis prior to the diagnosis of essential thrombocythemia does not modify survival
KEY WORDS: Essential Thrombocytemia, thrombosis, survival
INTRODUCCION
Las neoplasias mieloproliferativas crónicas Philadelfia negativa (NMPc) engloban clásicamente a las siguientes patologías: Policitemia vera, Trombocitemia esencial (TE) y Mielofibrosis primaria.
Los pacientes diagnosticados de NMPc pueden presentar una complicación trombótica anterior al diagnóstico hematológico pero en ocasiones esta complicación es el debut de la hemopatía. Así mismo, un evento trombótico puede aparecer en la evolución posterior, es decir tras el diagnóstico.
La aparición de una trombosis puede condicionar la supervivencia de estos pacientes pues ocasiona un aumento de la morbimortalidad.
Presentamos un estudio en el que se analiza la presencia de trombosis diagnosticada previamente o de forma posterior al diagnóstico de Trombocitemia esencial y la implicación de esta complicación en la supervivencia de estos pacientes.
MATERIAL Y MÉTODOS
Se trata de un estudio observacional, unicéntrico, que incluyó pacientes diagnosticados de Trombocitemia Esencial entre los años 2000 y 2022 en nuestro centro.
Para el análisis, se recogieron variables demográficas como la edad en el momento del diagnóstico de la neoplasia mieloproliferativa crónica, el sexo y, variables biológicas tales como información respecto al tipo de mutación conductora o driver que presentaban los pacientes: JAK2, calreticulina (CALR) y receptor de la trombopoyetina (MPL).
Así mismo, se recogieron variables clínicas como la presencia de trombosis previa a este diagnóstico o tras el mismo y se incluyeron los episodios tanto venosos como arteriales. Se analizó la supervivencia de los pacientes desde el diagnóstico de la Trombocitemia esencial hasta diciembre de 2022 valorando la implicación de la trombosis previa al diagnóstico o tras el mismo.
Toda la información referente al estudio de incluyó en una base de datos en formato excel que permitió su exportación posterior al programa estadístico SPSS con el que se realizó el análisis de los resultados. Los datos se procesaron mediante el software estadístico OBM SPSS 19 con un intervalo de confianza del 95%.
Se realizó un análisis descriptivo de la muestra aportando medias (desviación estándar), medianas (rango intercuartílico), frecuencia (porcentaje) según las características y distribuciones de las variables.
Posteriormente se realizó un análisis de supervivencia mediante el método de Kaplan-Meier y utilizando el long test para ver la diferencia entre los grupos.
El estudio fue presentado al Comité de Ética de la Investigación con medicamentos del área de Burgos y Soria y obtuvo su aprobación. Todos los pacientes aceptaron participar en el estudio y se obtuvo la firma del consentimiento informado.
RESULTADOS
Se evaluaron 198 pacientes de los cuales 117 (59%) fueron mujeres y 81 (41%) hombres con una edad promedio de 66,01 años (± 15,66).
En cuanto a la mutación driver señalar que 150 (75%) pacientes tenían la mutación JAK2, 31 (16%) la CALR, 9 (5%) la MPL y 8 (4%) fueron triple negativos.
Antes del diagnóstico de TE, 36 (18%) pacientes habían tenido una trombosis y 17 (9%) presentaron una trombosis después del diagnóstico.
Los datos demográficos se muestran en la siguiente tabla (Tabla 1).
El grupo de pacientes que presentó una trombosis previa al diagnóstico (36 casos) la localización de la trombosis fue la siguiente:
Se objetivó una trombosis arterial en 27 (75%) casos distribuidos de la siguiente manera: 17 presentaron un accidente cerebrovascular, 7 cardiopatía isquémica, 1 amaurosis fugax, 1 isquemia arterial periférica y 1 infarto de miocardio asociado a accidente isquémico transitorio.
Una trombosis venosa se observó en 7 (25%) casos: 3 tromboembolismo pulmonar, 3 trombosis venosa profunda y 1 trombosis peneana.
Dos pacientes presentaron trombosis tanto arterial como venosa: en un caso una trombosis venosa profunda asociada a trombosis de la arteria central de la retina y en otro paciente, un accidente cerebrovascular asociado a trombosis venosa profunda junto con tromboembolismo pulmonar.
De los 17 pacientes (9%) que presentaron una trombosis después del diagnóstico de TE señalar que la localización de la trombosis fue la siguiente: 10 (59%) casos de trombosis arterial distribuidos de la siguiente manera: 5 accidente cerebrovascular, 3 cardiopatía isquémica, 1 trombosis de la arteria central de la retina y 1 trombosis de la arteria iliaca y femoral común.
En 5 (41%) pacientes la manifestación trombótica fue venosa: 2 trombosis venosa profunda, 1 tromboembolismo pulmonar, 1 trombosis venosa profunda asociada a tromboembolismo pulmonar y 1 trombosis portal.
Reseñar que 2 pacientes presentaron una complicación trombótica tanto arterial como venosa: un caso de accidente cerebrovascular asociado a tromboembolismo pulmonar y un caso de trombosis venosa profunda junto con trombosis arterial del dedo de pie
Por tanto, el tipo de evento más frecuente fue el accidente cerebrovascular en el 42% de los casos, encontrándose en el 90% de éstos la mutación driver JAK2.
De los 53 (27%) pacientes que presentaron un evento trombótico, el 87% (46 pacientes) portaban la mutación JAK2, el 5% (3 pacientes) tenían la mutación CALR, el 4% (2 pacientes) eran MPL mutado y un 4% (2 pacientes) eran triple negativo.
En el período de estudio, desde el año 2020 al 2022, fallecieron 54 (27%) pacientes. La causa del fallecimiento fue: 18 (33,3%) por infección (5 de los cuales fue por SARS-CoV-2), 8 (14,8%) por neoplasia, 9 (16,7%) por insuficiencia cardíaca, (14,8%) por trombosis (trombosis mesentérica, tromboembolismo pulmonar, trombosis portal, infarto agudo de miocardio, accidente cerebrovascular e isquemia arterial periférica en miembros inferiores en 3 casos), 4 (7,4%) por progresión a mielofibrosis (2 casos) y a leucemia aguda (2 casos), 3 (5,6%) por hemorragia ((hemorragia subdural y 2 hemorragias intraparenquimatosas), 3 (5,6%) por insuficiencia renal y 1 (1,8%) de causa desconocida.
En las siguientes gráficas se muestra la supervivencia de los diferentes grupos con las curvas de Kaplan-Meier:
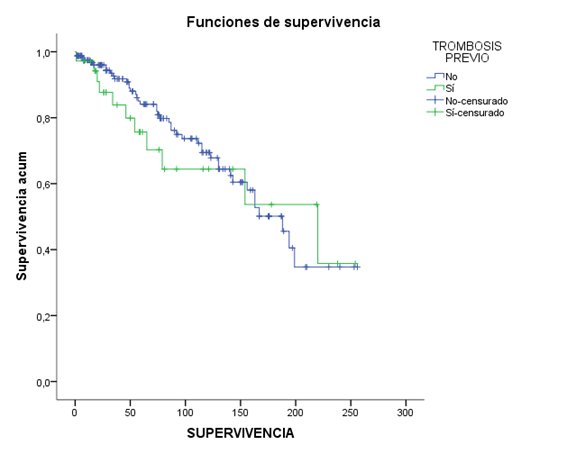
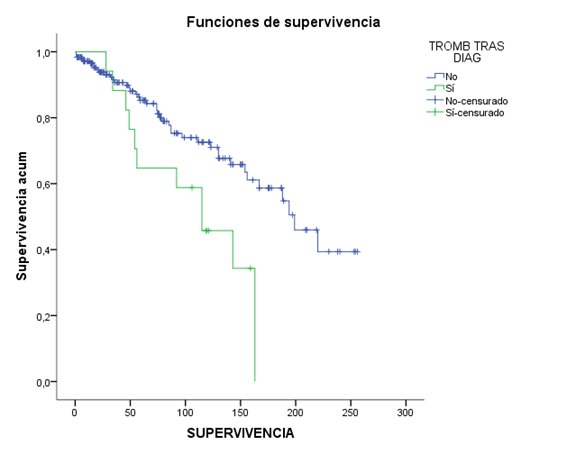
En la siguiente tabla se expresa la supervivencia total (en meses).
DISCUSIÓN
En ocasiones el diagnóstico de la TE es casual ante el hallazgo de una trombocitosis en un hemograma solicitado de rutina pero, en otras ocasiones el debut de la neoplasia mieloproliferativa crónica es una complicación trombótica arterial o venosa.
Los pacientes con TE presentan hasta en el 85% de los casos alguna de las mutaciones conductoras o driver; así, la mutación V617F de JAK2 aparece en el 55-60% de los casos, la mutación en calreticulina (CARL) en el 20-25% y la mutación en el gen receptor de la trombopoyetina en el 5%. Cuando no se detecta ninguna de estas mutaciones hablamos de TE triple negativa1.
En nuestra población la distribución de la mutación driver fue la siguiente: 75% (150 pacientes) tenían la mutación JAK2, 16% (31 pacientes) la mutación de CALR, 5% (9 pacientes) la mutación MPL y 4% (8 pacientes) fueron triple negativos.
La presencia de mutaciones JAK2 es un factor de riesgo independiente de trombosis incluso en pacientes con cifras hemoperiféricas normales. Es de destacar que los pacientes con TE JAK2 positivo presentan un mayor riesgo de trombosis en comparación con los pacientes CALR positivo o pacientes triple negativos.
La mutación en CALR puede ser de tipo 1 (deleción 52-bp) o tipo 2 (inserción de 5-pb). La tipo 1 se ha asociado con un menor riesgo de trombosis; sin embargo, no se han observado diferencias en el riesgo de trombosis arterial entre ambas mutaciones2.
Hay se reseñar que entre los 53 pacientes que presentaron un evento trombótico, el 87% (46 pacientes) portaban la mutación JAK2, el 5% (3 pacientes) la mutación CALR, el 4% (2 pacientes) eran MPL mutado y un 4% (2 pacientes) eran triple negativo.
Además, el tipo de evento trombótico más frecuente fue el accidente cerebrovascular que se presentó en 22 (42%) casos, encontrándose en el 90% de éstos la mutación driver JAK2.
Las complicaciones trombóticas se relacionan con una tasa importante de morbilidad y mortalidad en pacientes con neoplasias mieloproliferativas crónicas (NMPc). Se ha descrito que factores como la edad y la presencia de comorbilidades cardiovasculares, facilitan la aparición de complicaciones trombóticas. Así, a medida que aumenta la edad, el riesgo de trombosis en estos pacientes es mayor3.
La contribución de factores de riesgo cardiovascular tales como hipertensión arterial, tabaquismo, hipercolesterolemia y diabetes está bien establecida en la génesis de la trombosis en las NMPc4.
En particular estos factores han sido ampliamente estudiados en pacientes con TE lo que ha permitido el diseño de un índice pronóstico de riesgo trombótico llamado "índice IPSET". Éste incluye la edad y la presencia de trombosis previa además de la existencia de la mutación JAK2 junto con la presencia de los factores de riesgo cardiovascular y permite clasificar a los pacientes en 3 grupos pronósticos. El riesgo anual de trombosis sería del 1,03% para el bajo riesgo, del 2,35% para el grupo de riesgo intermedio y 3,56% para el grupo de alto riesgo5.
Se ha propuesto que la trombocitosis puede contribuir a la aparición de complicaciones trombóticas y se sugieren dos mecanismos principales implicados: la activación plaquetaria relacionada con la señalización dependiente de JAK-2 en megacariocitos y el segundo mecanismo, supondría la interacción de las plaquetas con su microambiente (con los neutrófilos mediante la formación de NETs (trampa extracelular de neutrófilos), con los monocitos que expresan factor tisular y secretan citoquinas y, con las células endoteliales)6.
La leucocitosis se ha descrito como factor de riesgo de trombosis tanto por el aumento de las cifras como por la presencia de alteraciones cualitativas en los leucocitos tales como una mayor expresión de la integrina de membrana CD11b, de la fosfatasa alcalina leucocitaria y del contenido celular de elastasa7.
Además, se describen otros parámetros que explicarían la hipercoagulabilidad en pacientes con neoplasias mieloproliferativas crónicas como la presencia de otras mutaciones CHIP como TET2, DNMT3A y ASXL1, la existencia de micropartículas procoagulantes, la activación endotelial y la neoangiogénesis6.
Dentro de las manifestaciones clínicas asociadas a alteraciones isquémicas en la microvasculatura encontramos: cefalea, dolor torácico atípico, alteraciones visuales (amaurosis fugax, escotomas), parestesias acras, decoloración digital, livedo reticularis y eritromelalgia.
Un estudio en 13.436 pacientes con NMPc demostró que es más frecuente que los pacientes desarrollen trombosis arterial que venosa. Dentro de las primeras estarían el accidente cerebrovascular isquémico y la isquemia coronaria siendo la trombosis venosa profunda la manifestación más frecuente en la trombosis venosa8.
Otras manifestaciones trombóticas bien conocidas son la trombosis venosa superficial, trombosis venosa profunda, el tromboembolismo pulmonar y trombosis venosa en lugares inusuales. Así, la prevalencia de la trombosis venosa abdominal en estos pacientes con NMPc varía del 1% al 23% siendo del 13% para la TE9.
En las trombosis de la venas hepáticas (síndrome de Budd-Chiari) y la trombosis de la vena porta que no están relacionadas con una cirrosis o con un tumor sólido, las NMPc son la causa subyacente más habitual: en un 41% en el primer caso y de un 32% en el segundo10.
En nuestro estudio en el grupo de pacientes con una trombosis previo al diagnóstico de TE, la trombosis arterial (75% de los casos) fue más frecuente que la trombosis venosa (25%).
El accidente cerebrovascular constituyó el 63% de las trombosis arteriales. En el caso de la trombosis venosa, el tromboembolismo pulmonar y la trombosis venosa profunda supusieron el 85% de los casos. Con respecto a los pacientes que presentaron una trombosis después del diagnóstico de TE, la trombosis arterial supuso el 59% casos y como en el grupo anterior, el accidente cerebrovascular agrupó al mayor número de casos (50%).
La complicación trombótica venosa en este grupo apareció en el 41%, de los cuales la trombosis venosa profunda y el tromboembolismo pulmonar supusieron el 80% de los eventos. Además, 2 pacientes de cada grupo presentaron una complicación trombótica arterial y trombótica de manera conjunta.
El tratamiento de la TE tiene como objetivo disminuir el riesgo de trombosis por lo que las diferentes guías estratifican a los pacientes en diferentes grupos de riesgo en base a la edad y el antecedente de trombosis previa al diagnóstico de TE. (1). Estas recomendaciones pretenden disminuir la morbimortalidad de esta patología. En nuestro estudio hasta un 14, 8% de los pacientes fallecieron a causa de una trombosis. Señalar que todos los pacientes tras el diagnóstico de TE recibían ácido acetil salicílico (AAS) o tratamiento con fármacos anticoagulantes y, a pesar de este tratamiento desarrollaron una trombosis.
Nuestro estudio refleja la importancia del seguimiento de los pacientes diagnosticados de TE puesto que requieren un exhaustivo control del tratamiento tanto antiagregante o anticoagulante como citorreductor en aras a la disminución de la posibilidad de la aparición de una trombosis.
Así mismo, es necesario el control de los factores de riesgo cardiovascular que pueden incidir negativamente y facilitar la aparición de la trombosis. Todo ello redundará en una menor morbilidad y una mayor supervivencia de los pacientes con TE.
FINANCIACIÓN:
Este estudio obtuvo financiación para su ejecución de la Fundación Burgos por la Investigación de la Salud.
REFERENCIAS
1.- Barbui T, Barosi G, Birgegard G, Cervantes F, Finazzi G, Griesshammer M, Harrison C, Hasselbalch HC, Hehlmann R, Hoffman R, Kiladjian JJ, Kröger N, Mesa R, McMullin MF, Pardanani A, Passamonti F, Vannucchi AM, Reiter A, Silver RT, Verstovsek S, Tefferi A; European LeukemiaNet. Philadelphia-negative classical myeloproliferative neoplasms: critical concepts and management recommendations from European LeukemiaNet. J Clin Oncol. 2011; 29(6): 761-770.
2.- Pérez Encinas MM, Sobas M, Gómez-Casares MT, Abuin Blanco A, Noya Pereira MS, Raya JM, Andrade-Campos MM, Álvarez Larrán A, Lewandowski K, ?ukasz S, Hernández Boluda JC, Ferrer-Marín F, Fox ML, Go?os A, Gasior Kabat M, Magro Mazo E, Czy? A, Martín Martín A, Bellosillo Paricio B, Quinteiro García C, González Martín JM, Stuckey R. The risk of thrombosis in essential thrombocythemia is associated with the type of CALR mutation: A multicentre collaborative study. Eur J Haematol. 2021; 106(3): 371-379.
3.- Barbui T, Finazzi G, Falanga A. Myeloproliferative neoplasms and thrombosis. Blood. 2013; 122(13): 2176-2184.
4.- Jantunen R, Juvonen E, Ikkala E, Oksanen K, Anttila P, Ruutu T. The predictive value of vascular risk factors and gender for the development of thrombotic complications in essential thrombocythemia. Ann Hematol. 2001; 80(2): 74-78.
5.- Barbui T, Finazzi G, Carobbio A, Thiele J, Passamonti F, Rumi E, Ruggeri M, Rodeghiero F, Randi ML, Bertozzi I, Gisslinger H, Buxhofer-Ausch V, De Stefano V, Betti S, Rambaldi A, Vannucchi AM, Tefferi A. Development and validation of an International Prognostic Score of thrombosis in World Health Organization-essential thrombocythemia (IPSET-thrombosis. Blood. 2012; 120(26): 5128-5133.
6.- Papageorgiou L, Elalamy I, Vandreden P, Gerotziafas GT. Thrombotic and Hemorrhagic Issues Associated with Myeloproliferative Neoplasms. Clin Appl Thromb Hemost. 2022; 28: 10760296221097969.
7.- Falanga A, Marchetti M, Evangelista V, Vignoli A, Licini M, Balicco M, Manarini S, Finazzi G, Cerletti C, Barbui T.. Polymorphonuclear leukocyte activation and hemostasis in patients with essential thrombocythemia and polycythemia vera Blood. 2000; 96 (13): 4261-4266.
8.- Rungjirajittranon T, Owattanapanich W, Ungprasert P, Siritanaratkul N, Ruchutrakool T. A systematic review and meta-analysis of the prevalence of thrombosis and bleeding at diagnosis of Philadelphia-negative myeloproliferative neoplasms. BMC Cancer. 2019; 19(1): 184.
9.- Gangat N, Wolanskyj AP, Tefferi A. Abdominal vein thrombosis in ET: prevalence, clinical correlates and prognostic implications. Eur J Haematol. 2006; 77(4): 323-333.
10.- Smalberg JH, Arends LR, Valla DC, Kiladjian JJ, Janssen HL, Leebeek FW. Myeloproliferative neoplasms in Budd-Chiari Syndrome and portal vein thrombosis: a meta-analysis. Blood. 2012; 120(25): 4921-4928.
CORRESPONDENCIA:
María Victoria Cuevas
Servicio de Hematología-Hemoterapia.
Hospital Universitario de Burgos
Avda. de las Islas Baleares, 3
09006, Burgos. ESPAÑA
Mail: mvcuevas @ hubu.es
