Indice del volumen Volume index
Comité Editorial Editorial Board
Comité Científico Scientific Committee
EXCRECION FRACCIONAL DE UREA BAJA EN HIPONATREMIA INDUCIDA POR HIPOTIROIDISMO
Musso CG, Macías Núñez JF*, Imperiali N, Algranati L.
Servicio de Nefrología - Hospital Italiano de Buenos Aires (Argentina) y
* Servicio de Nefrología - Hospital Universitario de Salamanca (España)
Rev Electron Biomed / Electron J Biomed 2005;1:68-71
Comentario del revisor, Prof. Hélio Teixeira. Titular y libre docente del Departamento de Clínica Médica, Universidade Federal de Uberlândia, Uberlândia (MG), Brazil
Comentario del revisor Prof. Jeyaraj Balasubramaniam. Resident Director. Kidney Care Centre. Tirunelveli. Tamilnadu, India.
ABSTRACT
Hypothyroidism can cause disturbance of renal hemodinamics, kidney histology, water and electrolyte metabolism, being hyponatremia and glomerular filtration reduction their low prevalent but most significant consequences. All these changes are largely corrected by substitution of exogenous thyroid hormone.
Fractional excretion of urea (FEU) is a useful index in the evaluation of hyponatremia. However, it was not still reported in the literature the FEU value in hyponatremia induced by hypothyroidism. Because of that we presented a case report showing that the value of FEU and fractional excretion of sodium (FENa) were low (FEU: 29%) and high (FENa: 2.2 %) respectively in a severe hypothyroid patient. Treatment based on thyroid hormone normalized both indeces.
RESUMEN:
El hipotiroidismo puede causar alteraciones del metabolismo del agua, los electrolitos, la hemodinamia e histología renales, siendo la hiponatremia y la reducción del filtrado glomerular sus consecuencias más significativas, pero poco prevalentes. Todos estos cambios son corregibles con el suministro de hormona tiroidea exógena.
La excreción fraccional de urea (EFU) es un índice útil en la evaluación de la hiponatremia, pero no se ha descripto aun el valor que este índice alcanza en la hiponatremia inducida por hipotiroidismo. En el presente reporte mostramos que la EFU y excreción fraccional de sodio (EFNa) fueron baja (EFU: 29%) y alta (EFNa: 2.2%) respectivamente en un paciente que padecía hipotiroidismo severo. El tratamiento con hormona tiroidea normalizó el valor de ambos índices.
INTRODUCCIÓN
El hipotiroidismo puede causar alteraciones del metabolismo del agua, los electrolitos, la hemodinamia e histología renales, siendo la hiponatremia y la reducción del filtrado glomerular sus consecuencias más significativas, pero de baja prevalencia. Todos estos cambios son corregibles con el suministro de hormona tiroidea exógena1.
Uno de los puntos principales en la evaluación de la hiponatremia es determinar el estado del volumen extracelular (VEC). Sin embargo, esta evaluación no siempre es fácil de hacer clínicamente, especialmente cuando se desea distinguir entre un VEC normal y uno ligeramente contraído2.
La excreción fraccional de urea (EFU) es un índice útil en la evaluación de la hiponatremia, siendo su valor elevado (EFU > 65%) en la hiponatrtemia con VEC normal, y bajo (EFU ‹ 35%) en los estados de hipoperfusión renal tales como la hiponatremia con VEC alto o bajo3.
Sin embargo, no se ha reportado aun en la literatura el valor de la EFU en la hiponatremia inducida por hipotiroidismo. Por esta razón reportamos un caso describiendo el valor de la EFU en esta entidad y analizamos sus posibles bases fisiopatológicas.
Caso Clínico
Paciente sexo masculino, 77 años de edad que fue derivado al servicio de nefrología para evaluación de su insuficiencia renal: creatininemia 2 mg/dl (valor normal en hombres: 0.6 - 1.3 mg/dl) e hiponatremia: natremia 133 mmol/l (valor normal 135-145 mmol/l). Este paciente tenía una historia previa de:
- 1) Gota recurrente tratada con alopurinol 300 mg/día
2) Hipertensión arterial tratada con dieta hiposódica y atenolol 50 mg/día
3) Reemplazo valvular aórtico bilógico hace 4 años.
En la primera entrevista el paciente presentaba muchos signos y síntomas compatibles con hipotiroidismo tales como cansancio, edema de aspecto mixedematoso, piel seca, voz ronca, bradipsiquia y caída de la cola de las cejas. Todos estos hallazgos eran de larga evolución.
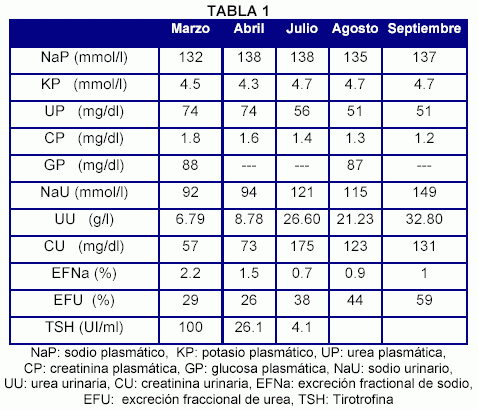
Desde el punto de vista bioquímico, presentaba TSH: 100 UI/ml (valor normal hasta 4 UI/ml), glucemia, colesterolemia total, triacilgliceridemia, albuminemia, hemoglobinemia y creatinfosfoquinasa sérica normales.Los anticuerpos antitiroideos eran negativos. El sedimento urinario mostró ausencia de proteinuria, hematuria y cilindros. La ecografía de cuello no mostró bocio. Luego de haberse confirmado el hipotiroidismo se inició el reemplazo hormonal con dosis bajas de hormona tiroidea (25 mcg/dia), siendo dicha dosis aumentada progresivamente hasta que el paciente quedó tratado con 150 mcg/día durante seis meses. En aquel momento el paciente había normalizado la mayoría de sus signos y síntomas de hipotiroidismo, su natremia y sus niveles plasmáticos de TSH (4 UI/ml). También se documentó una mejoría significativa en su función renal: la creatininemia posterior al reemplazo hormonal llegó a ser de 1.2 mg/dl.
Dado que la urea, creatinina, sodio y potasio fueron medidos en plasma y orina antes y después del remplazo hormonal la excreción fraccional de estas sustancias fue calculada. Se observó que antes de la sustitución hormonal el paciente tenía una EFU baja (29%) y una EFNa alta (2.2%) mientras que luego de la sustitución hubo un aumento en la EFU y una reducción en la EFNa respecto de los valores iniciales (Tabla 1).
DISCUSIÓN
Al menos uno de los siguientes componentes es necesario para desarrollar hiponatremia: un balance positivo de agua libre o un balance negativo de sodio4.
La hiponatremia inducida por hipotiroidismo es clásicamente descripta como secundaria a un mecanismo similar al del sindrome de secreción inadecuada de hormona antidiurética (SIDHA)5. Sin embargo algunos autores consideran que la bases fisiopatológicas de la hiponatremia inducida por hipotiroidismo no han sido aun comprendidas6, de hecho hay mucha evidencia en contra de la hipotesis de un mecanismo simil- SIDHA para explicar esta entidad.
Veamos algunos de estos hechos:
1) El SIDHA característicamente cursa con EFU elevada. Incluso, se ha propuesto que durante esta entidad existe secreción de urea, lo cual explicaría por qué muchos pacientes con SIDHA presentan una EFU mayor del 100%7. Por el contrario, en estudios con ratas hipotiroideas se ha documentado una reducción en la excreción de urea8. Así por ejemplo el paciente por nosotros reportado tenía una EFU baja (29%) antes del reemplazo hormonal que luego normalizó tras el suministro de hormona tiroidea (EFU: 59%) (Tabla 1). Este cambio en el valor de la EFU podría ser interpretado como una mejoría el la perfusión renal producto de una reducción en la vasoconstricción intra-renal e incremento en la capacidad reabsortiva de sodio.
2) Pacientes portadores de SIDHA se supone que poseen niveles elevados de vasopresinemia2. Sin embargo, no todos los pacientes con hiponatremia inducida por hipotiroidismo poseen vasopresinemia elevada9.
3) La eficiencia de la vasopresina está reducida en los pacientes hipotiroideos debido a su menor tonicidad medular, la cual conduce a una menor concentración urinaria y poliuria10.
Este fenómeno ha sido atribuído a una disminución en la reabsorción de sodio en la rama ascendente de Henle8. Incluso estudios llevados a cabo en modelos de hipotiroidismo en animales han demostrado bajos niveles de canales de acuaporina y receptores V2 para vasopresina en los túbulos colectores8,11.
Toda la evidencia antes presentada va en contra de un mecanismo simil-SIDHA como inductor de hiponatremia secundaria a hipotiroidismo.
Otros dos mecanismos parecieran cruciales en la generación de hiponatremia secundaria a hipotiroidismo: la presencia en estos pacientes de una alteración del clearance de agua libre y de un balance negativo de sodio.
Por un lado, el bajo clearance de agua libre podría ser generado por la reducida oferta de sodio a los sectores diluctores nefronales10,12. Este fenómeno podría ser secundario al bajo gasto cardíaco, la hipofiltración glomerular y la vasoconstricción intra-renal siempre presente en el paciente hipotiroideo8,12,13. Sin embargo, la tendencia a una elevada pérdida tubular proximal de sodio sufrida por estos pacientes podría minimizar el impacto final de este mecanismo. Por otra parte, hay un trabajo de investigación que demostró en hipotiroidismo la existencia de una disminución de la reabsorción de sodio en la rama ascendente de Henle, situación que afecta el clearance de agua libre pues es allí donde éste se genera8. Aunque un estudio en ratas no encontró cambios en el número de transportadores luminales de sodio de dicho segmento nefronal, ello no significa que su función esté preservada11.
Por otra parte, hay un aumento de la pérdida renal de sodio en los pacientes hipotiroideos14.
Se ha reportado que ratas recibiendo drogas antitiroideas conjuntamente con una dieta deficiente en sal murieron rapidamente a raiz del balance hidrosalino negativo. Uno de los mecanismos generadores de la alteración en la capacidad tubular reabsortiva de sodio es la menor actividad de la Na-K-ATPasa en los túbulos proximales y colectores documentada en animales hipotiroideos. Sin embargo, ha sido demostrado que la menor actividad de la bomba Na-K-ATPasa no sería la única causa de la pérdida tubular de sodio en el hipotiroidismo. También es importante la influencia de la hormona tiroidea en el funcionamiento de los 2 mayores transportadores de sodio del túbulo proximal: el intercambiador Na/H tipo 3 y el cotransportador Na-Fosfato tipo 2.8,11,14.
Además, la hormona tiroidea tiene un rol permisivo sobre la acción de la aldosterona. Esta es otra razón que justificaría la reducida capacidad reabsortiva de sodio en los estados hipotiroideos11.
En nuestro paciente observamos que cuando estaba hipotiroideo su EFNa era alta (EFNa: 2.2%), estando incluso bajo una dieta hiposódica. Luego de iniciar el reemplazo hormonal este índice alcanzó valores más bajo (EFNa 0.9%). Esto podría ser interpretado como reflejo de una recuperación de la capacidad reabsortiva de sodio después del suminitro de hormona tiroidea.
Nuestro paciente era además un anciano, y si bien ha sido descripto que en la gente anciana hay una tendencia a la pérdida tubular de sodio15, desde el momento que esta pérdida se resolvió luego de iniciarse el tratamiento con la hormona tiroidea, pareciera entonces que la pérdida de sodio estaba más relacionado con la endocrinopatía.
A pesar de haber en el paciente hipotioroideo una importante pérdida de sodio y un espacio intravascular contraído, el contenido total de sodio está incrementado y redistribuído especialmente en el compartimento intersticial9. Esto se debe al hecho de que los pacientes hipotiroideos poseen una fuga de proteínas (albúmina) desde el espacio intravascular al intersticial, y al mismo tiempo poseen una baja remoción de proteinas por parte del sistema linfático desde el intersticio. En consecuencia hay un aumento de la presión oncótica en el compartimento intersticial que atrae localmente al sodio y al agua resultando en el edema no depresible característico del hipotiroidismo y conocido como mixedema16.
Todo las modificaciones expuestas anteriormente conducen a un aumento del sodio urinario, reducción del volumen intravascular, expansión del compartimento intersticial, lo cual podría explicar la combinación de una elevada EFNa con una baja EFU en la hiponatremia secundaria a hipotiroidismo.
CONCLUSIÓN:
La excreción fraccional de urea pareciera ser baja en la hiponatremia inducida por hipotiroidismo.
Un aclaramiento de agua libre reducido y una alta pérdida de sodio podrían ser las bases fisiopatológicas de este tipo de hiponatremia.
REFERENCIAS
-
1.- Makino Y, Fujii T, Kuroda S, Inenaga T, Kawano Y, Takishita S. Exacerbation of renal failure due to hypothyroidism in a patient with isquemia nephropathy. Nephron 2000; 84: 267-269.
2.- Kokko JP. Disorders of fluid volume, electrolyte, and acid-base balance. In Bennet C, Plum F (Eds). Cecil Textbook of Medicine. Philadelphia. W.B. Saunders Company.1996: 534-537
3.- Bazerque F. 'Hypoosmolar and hyperosmolar syndroms'. In Pacin J, Dubin A, Gallesio A, Laffaire E, Maskin B, San Roman E (Eds). 'Intensive Care'. Buenos Aires. Panamericana. 1995: 369-384.
4.- Halperin ML, Goldstein MB. Hyponatremia. In Halperin ML, Goldstein MB (Eds). Fluid, electrolyte, and acid-base physioloy. Philadelphia. W.B. Saunders Company. 1999: 283-328.
5.- Dillmann W. The thyroid. In Bennet C, Plum F (Eds). Cecil Textbook of Medicine. Philadelphia. W.B. Saunders Company.1996:1237-1239
6.- Rose BD, Post TW. Hyposmolar syndromes. In Rose BD, Post TW (Eds). Clinical physiology of acid-base and electrolyte disorders. Madrid. Marbán. 2002: 710
7.- Bankir L. Urea and the kidney. In Brenner BM (Ed). The kidney. Philadelphia. W.B. Saunders company.1996: 571-606
8.- Cadnapaphornchai MA, Kim YW, Gurevich AK, Summer SN, Falk S, Thurman JM, Schrier R. Urinary concentrating defect in hypothyroid rats: role of sodium, potasium, 2-chloride co-transporter, and aquaporins. J Am Soc Nephrol 14: 566-574, 2003
9.- Wooddrow G, Brownjohn AM, Turney H. Acute-on-chronic renal failure and hyponatrremia associated with severe hyponatremia. Nephrol Dial Transplant 8: 557-559, 1993
10.- Rossi N, Schrier R. Hyponatremia. In Maxwell MH, Kleeman CR, Narins RG. (Eds). Clinical disorders of fluid and electrolyte metabolism. Buenos Aires. Panamericana. 1991: 417
11.- Schmitt R, Klussmann E, Kahl T, Ellison D, Bachmann S. Renal expression of sodium transporters and aquaporin-2 in hypothyroid rats. Am J Physiol 284: F1097-1104. 2003
12.- Nakahama H, Sakaguchi K, Horita Y, Sasaki O, Nakamura S, Inenaga T, Takishita S. Treatment of severe hypothyroidism reduced serum creatinine levels in two chronic renal failure patients Nephron 2001; 88: 264-267
13.- Kreisman S, Hennessey JV. Consistent reversible elevations of serum creatinine levels in severe hypothyroidism. Arch Intern Med 1999; 159: 79-82
14.- Shah M, Quigley R, Baum M. Maturation of proximal straight tubule NaCl transport: role of thyroid hormone. Am J Physiol Renal Physiol 278: F596-F602, 2000
15.- Musso C. Geriatric nephrology and the "nephrogeriatric giants". International Urology and nephrology 34:255-256, 2002
16.- Rose BD, Post TW. Edematous states. In Rose BD, Post TW (Eds). Clinical physiology of acid-base and electrolyte disorders. Madrid. Marbán. 2002: 484
Comentario del revisor Prof. Hélio Teixeira.
Titular y libre docente del Departamento de Clínica Médica, Universidade Federal de Uberlândia, Uberlândia (MG), Brazil
Traducción del original
La fracción de excreción de urea (EFU) es un marcador importante de la perfusión renal en personas con la función renal normal y un índice útil para distinguir la insuficiencia renal aguda pre-renal y parenquimatosa. Los autores presentan el caso clínico de un varón hipertenso de 77 años, con gota, hipotiroidismo, función renal disminuida e hiponatremia.
Inicialmente, la fracción de excreción de urea (EFU) era baja (29%) mientras que la fracción de excreción de sodio (EFNa) era alta (2,2%). En una publicación, la EFU estaba por debajo del 50% en la mayoría (el 82%) de los pacientes depleccionados de sal con la función tiroidea normal y, curiosamente, así estaba en el 48% de pacientes con síndrome de secreción inadecuada de hormona antidiurética (SIADH). Pero en todos los pacientes depleccionados de sal y casi la mitad de los pacientes de SIADH, la EFNa estaba por debajo del 0,5% (Int Urol Nephrol. 2001;32:475-93). Los autores sugieren que, en este paciente, el hipotiroidismo por sí mismo - y no el SIADH - es responsable de la excesiva pérdida urinaria de sal y de la hiponatremia.
Después del reemplazo terapéutico de la hormona tiroidea hubo una disminución significativa de la creatinina plasmática, con normalización del sodio plasmático, de la EFU y de la EFNa. Los autores concluyen que la hiponatremia en pacientes con hipotiroidismo se debe al aclaramiento de agua libre y al aumento de la pérdida tubular de sodio. Es una teoría elegante, pero creo que tenemos que considerar que muchos cambios en la función renal, relacionados con el envejecimiento, están presentes en este caso, además del hipotiroidismo. Así pues, se requiere la evaluación de un mayor número de pacientes similares para clarificar mejor los mecanismos intrínsecos de la pérdida tubular de sal que pueden presentar tales pacientes.
Comentario del revisor Prof. Jeyaraj Balasubramaniam.
Resident Director. Kidney Care Centre. Tirunelveli. Tamilnadu, India.
Traducción del original
El Dr. Musso hace un serio intento de aclarar la causa de la hiponatremia en el hipotiroidismo. En el caso que presenta, se argumenta de forma convincente que la causa de la hiponatremia no es una situación semejante al del síndrome de secreción inadecuada de hormona antidiurética, como generalmente se acepta, basándose en índices renales como los delas fracciones de excreción de sodio y urea. Habría sido conveniente elegir un caso del hipotiroidismo sin fallo renal o restricción dietética de sodio. La presencia de estos dos factores extratiroideos dificulta la generalización de las conclusiones a todos los casos de hipotiroidismo.
Recibido, 18 de enero de 2005.
Publicado, 9 de febrero de 2005
